儿茶酚胺能神经元与鸣禽鸣唱行为和听觉信息处理
2014-04-29刘少艺李东风
刘少艺 李东风
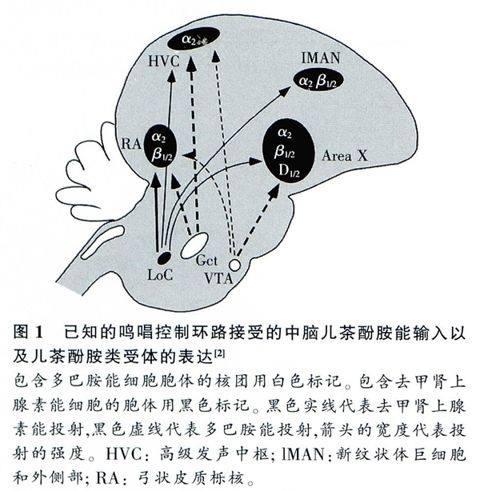
摘要:鸣禽脑部的一些呜唱核团与听觉核团接受来自中脑儿茶酚胺(catecholamine,CA)能神经元发出的纤维投射,并且存在多种儿茶酚胺类受体的表达。研究发现在不同的鸣唱环境下,中脑儿茶酚胺能神经元活性及其支配靶区即早基因的表达水平均存在显著差异。表明中脑儿茶酚胺能神经元在调节呜唱行为和听觉信息处理等方面发挥重要作用。介绍了近年来有关儿茶酚胺能神经元活动与鸣唱行为和听觉信息处理的研究进展。
关键词:儿茶酚胺能神经元;鸣唱;听觉;多巴胺;去甲肾上腺素
中图分类号:Q495
文献标识码:A
文章编号:1007-7847(2014)03-0250-05
鸣禽的鸣唱与人类的语言学习类似,都是一种习得性行为。鸣禽的发声依赖于脑部一系列离散分布的核团形成的两条重要通路,即发声运动通路和前端脑通路[1]。
儿茶酚胺能系统是鸣禽脑部一类非常重要的神经递质系统,主要释放儿茶酚胺类递质。而根据具体释放递质的不同主要分为去甲肾上腺素(noradrenaline, NE)能神经元和多巴胺(dopamine,DA)能神经元。研究发现儿茶酚胺能神经元胞体在鸣禽中脑有广泛的分布,并且发出大量的纤维支配鸣唱相关核团(图1)和一些听觉核团,而在一些鸣唱核团和听觉核团中也发现有大量儿茶酚胺类受体的分布,如α肾上腺素能受体、多巴胺Dl和D2受体等[2]。酪氨酸羟化酶(tyrosine hydroxy-lase,TH)作为儿茶酚胺合成的关键酶可以标定出儿茶酚胺能系统的分布,而多巴胺-β-羟化酶(dopamine beta hydroxylase,DBH)作为NE合成的关键酶,可以标定出NE能神经元的分布。研究发现,NE能神经元的胞体主要分布在蓝斑核(lo-cus coeruleus,Loc)和蓝斑下核(subceruleus nu-cleus,SC),而其发出的投射主要支配前脑鸣唱控制核团,HVC、RA、X区、1MAN等,也有纤维投射到听觉信息处理相关核团,巢状皮质背内侧区(caudomedial nidopallium,NCM)和旧皮层背中部区(caudomedial mesopallium, CMM)、卵原核、L区、HVC壳区及RA杯区等。DA能神经元的胞体主要位于腹侧被盖区(ventral tegmental area, VTA)、黑质致密部(substantia nigra pars compacta,SNc)和中脑中央灰质(midbrain central gray,GCt)。其中GCt主要投射到HVC和RA,VTA主要投射到X区,而对其他的鸣唱和听觉核团也有部分投射[3,4]。
1儿茶酚胺能细胞组调节鸣禽鸣曲
1.1NE参与调节鸣禽鸣曲
NE调节鸣禽鸣曲的学习主要表现在3个方而。一是NE系统的发育与鸣曲发育是平行的。随着鸣曲不断发育成熟,NE的含量和功能发挥都不断趋于成熟;二是NE可以调节与鸣曲学习相关核团的突触传递。鸣禽RA核团的研究发现,在幼鸟和成鸟中NE的注入都可以显著性地降低1MAN-RA的突触输入强度,但是对于HVC-RA的突触输入没有影响。在幼鸟中NE可以抑制RA侧枝对于RA投射神经元的突触联系,但在成鸟中没有发现,并且这种作用主要是通过α2肾上腺素能受体介导[5],因此NE可以影响到达RA突触输入的平衡,而这种平衡将会极大地影响幼鸟鸣曲的发育;三是NE还可以影响鸣禽对于教习曲模板的记忆。鸣禽记忆教习曲模板是鸣曲学习十分关键的一步。以往的研究表明,NCM和CMM区是教习曲记忆的储存位点。而NE的受体阻断剂可以扰乱NCM神经元中的即早基因表达以及对于鸣曲的应答[6]。这些结果都表明,NE可以从不同的方面影响鸣禽鸣曲的学习。
NE对于鸣曲的产生同样有重要的调节作用。鸣禽鸣曲的产生与所处的社会环境息息相关。而研究已经表明,NE对于这种环境依赖性鸣曲的产生具有重要的调节作用。中脑NE能细胞组及其支配的鸣唱核团中即早基因zenk的表达存在显著的差异,在求偶鸣唱时表达较高,表明在求偶时这些核团有更高的活性[7]。另外NE还可以通过调节鸣唱相关神经元的兴奋性影响鸣曲的产生。尤其是对前运动核团RA的研究更证实了这一点。RA位于鸣唱运动通路的重要位置,直接参与鸣曲的产生。研究发现,NE通过α2肾上腺素能受体显著降低RA神经元的白发放频率,增加RA神经元的电导。即使在阻断突触输入后,NE的这种效应依然存在。以上结果都表明NE参与调节鸣曲的学习以及环境依赖性的鸣曲产生。
1.2DA参与调节鸣禽鸣曲
中脑DA能神经元发出最为稠密的纤维支配前脑X区,而X区的DA浓度和受体分布与其他核团相比也是最多的。这些都说明DA对X区活动有着重要的调节作用。而研究发现X区对于环境依赖性鸣曲的产生是必须的[8]。Kubikova等[9]在研究了鸣禽脑DA受体的表达后指出,DA受体在X区的分布存在共定位的现象,在同一神经元上可能有多种DA受体的分布,这就为DA更加精确的调节鸣曲提供了结构基础。在不同社会环境下,DA可能是激活不同的DA受体,因而造成了X区神经元兴奋性的差异。在求偶鸣唱时中腑VTA-SNc的活性较高,释放更多的DA,而高浓度的DA更易于结合D2受体,降低X区的兴奋性。而非求偶时则是低水平的DA结合Dl受体,提高兴奋性,这与求偶鸣唱时X区zenk表达较低是,致的。Bosikova等[10]研究了X区的DIA、DIB和D2受体mRNA的表达与斑胸草雀鸣曲特征的相关性,发现鸣曲的一些量化指标,比如鸣曲的数目、主题曲的持续时间、不同主题曲音节的数目与X区和周围纹状体区域中的DA受体表达没有相关性。但是鸣曲的平均精确度却与DIA受体的表达水平呈现负相关关系。鸣曲的顺序匹配则是与X区D2受体的表达水平呈现正相关关系。而这些都表明DA受体的密度和分布与鸣曲的可变性密切相关。Leblois等[11]的研究则认为X区的Dl受体对于呜曲的频谱特性的调节发挥更为重要的作用。因为发现Dl受体的阻断使环境依赖性的鸣曲谐波可变性消失。但是鸣曲的鸣唱速度并不受Dl受体阻断的影响。因此可能Dl受体仅仅涉及环境依赖性的鸣曲声学特征,但是对于鸣唱速度和鸣曲结构没有调节作用。这些结果均表明,DA参与调节鸣曲很大程度上依赖于其结合的受体,受体分布的差异与发挥功能的不同直接影响了鸣唱核团的兴奋性,进而影响了不同社会环境下呜曲的产生。
2儿茶酚胺能细胞组调节鸣禽听觉信息处理
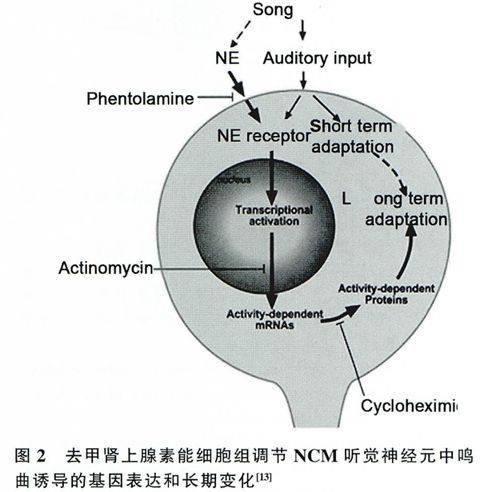
鸣禽听觉信息的处理涉及到一系列听觉核团形成的听觉通路。而研究发现CA能细胞组可以在各个水平支配脑部听觉通路,比如中脑、前脑和丘脑等。幼鸟在听到教习曲时,中脑儿茶酚胺能细胞出现了c-fos的诱导表达[12]。也有研究发现在15min的同类雄性鸣曲刺激下,磷酸化酪氨酸羟化酶(phosphorylated tyrosine hydroxylase,pTH)在听觉前脑有显著的增加。而在30min的刺激后,两种DA代谢物即苯乙酸和高香草酸在前脑增加[6]。这些结果表明CA能神经元参与听觉信息处理。NE对于NCM神经元的基因表达和鸣曲长期记忆都是必须的。α肾上腺素能受体阻断剂的局部应用可以阻断NCM区神经元的基因表达,但是并不影响其神经元白发和诱发动作电位。因此NE可能通过影响基因表达参与调节鸣曲听觉记忆(图2)[13]。NE可能是通过α受体作用于NCM神经元,影响一系列的转录因子的表达,进而影响鸣曲长期记忆需要的蛋白表达,最终影响鸣曲的听觉记忆。加入NE受体的阻断剂酚妥拉明、转录水平的抑制剂放线菌素以及翻译水平抑制剂放线菌酮均可以阻断NCM神经元的基因表达,最终影响鸣曲的听觉记忆而在雌性金丝雀的研究中发现,注入NE能神经元毒素DSP-4后,金丝雀对于鸣曲的应答急剧下降,而听到鸣曲时Loc中的CA能细胞zenk表达高于没有听到鸣曲的雌性斑胸草雀[7]。在听到同类鸣曲时,NCM和CMM有更高zenk蛋白表达,但是在毒素处理后这种差异性的表达在NCM背侧和CMM消失。并且在毒素处理组中zenk表达比对照组显著降低。利用功能磁共振技术也发现DSP-4的注入使得背侧NCM对于自鸣曲的选择性消失,这就说明NE参与调节听觉信息处理[7]。有趣的是,在哺乳动物中NE调节听觉主要是通过β受体[14],而鸣禽却主要是通过α受体发挥作用,这可能是由于物种差异或者脑区差异所致。
综上所述,儿茶酚胺能细胞组调节鸣禽听觉信息处理主要是通过影响听觉核团尤其是NCM和CMM的活性,进而影响这些区域对于各种鸣曲的识别与记忆。在众多的声音中区分出同伴的声音将有助于群体活动及社会信息交流。而对自鸣曲的识别将有助于其根据不同的社会环境调节自己的鸣曲,而对于异性鸣曲的识别更是与其求偶和繁殖行为相关。
3儿茶酚胺能细胞组参与感觉运动整合
儿茶酚胺能细胞组既参与鸣唱行为的调节也参与听觉信息的处理,因此也为我们研究儿茶酚胺如何参与感觉信息整合提供了优良的模型。
越来越多的证据表明,DA主要通过动机和奖赏机制来进行感觉运动的整合[15,16]。鸣禽可以根据听到的鸣曲种类不断地调节自己的发声。在听到异性鸣曲时,强烈的求偶动机使得鸣禽DA能神经元活动增强,释放更多的DA到达鸣唱相关核团,调节鸣曲特征,产生求偶性鸣唱。而在听到同种鸣曲时,同样可以激活DA能系统,然后通过影响鸣唱相关核团,调节鸣曲的产生,更好地进行信息的交流。而听到自鸣曲时,DA能神经元的激活将影响X区的神经元活性,而X区作为前端脑通路的重要组成部分,将在听觉反馈的指导下,进行自鸣曲与教习曲的比较,不断地调节鸣曲,使得逐渐匹配教习曲模板。
NE进行感觉运动整合的方式不同于DA。NE更多的是参与调节鸣禽鸣唱的不同状态,而且低浓度可能更有效。鸣禽在清醒时NCM区NE水平含量低于睡眠中的鸣禽,并且在听到自鸣曲时NE含量会进一步的下降,但是正是低浓度的NE水平才使得NCM对于自鸣曲有更大的反应,这就有利于鸣禽在睡眠时不受到声音的干扰,更好地记忆鸣曲。而在清醒时可以更好地进行自鸣曲与教习曲的比对,进而调整自己的发声[17]。有研究指出,NE可以对听觉核团进行抑制,比如界面核(Nif)[4]。最近的研究发现NCM区神经元存在局部的延迟现象。而这种延迟使得神经元更好地应答习得性和自然的声音,并在听觉反馈的指导下调节发声行为[18]。
综上所述,我们不难发现儿茶酚胺系统参与鸣禽感觉运动整合。DA和NE通过不同的方式将听觉信息进行整合,在听觉反馈的指导下,调节鸣唱核团的活性,最终调节自己的发声以适应不断变换的外界环境。
4NE与DA的相互作用
关于NE和DA在神经系统中的各自作用已经得到广泛的证实。但是对于两者之间相互作用关系的研究却很少。而近些年无论在鸣禽还是哺乳类研究中都发现在结构和功能方面两者均存在重要的相互作用。DA是NE的前体物质,DA可以向NE转化。多巴胺能神经元分布区域与NE能神经元分配区域存在一定程度的交叉与重叠,更为两者相互作用提供了结构基础。更为重要的是,研究发现VTA和LoC之间有相互投射,并且在VTA刺激可以增加LoC区的NE含量,而在LoC刺激可以增加VTA中的DA含量[19]。NE转运体不仅可以转运NE,也可以转运DA。尤为关键的是,两者在受体层面上也可以相互作用。DA可以结合到NE受体上,NE也可以结合到DA受体上[2,20]。DA与NE之间的这种相互作用为鸣禽更加精确地调节不同环境下的鸣曲提供了条件。
中脑CA能系统发出广泛的投射支配鸣禽鸣唱控制通路和听觉通路。正是这种投射的存在使得CA能细胞组可以在不同水平调节鸣禽鸣唱行为和听觉信息处理。而这种调节作用的存在使得鸣禽可以适应不断变换的环境,更好地生存与繁衍。但是目前来看我们对于CA能系统的研究还不完善,还有许多工作需要展开。
首先需要进一步地深入研究CA对于鸣唱核团中突触功能的影响。目前的研究局限在某些特定的核团中,比如DA对于鸣唱系统的影响主要集中在X区,NE的研究集中在RA和NCM区。但是对于其他鸣唱核团则缺乏必要的关注;其次,我们要着眼于鉴定CA对于鸣唱相关基因表达产物的影响。对于即早基因这类基因的研究将为我们提供神经元活性的标记物,为我们发现在不同刺激条件下发挥重要作用的具体CA能投射来源带来突破。同时我们也要将CA能系统的研究放在更为具体的社会行为中,利用更为科学的动物模型和实验设计探究CA能系统对于特定社会行为的调节作用。最为重要的是,我们有必要进一步的研究儿茶酚胺在感觉运动信息整合中发挥的重要调节作用,鸣禽是如何利用NE和DA进行听觉信息处理,进而指导特定环境下鸣曲的产生。而这些问题的解决无疑为我们更好地认识感觉运动整合机制带来突破。
参考文献(References):
[1]BRAINARD M S.DOUPF, A J.Translating birdsong:songbirdsas a model for basic and applied medical research[J]. AnnualReview of Neuroscience, 2013,36:489-517.
[2]CORNILC A,CASTELINOC B.BALL G F.Dopamine bindsto alpha (2)-adrenergic, receptors in the song control system ofzebra finches (Taeniopygia guttata)[J].Journal of ChemicalNeuroanatomy, 2008, 35(2):202-215.
[3]LYNCH K S.DIEKAMP B.BALL C F Catecholaminergic cellgroups and vocsl communication in m male songbirds[J]. PhysiologyBehavior, 2008, 93(4-5):870-876
[4]CASTELINO C B,SCHMIDT M F.What birdsong can teachus about theCentral noradrenergic system?[J]. Journal Chemi-cal Neuroanatomy, 2010, 39(2):96-111.
[5]SIZEMORE M,PERKEL D J.Noradrenergic and GABA Breceptor activation differentially modulate inputs to the premotornucleus RA in zebra finches[J]. Journal of Neurophysiology, 2008,100(1):8-18.
[6]MATRAGRANO L L, BEAULIEU M, PHILLIP J O, et al.Rapid effects of hearing song on catecholaminergic activity inthe songbird auditory pathway[J]. PLoS ONE, 2012, 7(6):e39388.
[7]LYNCH K S. DIEKAMP B, BALL G F. Colocalization of im-mediate early genes in catecholamine cells after song exposurein female Zebra Finches(Taeniopygia guttata)[J]. Brain Behav-ior Evolution, 2012, 79(4):252-260.
[8]LEBLOIS A. Social modulation oflearned behavior by dopaminein the basal ganglia: Insights from songbirds[J]. Journal of Ph-ysiology Paris, 2012, 107(3):219-229.
[9]KUBIKOVA L. WADA K, JARVIS E D. Dopamine receptorsin a songbird brain[J]. Journal of Comparative Neurology, 2010,518(6):741-769.
[10]BOSIKOVA E KOSTAL L, CVIKOVA M, et al. Song-relateddopamine receptor regulation in Area X of zebra finch male[J].General Physiology Biophysics, 2012, 31(3):291-298.
[ll]LEBLOIS A, WENDEL B J, PERKEL D J. Striatal dopaminemodulates Basal ganglia output and regulates social contexl-DepenDent behavioral variability through Dl receptors[J]. Jour-nal of Neuroscience, 2010, 30(16):5730-5743.
[12]NORDEEN E J, HOLTZMAN D A, NORDEEN K W. In-creased Fos expression among midbrain dopaminergic cellgroups during birdsong Lutoring[J]. European Journal of Neuro-science, 2009, 30(4):662-670.
[13]VELHO T A, LU K, RIBEIRO S, et al. Noradrenergic, controlof gene expression and long-term neuronal adaptation evokedby learned vocalizations in songbirds[J]. PLoS ONE, 2012, 7(5):e36276.
[14]MCINTYRE C K, MCGAUGH J L, WILLIAMS C L. Interact-ing brain systems modulate memory consolidation[J]. Neurosci-ence Biobehavior Review, 2012, 36(7):1750-1762.
[15]RITERS L V. The role of motivation and reward neural sys-tems in vocal communication in songbirds[J]. F'rontiers in Neu-roendocrinology, 2012, 33(2):194-209.
[16]KUBIKOVA L, KOSTAL L. Dopaminergic system in birdsonglearning and maintenance[J]. Journal of Chemical Neuroanato-my, 2010, 39(2):112-123.
[17]POIRIER C, BOUMANS T, VELLEMA M, et al. Own song se-lectivity in the songbird auditory pathway: suppression hynorepinephrine[J]. PLoS ONE, 2011, 6(5):e20131.
[18]THOMPSON J V, JEANNE J M, GENTNER T Q. Local inhi-bition modulates learning-dependent song encoding in thesongbird auditory cortex[J]. Journal of Neurophysiology, 2013,109(3):721-733.
[19]MEJIAS-APONTE C A, DROUIN C, ASTON-JONES G. A-drenergic and noradrenergic innervation of the midbrain ven-tral tegmental area and retrorubral field: prominent inputs frommedullary homeostatic centers[J]. Journal of Neuroscience, 2009,29(11):3613-3626.
[20]ROMINGER A, MILLE E, BONING G, et al. alpha2-adrener-gic drugs modulate the binding of [18F] fallypride to dopamineD2/3 receptors in striatum of living mouse[J]. Synapse, 2010, 64(8):654-657.
