水环境中有机碳循环的重要驱动力—噬茵体
2014-04-29季秀玲林连兵张琦魏云林
季秀玲 林连兵 张琦 魏云林

摘要:随着气候温暖化问题日益突出,维持全球碳平衡成为人类可持续发展的关键。在超过地球表面70%的水环境中,生物有机碳循环是所有元素循环中最重要的一环。噬菌体的分布十分广泛,且含量丰富,其丰度可达106~108/mL,仅海洋噬菌体的总量即可达l030个。噬菌体在维持生物有机碳循环中贡献巨大,据估算经由海洋病毒完成的可溶性有机碳就达到全球碳循环的26%。主要针对噬菌体在海洋、湖泊、冰尘穴及湿地有机碳循环的作用进行了综述。
关键词:水环境;噬菌体;碳循环;可溶性有机碳
中图分类号:Q939.48
文献标识码:A
文章编号:1007-7847(2014)03-0269-06
水环境面积约占地球表面的71%,可分为海洋、湖泊、河流等,是众多生物赖以生存的一类重要生态系统。在这个生态系统中碳循环是其中非常重要的一环,它支配着系统中其它物质的循环,也深刻影响着人类的生存环境,因此碳循环研究是生态系统能量流动的核心问题。目前的研究结果表明,在水环境的碳循环中除了化学平衡、物理泵参与了碳循环外,生物泵也是必不可少的一个重要环节,在生物泵环节中病毒尤其是噬菌体的重要作用逐步为人所知[1~4]。
病毒广泛分布于地球的各种生境中[1~4],它们不仅影响着宿主的生存状况和进化历程[5,6],而且通过裂解宿主快速释放有机碳而影响着系统中其他物质循环和能量流动[7,8]。当前,病毒(尤其是噬菌体)在维持可溶性有机碳(dissolved organic car-bon,DOC)平衡中的作用已成为生态学、微生物学和海洋生物学等研究领域关注的热点,其最新研究成果及评论纷纷登载在诸如NATURE、SCI-ENCE等国际著名学术刊物上[9~13]。
本文针对噬菌体在海洋、湖泊、冰尘穴及湿地有机碳循环中的作用进行简单介绍。
1噬菌体在海洋有机碳循环中的作用
海洋是地球上最大的碳库,含碳量为大气的50倍,生物圈的15倍,同时海洋还对调节大气中的含碳量起着非常重要的作用。由于海洋储碳对于应对全球变暖具有重要意义,生物泵储碳过程研究已成为近30年来海洋碳循环研究的焦点之一:海洋中的有机碳更主要的是以溶解有机碳(dissolved organic carbon,DOC)形式存在的,从过滤分离角度看,DOC占总有机碳的95%。病毒是海洋中数量和种类最多的生物,总量约l030个,是海洋微生物群落的重要组成部分,在全球生态系统调控、生物地球化学循环,特别是碳循环中具有重要的作用,也是一类不可忽视的战略生物资源。
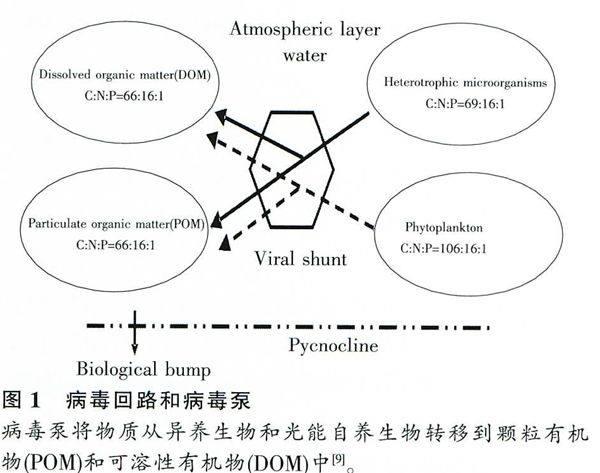
“微食物环”是指海洋中溶解性有机物被异养浮游细菌摄取形成微生物型次级生产量,进而又被原生动物和桡足类所利用的微型生物摄食关系,海洋病毒主要通过“微食物环”介导了这一过程中的物质循环和能量流动。病毒通过裂解浮游植物和异氧细菌加速了颗粒性有机物(POM)向可溶性有机物(DOM)的转化,从而影响海洋系统的物质循环;而噬菌体半衰期很短,其死亡后又会形成溶解态的营养物质,在“微食物环”中形成一个“病毒回路(viral shunt)”,加快碳、氮等元素在微生物间的循环(图1)[9]。因此,噬菌体导致的细菌溶解成为初级生产者与消费者参与C、N循环最重要的途径之一[14]。
Shuttle等[9]在研究海洋病毒作用时发现:作为物质和能量流动的枢纽,病毒可以将碳和其他营养物质分流到可溶性有机物中。水体沉积物能较好保存环境中的有机物质存在信息,为探索古气候变化、追踪有机质来源、了解生态系统状况等提供了重要的线索。Danovaro等[10]对大西洋、南太平洋、地中海海底沉积物及覆水病毒的生态功能进行研究时发现:在深海沉积物中由于病毒的感染和裂解可以促使原核生物量减少80%以上,而在超过1000m深度时甚至可接近100%,将大量可溶性有机碳释放到深海中,从而大大缩短该生态系统的食物链,加快有机碳的循环和使用效率。在海洋中近70%的蓝藻和60%的游离异养菌及淡水中90%~l00%的细菌裂解死亡与病毒(噬菌体)密切相关[15,16]。据统计地球上约26%的有机碳循环是由海洋病毒完成的[l7,18]。因此海洋病毒直接或间接参与陆地生物碳循环、海洋碳固定以及大气间的碳交换[19]。
Evans等[20]测定了2007年夏季塔斯马尼亚岛亚南极带(SAZ)和澳大利亚南极海极前锋带(PFZ)的病毒丰度及病毒裂解产物总量。南极洋由两个明显的区域——亚南极带(SAZ)和极地前锋带(PFZ)组成:SAZ的硅酸盐、叶绿素含量低,而且是大气中CO2的碳汇,PFZ为低温、低盐、高营养盐和低叶绿素含量。结果发现:病毒感染导致的细菌裂解生物量在SAZ和PFZ西部很接近,分别为23.5%和23%,每天可溶性有机碳的释放量为3.3μg/L和2.3μg/L;而在SAZ东部,病毒感染导致的细菌裂解生物量可达39.7%,每天可溶性有机碳释放量为26.5μg/L。这些数据表明在SAZ和PFZ这些相互分割的区域中,病毒感染导致细菌裂解释放的可溶性有机碳是碳循环的重要途径。由于SAZ是大气中主要的CO2碳汇[21],因此对于研究病毒对碳循环的影响是很有意义的。Evans等对南极洋不同区域的裂解性和溶原性噬菌体的感染进行了调查,研究表明病毒感染导致细菌裂解每天释放的碳为0.02~7.5μg/L,病毒活性是满足微生物,尤其是威德尔海原核生物和SAZ浮游生物基本需求的主要贡献者[22]。
因此,病毒尤其是噬菌体在海洋生物地球化学循环尤其是碳循环和深海代谢方面扮演了重要角色。
2噬菌体在湖泊有机碳循环中的作用
噬菌体在海洋及其沉积物中的功能及作用,并不一定能反映其在大陆环境中的功能与作用。湖泊作为连接陆地与淡水环境的自然综合体,不仅是多种沉积矿藏赋存的场所,而且与大气、生物、上壤等多种要素密切相关,对气候、环境系统的变化史为敏感。
鉴于噬菌体对内陆湖泊日益重要生态功能的凸显,近年对大江(河)、湖泊(淡水及咸水)的噬菌体、细菌及其与DOC关系的研究也逐步受到人们的关注。Thomas等[23]对法国Bourget湖泊的病毒生态学功能展开了研究,发现病毒通过裂解每天释放的碳和磷分别可达56.5μg/L和1.4μg/L,这些有机质成为了浮游细菌营养需求的重要来源。在南极寡营养湖(Druzhby湖和Crooked湖)中,噬菌体裂解导致的细菌死亡率极高,可达251%,而释放的DOC为总DOC的0.8%~69%,其比率会随季节变化有所不同,在黑暗的冬季,病毒裂解造成的有机碳的释放量对总DOC的贡献率超过60%[24]。Fischer等[16]对多瑙河地区富营养湖泊中噬菌体及细菌数量关系的研究中发现:噬菌体感染而导致细菌裂解释放的碳为每天5~39μg/L,其中有29%~79%的有机碳能被细菌再利用,重新进入微生物环。因此病毒在湖泊中具有重要生态作用,尤其是细菌溶解产生的有机C的流动和再同化。
由此可见,虽然湖泊生态系统复杂,但病毒尤其是噬菌体在有机碳循环中同样扮演着非常重要的角色。
3噬菌体在冰尘穴有机碳循环中的作用
大陆上约10%的土地为冰川所覆盖,其中1%~6%被冰尘所沾染,冰川表面的无机和有机颗粒等统称为冰尘[25,26],而冰尘穴(croconite holes)就是指被冰尘沾染后导致冰川溶解后形成的圆柱形冰融水洞。冰尘穴广布于冰川及其消融地带,如南极、北极、格陵兰岛、加拿大、西藏和喜马拉雅山脉等。由于冰尘的颜色较深,使得冰尘穴吸收的太阳射线也随之增加,促进了冰雪的融化,形成季节性的融水洞[27](图2)。当然,冰尘穴并不仅仅局限于大陆冰川,海洋冰川和湖泊冰川同样有冰尘穴的存在。
冰尘穴是在冰川生态系统中生命活动最活跃的栖息地,据估算仅北极冰川冰尘沉积物中生物含量就可达36g/m2。谢菲尔德大学、布里斯托尔大学和因斯布鲁克大学研究团队的学者发现格陵兰岛、斯瓦尔巴群岛和阿尔卑斯山冰尘穴中的微生物丰度甚至可与温带地区普通生态系统相当[25,26,28,29],比如每克冰尘中的微生物丰度与地中海每克土壤中的微生物丰度几乎是一致的,冰尘穴中的微生物主要包括病毒、细菌和微观植物。Sawstrom研究组也得到同样的研究结果,他们在研究北极冰川斯瓦尔巴特群岛Midre Lovenbreen冰尘穴中微生物时发现冰尘中的细菌丰度远高于冰尘穴中上覆水的细菌丰度。冰尘中细菌丰度为4.67×104/mL~7.07xl04/mL,是上覆水细菌丰度的2~6倍;其噬菌体的丰度规律也与细菌丰度类似[30]。Midtre Love-nbreen冰川冰尘穴上覆水和冰尘中病毒的丰度分别为0.6xl06/mL和20x106mL[31]。斯瓦尔巴特群岛冰尘穴噬菌体感染而导致细菌裂解比例(约l3%)远高于常温水域中噬菌体对细菌的裂解率(2%)[32]。因此,该研究团队认为:随着冰川的消退、融化,生物扮演的角色越来越重要。
冰尘中微生物的定殖加深了冰表而的颜色,其原因在于冰尘穴中的光合作用率远高于呼吸作用率,净吸收CO2,是一种负反馈机制,因此冰川表面能不断累积有机质,形成自我维持的生态系统,吸收的太阳射线进一步增加,促进冰的溶解,为微生物生长提供了必需的水份,并通过物理和生物活动将水和有机质进一步分散到冰川的其他部分,促进了微生物、有机质和碎屑转移到周边(如冰川底部),促进了其他生态系统的生命活动[26]。
冰尘穴中的光合作用率高于呼吸作用率,从而可以维持高的细菌种群丰度,而许多湖泊的光合作用低于呼吸作用,使得它们必须接收外源有机物质的输入才能得以维持平衡。从光合作用率分析,普通冰川融水的光合作用率为每小时释放碳0.60~8.33μg/L,而斯瓦尔巴特群岛MidreLovenbreen冰尘的光合作用率最高可达到每小时释放碳156.99μg/L,冰尘穴中上覆水的光合作用率则与普通冰川差不多[30]。考虑到冰尘穴的密度(约6%的冰川表面积或每m2 12个洞),那么可以确定冰尘微生物相关的碳固定和营养物质代谢是冰川生态系统物质循环的一个重要环节。
对于较简单封闭的生物地球化学微循环系统,如南极麦克马多干河谷冰川的冰尘穴,那里仅含有水、冰、矿物和有机碎屑,但也能长期维持微生物种群结构的平衡;Bagshaw等[33]系统研究了其中溶解物随季节变化而产生的化学演变过程。通过对DIC、DOC、K+和SO42-的检测发现:冰尘穴中DOC的产生速率为每年释放碳0.75μg/cm2,冰尘中代谢初级产物的溶解、周期性沉淀、次级碳酸盐的溶解、夏季的净光合作用和秋季冰冻时期净呼吸作用是左右冰尘穴中季节性变化和年溶解浓度的主要过程。
通过对格陵兰和阿尔卑斯山冰尘穴中微生物(噬菌体、细菌和藻类等)进行的研究表明:仅该地区微生物每年释放的有机碳就高达6400t[34]。所以在冰川生态系统中冰尘穴扮演着非常重要的角色。冰川覆盖了地球l5xl06km2的表面积,其生态系统同样对全球碳循环影响巨大。
因此,噬菌体感染而导致细菌裂解对冰尘穴生态系统中营养物质和有机质的循环起着重要作用。
4噬菌体在湿地有机碳循环中的作用
湿地狭义是指陆地与水域之间的过渡地带,广义上则被定义为地球上除海洋(水深6m以下)外的所有大面积水体。按照湿地的广义定义,它覆盖了地球表面的6%,却为地球上约20%的物种提供了生存环境,在维持全球生态系统平衡中具有不可替代的生态功能,享有“地球之肾”的美誉。湿地也是连接生物圈、大气圈、水圈、岩石(土壤)圈的重要纽带,位于陆生生态系统和水生生态系统之间的过渡性地带,具有独特的生态功能。
湿地是地球上能量流动和物质循环最活跃的场所,也是陆地DOC最大的储库。湿地面积虽只占陆地面积的2%~3%,但其储存的DOC却占到陆地土壤碳量的18%~30%[35]。在已知的湿地生态类型中,高原(或高纬度)湿地由于具有较高的生产力和较低的分解速率(由于温度较低所致),使之成为有机碳储备最丰富的碳库。我国科学家在对青藏高原和东北三江平原低温沼泽湿地释放的CO2/CH4观测研究中也发现其碳释放量巨大,并呈逐年上升的趋势,这充分表明高原(高纬度)湿地在全球碳循环中作用非常巨大[36,37]。然而,随着全球湿地的退化,其碳储备能力也正在下降,这一现象应该引起人们足够的重视。
湿地的储备的DOC往往通过季节性的融水或常年积水以及与小溪相连而向外部环境输出,DOC输出是湿地通过水文过程实现向土壤碳输出的一个主要途径。研究表明,在加拿大北部湿地,通过小溪迁移输出的溶解性有机物中,DOC大约为每年5~40g/m2[38]。湿地生态系统中的DOC是细菌及其他微生物养料的主要来源,DOC含量的变化将深刻影响湿地内所有微生物的生活及生长状况,而噬菌体不仅与细菌的活动密不可分,而且还可以通过裂解作用有效释放DOC进而影响湿地微生物的种群结构和组成,最终影响整个湿地生态系统的物质循环和能量流动。因此,探寻湿地中噬菌体、细菌与DOC的相互关系,也是未来研究的一个重要方向。
综上所述,病毒作为海洋中数量最多的生命粒子,一个重要的生态作用是作为其他微型生物的消费者,使得许多浮游生物细胞成为无内容物的“ghost”,同时把微生物POC转化为DOC,形成“病毒回路”,进而改变了海洋生态系统中物质循环和能量流动的途径,而病毒回路的存在可使系统中的呼吸和生产力较无病毒的系统高出约1/3 [39,40]。病毒尤其是噬菌体在在湖泊生态中对细菌溶解产生的有机C的流动和再同化过程起到重要生态作用。而在冰川生态系统中生命活动最活跃的栖息地一冰尘穴,噬菌体感染而导致细菌裂解对冰尘穴生态系统中营养物质和有机质的循环起着重要作用。所有的证据表明噬菌体在不同生态系统中对DOC的循环均起着举足轻重的作用,但在不同的系统中它们的贡献率和作用机制和调节方式又有着显著差异,因此,系统研究噬菌体在不同生态系统中对DOC的调节作用,将有利于全面理解和揭示噬菌体(病毒)在整个地球物质循环和能量流动中所起的作用。
5结语
水环境是人类社会赖以生存和发展的重要场所,碳循环的关键在于过程与机制,其中的生物过程机制是焦点之一。维持全球碳平衡的关键不应仪仅关注各个库的碳贮存总量,而应更多地研究碳的流向问题,以及“源”、“汇”不平衡的问题。噬菌体由于结构简单、基因组小、便于操作等优点,常常被用作生物基因复制及表达调控研究的模型,对近现代生物化学与分子生物学的发展做出了突出的贡献。尽管目前的研究已表明噬菌体广泛分布于各生境中,对全球的碳、氮循环均有重要影响,但对于噬菌体在水环境中的分布及生态功能方面的了解仍然非常有限。我国科学家开展了影响南海深海碳循环的底栖微生物氮营养盐补充过程和机制研究,以及南海水体中古菌的分布及生物地球化学功能的研究,但对水环境中噬菌体对有机碳循环的作用鲜有报道。昆明理工大学生命科学与技术学院对腾冲热海高温噬菌体和云南高原湖泊低温噬菌体多样性进行了研究,表明高温噬菌体和低温噬菌体均存在多样性,并对部分嗜极微生物噬菌体进行了全基因组解析和功能蛋白的高效表达及其热不稳定性分析,对云南高原湖泊低温噬菌体与有机碳循环的作用研究正在进行中。
对嗜极微生物噬菌体(尤其是嗜冷和嗜热微生物噬菌体)的研究有助于丰富人们对生命起源与进化、生命本质及环境适应策略的认识,而对嗜极微生物噬菌体中重要功能蛋白的开发与应用也将带来巨大的社会和经济效益。
参考文献( References):
[l]BETTAREL Y.SIME-NGANDO T,AMBLARD C,et al.Viralactivity in two contrasting lake ecosystems[J]. Applied and En-vironmental Microbiology, 2004,70(5):2941-2951.
[2]BREITBART M,ROHWER F.Here a virus, there a virus, ev-erywhere the same virus?[J]. Trends in Microbiology, 2005,13(6):278-284.
[3]ACKERMAN H W. 5500 Phages examined in the electron mi-croscope[J]. Archives of Virology, 2007, 152(2):227-243.
[4]SAWSTROM C, LISLE J, ANESIO A M, et al. Bacteriophagein polar inland waters[J]. Extrcmophiles, 2008, 12(2):167-175.
[5]SUTTLE C A. Viruses in the sea[J]. Nature, 2005, 437(7057):356-361.
[6]LOPEZ-BUENO A, TAMAMES J, VELAZQUEZ D, et al. Highdiversity of the viral community from an Antarctic lake[J]. Sci-ence, 2009, 326(5954):858-861.
[7]ANESIO A M, BELLAS C M. Are low temperature habitats hotspots of microbial evolution driven by viruses[J]. Trends in Mic-robiology, 2011,19(2):52-57.
[8]WEITZ J S, WILHELM S W. Ocean viruses and their effectson microbial communities and biogeochemical cycles[J]. F1000Biology Reports, 2012,(4):17.
[9]SUTTLE C A. Marine viruses--major players in the global e-cosystem[J]. Nature Reviews Microbiology, 2007, 5(10):801-812.
[10]DANOVARO R, DELL'ANNO A, CORINALDESI C,et al.Major viral impact on the functioning of benthic deep-sea e-cosystems[J]. Nature, 2008, 454(7208):1084-1087.
[11]ROHWER F,THURBER R V. Viruses manipulate the marineenvironment[J]. Nature, 2009, 459(7244):207-212.
[12]CHIARA S, LUCIANO N, ALFREDO S. DOC dynamics in themeso and bathypelagic layers of the Mediterranean sea[J].Deep-Sea Research II, 2010, 57(16):1446-1459.
[13]ZHANG R, WEINBAUER M G, TAM Y K, et al. Response ofbacterioplankton to a glucose gradient in the absence of lysis andgrazing[J]. FEMS Microbiology Ecology, 2013, 85(3):443-451.
[14]周玉航,潘建明,叶瑛,等.细菌、病毒与浮游植物相互关系及其对海洋地球化学循环的作用[J].台湾海峡(ZHOU Yu-hang, PAN Jian-ming, YE Ying, et al.Relationship betweenbacterium, virus and phytoplankton and their effects to geo-chemical cycling in ocean[J]. Journal of Oceanograaphy in TaiwanStrait), 2001, 20(3):340-345.
[15]FUHRMAN J A. Marine viruses and their biogeochemical andecological effects[J]. Nature, 1999, 399(6736):541-548.
[16]FISCHER U R, VELIMIROV B. High control of bacterial pro-duction by viruses in a eutrophic oxbow lake[J].Aquatic Micro-bial Ecoogy, 2002, 27(1):1-12.
[17]WEINBAUER M G. Ecology of prokaryotic viruses[J]. FEMS Mi-crobiology Reviews, 2004, 28(2):127-181.
[18]CORINALDESI C, DELL'ANNO A, MAGAANINI M, et al.Viral decay and viral production rates in continetal-shelf anddeep-sea sediments of the Medilerranean sea[J]. FEMS Microbi-ology Ecology, 2010, 72(2):208-218.
[19]DANOVARO R, CORiNALDeSI C, DELL'ANNO A, et al.Marine viruses and global climate change[J]. FEMS MicrobiologyReviews, 2011, 35(6):993-1034.
[20]EVANS C, PEARCE I, BRUSSAARD C P. Viral-mediated ly-sis of microbes and carbon release in the sub-Antarctic andPolar Frontal zones of the Australian Southern Ocean[J].Envi-ronmental Microbiology, 2009, 11(11):2924-2934.
[21]MARINOV I, GNANADESIKAN A, TOGGWEILER J R,et al.The Southern Ocean biobeochemical divide[J]. Nature, 2006, 441(7096):964-967.
[22]EVANS C, BRUSSAARD C P. Regional variation in lytic andlysogenic viral infection in the Southern Oman and its contribution to biogeochemical cycling[J]. Applied and EnvironmentalMicrobiology, 2012, 78(18):6741-6748.
[23]THOMAS R, BERDJEB L, SIME-NGANDO T, et al. Viralabundance, production, decay rates and life strategies (lysoge-ny versus lysis) in Lake Bourget (France)[J]. EnvironmentalMicrobiology, 2011, 13(3):616-630.
[24]SAWSTROM C, ANESIO A M, GRANELI W,et al.Seasonalviral loop dynamics in two large ultraoligotrophic Antarcticfreshwater lakes[J].Microbiology Ecology, 2007, 53(1):1-11.
[25]EDWARDS A, ANESIO A M. RASSNER S M, et al, Possibleinteractions between bacterial diversity, microbial activity andsupraglacial hydrology of cryoconite holes in Svalbard[J]. Inter-national Society for Microbial Ecology Journal, 2011, 5(1):150-160.
[26]ANESIO A M, MINDL B, LAYBOURN-PARRY J, et al. Viraldynamics in cryoconite holes on a high Arctic glacier (Svalbard)[J].Journal of Ceophysical Research, 2007, 112(G04S31):10.
[27]SHELLEY M, SEAN F. The formation and hydrological significance of cryoconite holes[J]. Progress in Physical Geography, 2008,32(6):595-610.
[28]FOUNTAIN A G, TRANTER M, NYLEN T H, et al. Evolutionof cryoconite holes and their contribution tomeltwater runofffromglaciers in the McMurdo DryValleys, Antarctica[J]. Journalof Glaciology, 2004, 50(168):35-45.
[29]PORAZINSKA D L, FOUNTAIN A G, NYLEN T H, et al. Thebiodiversity and biogeochemistry of cryoconite holes from Mc-Murdo Dry Valley glaciers, Antarctica[J]. Arctic Antarctic andAlpine Research, 2004, 36(1):84-91.
[30]SAWATROM C, MUMFORD P, MARSHALL W, et al. Themicrobial communities and primary productivity of cryoconitesholes in an Arctic glacier (Svalbard 79 degrees N)[J]. PolarBiology, 2002, 25(8):591-596.
[31]SAWATROM C. GRANELI W, LAYBOURN-PARRY J, et al.High viral infection rates in Antarctic and Arctic bacterio-plankton[J]. Environmental Microbiology, 2007, 9(1):250-255.
[32]HODSON A J, ANESIO A M, TRANTER M, et al. Glacial e-cosystems[J]. Ecological Monographs, 2008, 78(1):41-67.
[33]BACSHAW E A, TRANTER M, FOUNTAIN A G, et al. Bio-geochemical evolution of cryoconite holes on Canada Glacier,Taylor Valley, Antarctica[J]. Journal of Geophysical Research,2007, 112(G04S35):8
[34]ANESIO A M, HODSON A J,FRITZ A,et al.High microbialactivity on glaciers: importance to the global carbon cycle[J].Global Change Biology, 2009,15(4):955-960.
[35]SMITH L C,MACDONALD G M, VELICHKO A A,et al.Siberian peatlands a net carbon sink and global methanesource since the early Holocene[J]. Science, 2004, 303(5656):353-356.
[36]王德宣,丁维新,王毅勇若尔盖高原与三江平原沼泽湿地CH4排放差异的主要环境影响因素[J].湿地科学(WANG De-xuan, DING Wei-xin, WANG Yi-yong. Influence of major en-vironmental factors on difference of methane emission fromZoige plateau and Sanjiang plain wetlands[J]. Wetland Science),2003, 1(1):63-67.
[37]HIROTA M, TANG Y H Hu Q W, et al.Carbon dioxide dy-namics and controls in a deep-water wetland on the Qinghai-Tibetan plateau[J]. Ecosystems, 2006, 9(4):673-688.
[38]SHURPALI N J,VERMA S B,KIM J,et al.Carbon dioxideexchange in a peatland ecosystem[J]. Journal of Geophysical Re-search, 1995, 100(7):14319-14326.
[39]焦念志,海洋固碳与储碳一并论微型生物在其中的重要作用[J].中国科学:地球科学(JIAO Nian-zhi. Carbon fixation andsequestration in the ocean, with special reference to the mi-crobial carbon pump (in Chinese)[J]. Scientia Sinica Terrae),2012, 42(10):1473-1486.
[40]焦念志,张传伦,李超,等.海洋微型生物碳泵储碳机制及气候效应[J].中国科学:地球科学(JIAO Nian-zhi, ZHANCChuan-lun, LI Chao, et al.Controlling mechanisms and cli-mate effects of microbial carbon pump in the ocean (in Chi-nese[J]). Scientia Sinica Terrae), 2013, 43(1):1-18.
