滇龙胆GrHMA基因的克隆和原核表达
2014-04-29王彩云李富生李涛李彩霞张晓东王元忠
王彩云 李富生 李涛 李彩霞 张晓东 王元忠

摘要:HMA蛋白(heavy metal transporting ATPase)是一种在植物中广泛存在的多功能蛋白。根据滇龙胆转录组GrHMA基因序列,设计特异性引物,通过RT-PCR扩增GrHMA基因序列,并进行TA克隆、测序及序列分析;构建原核表达载体pGEX-4T-1-GrHMA,转入E.coli Rosetta(DE3)中,并在37℃、1.Ommol/L IPTG下成功诱导表达。序列分析表明,GrHMA基因是HMA超家族的成员;GrHMA氨基酸序列系统发育分析表明,CrHMA与TcHMA处于同一进化枝。SDS-PAGE结果表明所表达蛋白与预期蛋白大小一致。这些结果为GrHMA蛋白的进一步纯化及结构和功能的研究奠定基础。
关键词:滇龙胆;GrHMA基因;克隆;原核表达
中图分类号:Q786
文献标识码:A
文章编号:1007-7847(2014)03-0211-07
滇龙胆(Gentiana rigescens)为龙胆科(Gen-tianaceae)龙胆属多年生宿根草本植物,是我国特有物种,主要分布于云南、贵州、四川、广西等省,其中云南是主要产区。野外主要生长在海拔1100~3000m杂木林下、荒坡地、山谷灌木丛旁[1]。滇龙胆在云南有悠久的药用历史[2],被《中国药典》2010年版收录,为传统中药材龙胆的植物主要来源之一[3]。目前,国内外对滇龙胆的研究主要集中在栽培、农艺性状、化学成分研究、矿质元素测定等方面[4-6],而对滇龙胆的重金属转运蛋白及其逆境胁迫和抗性研究未见报道。
重金属ATP酶(heavy metal transporting AT-Pase,HMA),又称为P1B-ATPase,其能选择性地运输Cu+、Cu2+、Zn2+和CO2+等必须的金属离子,还能转运Cu2+、Cd22+和Pb2+等重金属离子[7];因其含有一个保守的内膜基序(CPx:Cys-Pro-Cys/His/Ser),又称为CPx-ATPase[8,9]。植物HMA除参与重金属离子的稳态外,还涉及植物对重金属的吸收、转运、解毒和富集等方面[10,ll]。HMA基因在植物中广泛存在,如在低等植物绿藻(Chlamydomonas rein-hardtii)中克隆到3个基因(CrHMA1~3),红藻(Cyanidioschizon merolae)中克隆到2个基因(CmHMA1,CmHMA2)。单子叶植物水稻(Oryzasativa)基因组中发现9个HMA基因(OsHMAl~9),大麦(Hordei vulgaris)中有10个HMA基因(HvHMAl-HvHMA10)[11~13]。于拟南芥(Arabidop-sis thaliana)中克隆到8个HMA基因(AtHMA l~8) [12,14],大豆(Glycine max)基因组中发现9个HMA基因(GmHMAl~GmHMA9)[15]。此外,Southron、Pa-poyan等16,17]从甘蓝型油菜(Brassica napus)克隆到了P1B-ATPase基因BnRANl(HMA7);Courbot等[18]从重金属Zn/Cd超富集植物鼠耳芥(Arabidopsishaller)中克隆到AhHMA4;Cobbett、Bernard等[8,19]从遏蓝菜(Thlaspi caerulescens)中克隆到TcHMA4基因。植物基因组中有多个HMA基因存在,其蛋白在植物的根、茎、叶和细胞中的叶绿体、内质网、高尔基体、液泡和质膜上均有定位[20]。根据重金属的底物特异性可以将P1B-ATPase分为两个亚类:Zn2+/CO2+/Cd2+/Pb2+P1B-ATPase(Zn亚类)和Cu+/Ag+P1B-ATPase(Cu亚类),其中动物只有Cu亚类[11,21]。植物中则包含这两个亚类,如拟南芥AtHMAl-4属于Zn亚类,而AtHMA5-8属于Cu亚类[21];水稻OsHMAl-OsHMA3属于Zn亚类,OsHMA4-OsHMA9属于Cu亚类[13]。
虽然HMA蛋白在植物中广泛分布,但目前的研究仍仅局限于拟南芥,在重金属超富集植物中没有进行系统全面的研究,而在药用植物滇龙胆中至今未有报道。本研究根据3年生滇龙胆的转录组中GrHMA基因序列设计特异性引物,从滇龙胆幼叶中提取RNA,反转录为cDNA,进而扩增到GrHMA基因序列,并进行TA克隆、测序和序列分析;构建GrHMA基因原核表达载体,在大肠杆菌Rosetta中进行表达,使用SDS-PAGE检测其蛋白表达情况。结果显示GrHMA基因为HMA基因家族的成员,在37℃、1.0mmol/L IPTG诱导下成功表达,这将为滇龙胆GrHMA蛋白的纯化、结构和功能研究奠定基础,也为植物、动物、微生物中HMA的研究提供参考。
1材料与方法
1.1植物材料
供试材料滇龙胆(Gentiana rigescens Franch.ex Hemsl.)种植于云南省农科院药用植物研究所种质资源圃(25°08'04.50"N,102°46'15.05"E)。栽培地海拔1942m,年平均气温14.7℃,年平均降水量980~1050mm,极端高温30.4℃,极端低温-0.2℃。试验材料为滇龙胆长势良好的幼叶。
1.2菌株、载体、酶等主要试剂
工程菌E.coli Trans 5α、E.coli Rosetta(DE3)、RNAiso for Polysaccharide-rich Plant Tissue Reagent、反转录试剂盒、限制性内切酶BamH I和Xho I及异丙基-β-D-硫代吡喃半乳糖苷(IPTG)、X-gal等均购买于宝生物工程(大连)有限公司;高纯质粒小量制备试剂盒(离心柱型)、多功能DNA纯化回收试剂盒均购自北京百泰克生物技术有限公司;质粒pGEX-4T-l由玉溪师范学院分子生物学实验室保存;引物由上海捷瑞生物工程有限公司合成,测序由生工生物工程(上海)股份有限公司完成。
1.3引物设计
根据3年生滇龙胆转录组中GrHMA基因序列和原核表达载体pGEX-4T-l多克隆酶切位点,设计一对特异引物GrHMABamH I-F:5'一GG -ATCCATGTCTATGGTGGAAGTTTTGG-3':GrHMAXho I -R: 5'-CTCGAGTCACATAATAGAACAAG-CATGGG-3'。
1.4滇龙胆叶片总RNA的提取及GrHMA基因的扩增
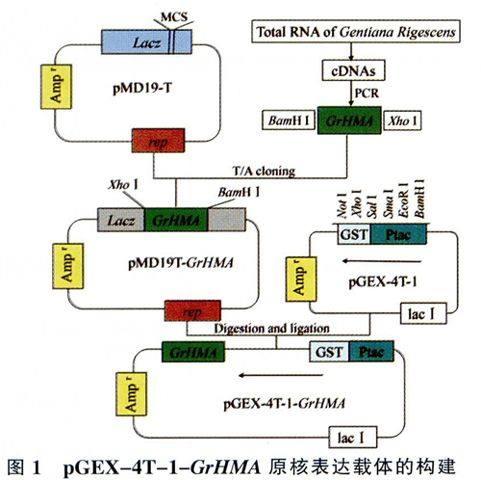
采用植物RNAiso for Polysaccharide-rich PlantTissue提取试剂盒,按照说明书提取滇龙胆叶片的总RNA,参照Reverse Transcriptase M-MLV(RNase H-)试剂盒说明书反转录为cDNA,-20℃保存备用。以cDNA为模板进行PCR扩增,反应条件为:94℃ 3min;94℃ 30s,54℃ 30s,72℃30s,30个循环;72℃延伸7min。利用BioTekeCorporaltion高纯质粒小量制备试剂盒回收RT-PCR产物,随后将其连接到pMD19-T载体上,转化E.coli Trans5a感受态细胞,涂布于添加氨苄青霉素(Amp)(100mg/L)、IPTG、X-gal的LB平板上37℃培养12~16h后随机挑选阳性克隆摇菌并提取质粒,经PCR检测和酶切验证正确后送出测序,即可获得pMD19T-GrHMA重组载体。使用BarnH I和Xho I双酶切pMD19T-GrHMA重组质粒和pGEX一4T-l载体,回收目的基因和载体片段,按1:4(摩尔比)混合后经Ligation SolutionI连接并转化E.coli Trans Sa感受态细胞,涂布于添加100mg/L Amp的LB固体平板。次日随机挑选阳性克隆摇菌并提取质粒,经PCR检测和酶切验证正确后测序,即可获得pGEX-4T-1-GrHMA原核表达载体(图1)。
1.5GrHMA的生物信息学分析
利用NCBI网站上的BLAST程序对GrHMA蛋白进行分析,应用DNAMAN推测并比对氨基酸序列,利用在线软件预测GrHMA蛋白的相对分子质量、氨基酸含量、等电点、二级结构、三级结构和稀有密码子等;应用软件Mega4.0构建系统进化树。
1.6pGEX-4T-1-GrHMA重组质粒在大肠杆菌Rosetta中的表达
利用热激法将pGEX-4T-l-GrHMA重组质粒转化大肠杆菌Rosetta( DE3)感受态细胞,挑取单菌落并接种于4mL含100mg/L Amp的LB液体培养基中,37℃ 200r/min培养过夜。次日以l:100接种到新的不含Amp的LB液体培养基中,37℃200r/min培养至OD6≈0.6~0.8,在37℃条件下,加入IPTG(终浓度为lmmol/L)进行诱导表达,并以pGEX-4T-l质粒转化菌(含1mmol/L IPTG)作对照。诱导0、1、2、4、6、8、18h后分别收集2mL菌液。常温13000r/min离心lmin,弃上清,加入20μL5xSDS-PAGE蛋白上样缓冲液,100μL Milli-Qwater,震荡混匀,煮水沸1 5min。室温13000r/min离心5min,取20μL蛋白样品上样,进行SDS-PAGE(12%分离胶和4%浓缩胶)电泳检测。
2结果与分析
2.1滇龙胆GrHMA基因的克隆与分析
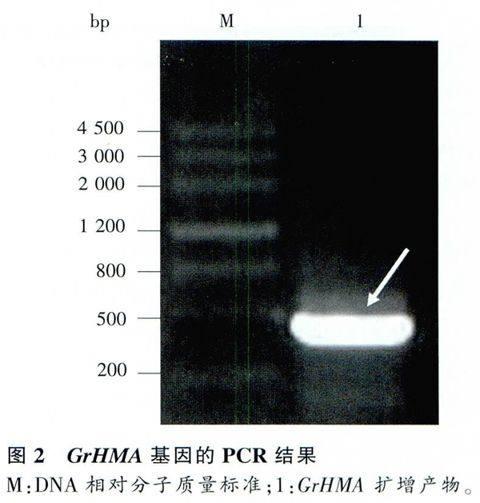
以滇龙胆cDNA为模板扩增出的PCR结果表明,扩增片段在500bp附近,是预期的目的片段(图2)。pMD19T-GrHMA经酶切验证连接正确,有明显的、单一的目的条带,且目的条带与预期条带的大小吻合。
cDNA序列测序结果分析表明,滇龙胆GrHMA基因(GenBank登录号为KF922376)全长429bp,编码142个氨基酸。
使用在线软件ExPASy ProtParam tool(http://web.expasy.org/protparam/)对GrHMA蛋白进行分析,结果显示GrHMA蛋白的相对分子质量为15.56kD,理论等电点为6.58,化学方程式为:C705H1069N179O205S7,不稳定指数为31.78,脂肪族指数为71.14,总平均疏水性(grand average of hy-dropathicity,GRAVY)为-0.182,半衰期为30h。通常依据蛋白的GRAVY值来预测蛋白的疏水性,GRAVY值在2到-2之间,若为负值,则为亲水蛋白;若为正值,则为疏水蛋白。GrHMA蛋白的GRAVY值为-0.182,说明GrHMA为亲水蛋白。
通过使用ExPASy ProtParam tool对GrHMA蛋白的氨基酸含量进行预测,结果显示GrHMA蛋白含有20种氨基酸,其中丙氨酸(Ala)、缬氨酸(Val)的含量最高,为10.6%,其次是甘氨酸(Gly)、丝氨酸(Ser),为7.7%;谷氨酰胺(Gln)、色氨酸(Trp)含量最低,仅为0.7%。
采用InterProScan在线工具对GrHMA蛋白的保守结构域进行预测。结果显示GrHMA蛋白有6个保守结构域(图3),主要是HMA(heavy met-al-associated domain,HMA)结构域(IPR006121),分别为位于6~63位HMA( PF00403)结构域、3~67位HMA-2(PS50846)结构域和1~70位HMA(heavy metal-associated domain)结构域(SSF55008)。另外还有在IPR中没有明确分类的结构域,主要为位于2~69位未明确描述的结构域(3.30.70.100)、1~70位Copper Transport Protein Atoxl-Related结构域(PTHR22814)和1~70位OS04G0401000 Pro-tein(PTHR22814:SF44)结构域。
选择GrHMA氨基酸序列,在NCBI中进行BLASTp分析,结果表明滇龙胆GrHMA蛋白属于HMA超家族(图4)。
GrHMA氨基酸序列与NCBI中经比对后一致性较高的可可(Theobroma cacao)、拟南芥(Ara-bidopsis thaliana)、蓖麻(Ricinus communis)、蒺藜状苜蓿(Medicago truncatula)HMA氨基酸序列进行比对,结果表明GrHMA蛋白与可可TcHMA同源性最高(74%),其次是拟南芥AtHMA,同源性为70%,与蒺藜状苜蓿HMA蛋白的同源性较低(39%),见表1。
根据推测的氨基酸序列进行的系统发育分析,结果表明GrHMA与TcHMA在同一进化枝上,表明GrHMA与TcHMA蛋白的亲缘关系较近(图5)。GrHMA与NCBI中HMA已知序列进行多序列比对,结果表明滇龙胆GrHMA蛋白保守性较强,与已知序列存在较高的同源性(图6)。
利用ExPASy SignalP 4.0 Server在线软件(http://www.cbs.dtu.dk/services/SignalP/)对GrHMA蛋白进行分析,未发现信号肽,表明GrHMA不是分泌蛋白。
利用在线软件Expasy中的TMHMM工具(http://www.cbs.dtu.dk/services/TMHMM-2.0/)预测GrHMA蛋白的跨膜螺旋区,结果表明GrHMA蛋白不是膜蛋白,无跨膜螺旋区。
使用SSpro在线软件(http://scratch.proteomics.ics.uci.edu/)分析GrHMA的二级结构。结果显示该蛋白二级结构中无规则卷曲(C)占61.98%,β-折叠(E)占17.6%,α-螺旋(H)占20.42%。
利用CPHmodels 3.2 Server在线软件(http://www.cbs.dtu.dk/services/CPHmodels/)预测GrHMA蛋白的三级结构(图7),从图中可以看到GrHMA的三级结构形成了多个无规则卷曲,整个三维结构呈“口袋”状,表明该蛋白可能通过该“口袋”与金属离子和DNA结合。
用ProtFun在线软件基于已知的具有相似功能蛋白的搜索和比对,对GrHMA编码的蛋白质进行功能预测,结果显示GrHMA蛋白参与复制与转录、能量代谢、翻译、转录调控的可能性远高于其他功能,其可能性分别为0.204、0.184、0.167和0.118;另外其参与金属离子转运的可能性为0.009,这些数据能为GrHMA蛋白的后续研究提供参考。
对GrHMA基因进行稀有密码子分析(http://molbiol.edu.ru/eng/scripts/01_11.html),结果表明GrHMA基因中不含稀有密码子,因此可选用Rosetta菌或BL21进行原核表达。
2.2原核表达重组质粒的鉴定
利用BamH I和Xho I双酶切pGEX-4T-l一GrHMA重组质粒,可检测到约429bp的片段(图8),表明GrHMA基因已插入pGEX-4T-1载体中。对pGEX-4T-1-GrHMA重组质粒进行测序,结果显示连入原核表达载体中的基因片段与目的序列一致,酶切位点处序列连接无误,没有移码及碱基突变等现象出现,表明已获得正确的CrHMA原核表达载体。
2.3 SDS-PAGE分析
将pGEX-4T-l-GrHMA重组质粒转化大肠杆菌Rosetta(DE3)并诱导表达。37℃、IPTG终浓度为1mmol/L时分别诱导0、1、2、4、6、8、18h后,提取大肠杆菌总蛋白进行SDS-PAGE检测。结果显示,插入外源片段的pGEX-4T-1一GrHMA重组质粒经IPTG诱导后,在预期蛋白相对分子质量41.56kD(包含GST蛋白)处有1条蛋白带,而未诱导的pGEX-4T-l对照质粒和转化重组质粒均未出现该条带,表明pGEX-4T-1-GrHMA重组质粒在大肠杆菌Rosetta中诱导表达了GrHMA蛋白。诱导时间为8h时,蛋白表达量已很大,18h时达最大(图9),表明相同条件下,一定时间范围内,随着诱导时间的延长,蛋白表达量逐渐增加。
3讨论
HMA是一个在植物中广泛存在的蛋白家族,具有参与叶绿体Cu运输、Cu稳态、毒性重金属转运等功能。植物中有关HMA蛋白纯化的报道较少,其确切功能还有待进一步研究。研究表明HMA可以调节植物稳态,具有重金属转运、吸收、富集等作用。如Mills等[22]研究发现拟南芥AtHMA4的T-DNA插入突变体对Cd、Zn离子浓度的升高敏感,AtHMA4在野生型酵母(Saccharomyces cere-visiae)中的异源表达可提高其对Cd离子的抗性,还能使Zn敏感型大肠杆菌zntA突变体存活;Andres-Colas等[23]研究发现AtHMA4在拟南芥中过表达可增加叶片中Zn和Cd的含量;Verret F等[24]研究发现AtHMA4在野生型酵母和Co超敏感突变体cotl中的表达能提高酵母对Co的敏感性。Papoyan等[17]研究表明遏蓝菜TcHMA4在酵母中的过表达可提高其对重金属离子的耐受性,并使其输出Cd、Zn、Pb和Cu等重金属;鼠耳芥AhHMA4在酵母中的过表达可降低细胞中Zn和Cd的含量,表明AhHMA4蛋白具有跨膜转运Zn和Cd的作用。本研究利用RT-PCR技术,从滇龙胆幼叶中分离到GrHMA基因,序列分析表明GrHMA属于HMA蛋白超家族。系统发育分析显示,GrHMA与SIHMA26位于同一进化枝,亲缘关系最近;与CsHMA同源性最低,亲缘关系最远。但要明确GrHMA蛋白在滇龙胆中的具体功能,必须从蛋白水平进一步研究,而原核表达是目前最常用的研究蛋白结构和功能的方法。
本研究首次从滇龙胆中克隆到GrHMA基因,成功将其连接到pGEX-4T-l原核表达载体上并顺利在大肠杆菌表达菌Rosetta(DE3)中表达到目的蛋白。大肠杆菌中外源目的基因能否顺利表达及表达效率的高低取决于原核表达载体、大肠杆菌菌株、诱导温度、诱导时间以及诱导剂浓度等。本研究在大肠杆菌Rosetta中进行表达,获得预期效果,在37℃、60r/min、IPTG终浓度为1mmol/L时,成功诱导了目的蛋白的表达。
本研究克隆了滇龙胆GrHMA基因,成功在大肠杆菌Rosetta中表达并获得融合蛋白。这为GrHMA蛋白结构和功能的深入研究以及进一步开发和利用植物HMA蛋白都具有重要的理论和应用价值。
参考文献(References):
[1]何廷农,刘尚武,吴庆如.中国植物志(第62卷)[M].北京:科学出版社(HE Ting-nong, LIU Shang-wu, WU Qing-ru. TheFlora of China (Vo1.62)[M]. Beijing:Science Press), 1988.1OO-101.
[2]兰茂.滇南本草(第2卷)[M].昆明:云南人民出版社(LANMao.South Yunnan Medica (Vol.2)[M]. Kunming Yunnan People'sPublishing House),1977,317-318.
[3]国家药典委员会.中华人民共和国药典(一部)[s].北京:化学工业出版社(National Pharmacopoeia Committee. ChinesePharmacopoeia(a)[S].Beijing. Chemical Industry Press),2010.65.
[4]沈涛,张金渝,杨维泽,等.滇龙胆主要农艺性状的相关及通径分析[J].中国中药杂志(SHEN Tao, ZHANG Jin-yu, YANGWei-ze.et al. Correlation and path analysis on agronomictraits of Gentiana rigescens[J]. China Journal of Chinese Ma-teria Medica), 2011,36(12):1568-1571.
[5]杨美权,张金渝,沈涛,等.不同栽培模式对滇龙胆中龙胆苦苷含量的影响[J].江苏农业科学(YANG Mei-quan, ZHANCJin-yu, SHEN Tao, et al.Different cultivation mode influenceon gentiopicroside in Gentian,a rigescens[J]. Jiangsu AgriculturalSciences), 2011(1):287-289.
[6] 沈涛,杨美权,赵振玲,等.滇龙胆中萜类物质积累的动态变化[J]植物学报(SHEN Tao, YANG Mei-quan, ZHAO Zhen-ling, et al.Dynamic changes in terpenoid contents in Gentian.arigescens[J]. Bulletin of Botany), 2011,46(6):652-657.
[7]ARGUELLO J M,EREN E,GONzALEZ-GUERRERO M.Thestructure and function of heavy metal transport P1B-ATPases[J].Biometals, 2007,20(3/4):233-248.
[18]BERNARD C,ROOSENS N,CZERNIC P,et al.A novel CPx-ATPase from the cadmium hyperaccumulator Thlaspi caeru-lescens[J]. Febs Letters, 2004,569(1/3):140-148.
[9]SOLIOZ M. VULPE C.CPx-type ATPases:a class of P-typeATPases that pump heavy metals[J]. Trends in Biochemical Bcie-nces,1996,21(7):237-241.
[lO]CLEMENS S.Mecular mechanisms of plant metal toleranceand homeostasis[J]. Planla, 2001,212(4):475-486.
[11]WILLAMS L E,MILLS R F.PIB-ATPases-an ancient familyof transition metal pumps with diverse functions in plants[J].Trends in Plant Science, 2005,10(10):491-502.
[12]PUIG S,ANDRES-COLAS N,GARcfA-MINA A,et al.Cop-per and iron homeostasis in Arabidopsis: responses to metaldeficiencies interactions and biotechnological applications[J].Plant.Cell&Fnvironment, 2007,30(3):271-290.
[13]LEE S,KIM Y Y,LEE Y,et al.Rice P1B-type heavy-metalATPase, OsHMA9, is a metal efflux protein[J]. Plant Physiolo-gy, 2007,145(3):831-842.
[14]HUSSAIN D, HAYDON M J, WANG Y, et al. P-type ATPaseheavy metal transporters with roles in essential zinc homeosta-sis in A rabidopsis[J].The Plant Cell Online, 2004, 16(5):1327-1339.
[15]BERNAL M, TESTILLANO P S, ALFONSO M, et al. ldentifi-cation and subcellular localization of the soybean copper P1B—ATPase CmHMA 8 transporter[J]. Journal of Structural Biology,2007,158(1):46-58.
[16]SOUTHRON J L, BASU U, TAYLOR C J. Complementation ofSaccharomyces cerevisiae ccc2 mutant by a putative P1B-AT-Pase from Brassica napus supports a copper-transporting func-tion[J]. Febs Letters, 2004,566(1/3):218-222.
[17]PAPOYAN A, KOCHIAN L V. Identification of Thlaspicaerulescen,s genes that may be involved in heavy metal hy-peraccumulation and tolerance. Characterization of a novelheavy metal transporting ATPase[J]. Plant Physiology, 2004,136(3):3814-3823.
[18]COURBOT M, WILLEMS G, MOTTE P, et al. A major quanti-tative trait locus for cadmium tolerance in Arabidopsis hallericolocalizes with HMA4, a gene encoding a heavy metal AT-Pase[J]. Plant Physiology, 2007,144(2):1052-1065.
[19]COBBETT C S, HUSSAIN D, HAYDON M J. Structural andfunctional relationships between type 1B heavy metal-trans-porting P-type ATPases in Arabidopsis[J]. New Phytologist, 2003,159(2):315-321.
[20]张玉秀,张媛雅,孙涛,等.植物重金属转运蛋白P1B-AT-Pase结构和功能研进展[J].生物工程学报(ZHANC Yu-xiu, ZAHNG Yuan-ya, SUN Tao, et al. Structure and functionof heavy metal transporter P1B-ATPase in plant: a review[J].Chinese Journal of Biotechnology), 2010,26(6):715-725.
[21]AXELSEN K B, PALMGREN M G. Inventory of the superfami-ly of P-type ion pumps in Arabidopsis [J]. Plant Physiology, 2001,126(2):696-706.
[22]MILLS R F, KRIJCER G C, BACCARINI P J, et al. Functionalexpression of AtHMA4, a P1B-type ArrPase of the Zn/Co/Cd/pbsubclass[J]. The Plant Journal, 2003,35(2):164-176.
[23]ANDRES-COLAS N, SANCENoN V, RODRfCUEZ-NAVAIR-RO S, et al. The Arabidopsis heavy metal P-type ATPaseHMA5 interacts with metallochaperones and functions in cop-per detoxification of roots[J]. The Plant Journal, 2006,45(2):225-236.
[24]VERRET F, GRAVOT A, AUROY P, et al. Heavy metaltransport by AtHMA4 involves the N-terminal degeneratedmetal binding domain and the C-terminal His11 stretch[J].Febs Letters, 2005,579(6):1515-1522.
