植物乳杆菌AY01 luxS基因表达模式与功能的研究
2014-04-29王良才姜黎明康子腾柳陈坚李晓然罗义勇
王良才 姜黎明 康子腾 柳陈坚 李晓然 罗义勇
摘 要:植物乳杆菌(Lactobacillus plantarum)是发酵食品中常见的一种益生菌,群体感应(quorum sensing,Qs)是细菌进行信号交流的一种普遍方式,Lb.plantarum是否通过QS介导着其益生特性尚不清楚。为了探索Lb.plantarum AY01是否通过AI-2/LuxS QS系统介导其对常见食源性病原菌的抑制,首先运用半定量PCR方法,研究了AY01在不同生长阶段luxS基因(合成Qs信号分子AI-2的关键基因)的表达情况;然后,利用牛津杯抑菌法研究了AY01对食源性病原菌肠出血性大肠杆菌(enterohemorrhagic Escherichia coli,EHEC)0157:H7、单核细胞增生李斯特菌(Listeria monocytogenes)和金黄色葡萄球菌(Staphylococcus aureus)的抑菌效果。研究发现:1)Lb.plantarum AY01 luxS基因在指数早期没有表达,指数中期出现表达,指数末期表达量明显增加,并于稳定中期达到最大值;2)AY01培养上清液对EHEC 0157:H7、L.monocytogenes、S.aureus均有抑茵效果,抑菌效果与;luxS基因表达趋势一致,即随AY01生长时间的增加抑菌呈现增加变化,到稳定期达到最大抑茵效果。结果表明,Lb.plantarum AY01可能通过AI-2/LuxS QS系统介导其对常见食源性病原菌的抑制。
关键词:植物乳杆菌;luxS基因;表达;抑茵;群体感应
中图分类号:Q786
文献标识码:A
文章编号:1007-7847(2014)03-0199-06
乳杆菌(Lactobacillus)是乳酸菌(lactic acidbacteria,LAB)最大的一个属,因其形态呈杆状或球状以及能发酵碳水化合物(主要为葡萄糖)并产生大量乳酸而得名[1]。作为乳杆菌一个主要的种,植物乳杆菌(Lb.plantarum)具有很多益生功能[2],其中对病原菌的抑制功能得到了最广泛的研究。2011年Moslehi-Jenabian等[3]将病原菌单核细胞增生李斯特菌(Listeria mono-cytogenes)与嗜酸乳杆菌(Lb.acidophilus)NCFM共培养,发现L.monocy-togenes生长明显受到影响,而Lb.acidophilusNCFM的生长几乎没有变化,说明Lb.acidophilusNCFM对病原菌L.monocytogenes具有很好的抑菌效果。Kim等[4]研究发现,Lb. acidophilus A4除了能抑制L.monocyogenes的生长外,对肠出血性大肠杆菌(enterohemorrhagic Escherichia coli,EHEC)0157:H7同样具有抑制功能。此外,本实验室之前的研究显示,Lb.plantarum,是一种具有广谱抑菌性的乳酸菌,不仅能抑制同种或近亲源关系的细菌,还能抑制大多数病原菌如E.coli、L.mono-cytogenes、金黄色葡萄球菌(Staphylococcus aureus)和鼠伤寒沙门氏菌(Sal-monella typhimurium)等菌株[5,6]。
群体感应(quorum sensing,QS)是细菌间通过化学信号分子进行信息传递的一种形式。根据细菌信号分子种类的不同,QS系统可分为4种代表性的类型:1)革兰氏阳性(G+)细菌中的种内信号通讯使用的语言是寡肽;2)革兰氏阴性fG)细菌利用酰基高丝氨酸内酯作为信号分子实现种内细胞通讯;3)许多革兰氏阴性菌还可以使用扩散信号因子系统来调节多种生物学功能,例如毒力和生物膜形成等[7];4)不同种的细菌之间也能进行交流,交流所用的语言是AI-2,这种信号分子存在于大多数细菌中,是许多细菌进行种内和种间交流的通用语言[8.9]。AI-2在细菌体内由LuxS催化合成,LuxS基因广泛存在于G+和G-细菌中,且具有很高的保守性[10]。代谢学研究发现,LuxS是细菌硫代谢中甲基循环中一个代谢酶,在代谢过程中AI-2作为副产物被合成,所以LuxS肩负着代谢和信号传递的双重功能[11,12]。
AI-2/LuxS QS系统介导乳酸菌发挥益生特性已有一定研究。Moslehi-Jenabian等[13]发现luxS基因可能参与某些Lactobacillus的酸适应过程,使细菌可以通过胃肠道而存活下来,并且在肠道微生态系统中可能在细菌与细菌之间的交流中具有一定作用。Buck等[11]得出AI-2/LuxS QS系统在Lb.acidophilus粘附肠表皮,定植肠道过程中具有重要作用;Lebeer等[14]研究推测AI-2/LuxS QS系统可能与Lactobacillus在动物消化道中的适应性密切相关。AI-2/LuxS QS系统与LAB抑菌的相关性研究很少。据报道,一些G+细菌能够通过QS系统激活Lb. plantarum特异信号途径,增加细菌素(一种具有抑菌作用的多肽)产量[15,16]。Man等[17,18]不仅发现4种LAB(称为诱导LAB)与Lb. plan-tarum, KLDSl.0391共培养能使Lb.plantarumKLDSl.0391的细胞数增多,同样能显著提高Lb.plantarum KLDSl.0391产生细菌素的能力;以此为基础,通过进一步基因敲除和表达研究,他们建立了AI-2/LuxS QS系统介导Lb. plantarum KLDS-1.0391细菌素产生的模型:诱导LAB作为环境刺激被Lb. plantarum, KLDSl.0391识别,导致Lb.plantarum KLDSl.0391细胞数显著增加,造成LuxS合成的信号分子AI-2的大量积累,当该浓度达到一定阈值时,它能够开启下游调节元件的转录,调控细菌素编码基因合成细菌素。
在前期的研究中,我们从云南石林路南鲜羊奶中,分离鉴定了一株益生效果较好的乳杆菌。16S rRNA基因测序鉴定其为Lb. plantarum,命名为AY01,并且利用焦磷酸测序策略测定了其全基因组序列[19]。本研究以Lb. plantarum AY01为实验材料,首先制作它的生长曲线,然后选取跟细菌QS密切相关的指数早期(4.5h)、指数中期(12h)、指数晚期(18h)和稳定中期(27h)4个点为研究对象,应用半定量PCR方法和牛津杯抑菌法分别测定其在这4个点的luxS基因表达水平和对常见食源性病原菌EHEC 0157:H7、L monocytogenes、S.aureus的抑制情况,探讨Lb.plantarum AY01luxS基因表达与抑菌的相关性,为AI-2/LuxS QS系统介导乳杆菌的抑菌关系提供理论依据。
1材料与方法
1.1菌株与培养基
Lb.pLantarum AY01由本实验室从云南石林路南鲜羊奶中分离获得。常见食源性病原菌E-HEC 0157:H7、L monocytogenes、S.aureus为本实验室保存菌株。Lb.plantarum培养用MRS培养基(Oxoid,英国),E.coli用营养肉汤培养基(杭州天河微生物试剂有限公司,中国),L.monocytoge-nes、S.aureus用脑心浸液肉汤培养基(青岛高科园海博生物技术有限公司,中国)培养。
1.2生长曲线和产酸试验
首先从-80℃冰箱中取出Lb.plantarumAY01种子液,然后按4‰(V/V)接种于MRS液体培养基中,30℃活化24h后,同样按4‰(V/V)接种到新鲜的MRS液体培养基中,30℃静止培养。隔1.5h取样(0~36h),利用分光光度计测定600nm波长处的吸光值(OD6oo),同时利用pH计测定各样品的pH值。以培养时间为横坐标,OD6oo和pH为纵坐标,制作Lb.plantarum AY01生长曲线和产酸趋势图。
1.3生长阶段luxS基因表达分析
1.3.1cDNA第一条链的合成
依据Lb.plantarum AY01生长曲线,用RNAprep pure培养细胞/细菌总RNA提取试剂盒(TIANGEN,中国)提取其指数早期(a点,培养4.5h)、指数中期(b点,培养12h)、指数晚期(c点,培养18h)和稳定中期(d点,培养27h)4点的菌体总RNA,利用琼脂糖凝胶电泳和吸光值测定法分别分析总RNA的完整性、纯度和浓度。最后,以总RNA为模板,利用mRNA selective PCR kit (TAKARA,日本)进行逆转录反应,生成第一条链cDNA。
1.3.2引物设计
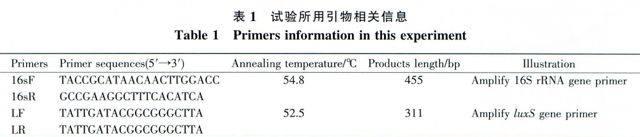
选取看家基因16S rRNA基因作为相对半定量的内参照基因。根据Lb.plantarum AY01全基因组序列[19],利用引物设计软件Primer Premier5.0(PREMIER Biosoft International,美国),设计扩增16S rRNA和luxS基因的引物(表1)。引物由上海生工生物有限公司合成。
1.3.3相对半定量测定luxS基因表达
以逆转录得到的单链cDNA为模板,按照mlRNA selective PCR kit (TAKARA,日本)说明书进行相对半定量分析。首先调节内参16S rRNA基因PCR时的cDNA加样量,通过较少循环数PCR扩增(85℃ 1 min;54.8℃ 1 min;72℃1min,25个循环),使PCR产物浓度在a、b、c、d 4点相同(利用GeneTools from SynGene软件(Syngene,英国)测定琼脂糖凝胶中PCR产物的浓度),记录a、b、c、d 4点相应的模板cDNA加样量。然后,按照上一步相同的cDNA加样数加量,同样利用较少循环数PCR扩增(90℃l min;52.5 ℃ 1 min;72℃lmin,25个循环)a、b、c、d 4点的luxS基因,最后通过琼脂糖凝胶电泳与GeneTools fromSynGene软件测定和分析luxS基因在a、b、c、d 4点相对表达量。
1.4抑菌试验
Lb.plantarum AY01种子液经活化培养后,按40‰ (V/V)接种到新鲜的MRS液体培养基中,30℃静止培养至a、b、c、d 4点,9000r/min离心2min,收集上清液和菌体。菌体用1mL无菌水悬浮后用细胞破碎仪破碎(程序为“在25℃下,按60%总功率,超声开3.5s,关9s”处理5min)。上清液和菌体破碎液通过牛津杯法进行抑菌实验:首先,将灭菌好的2%水琼脂倒入直径为90mm的平板中,凝固后,将4个无菌牛津杯垂直放置在同一个平板上;然后,将含有约l.Oxl06cfu/mL食源性病原菌的培养基小心倒人上述平板中,凝固后,用灭菌镊子夹出牛津杯;最后,分别取250μL上清液和菌体破碎液加入到牛津杯孔中,30℃过夜培养后(约15h),用尺子按垂直测量的方法测定抑菌圈直径,取两次垂直测量值的平均数。每个样品做3个平行平板,3个平板的平均值作为最终的抑菌值[20]。
2结果
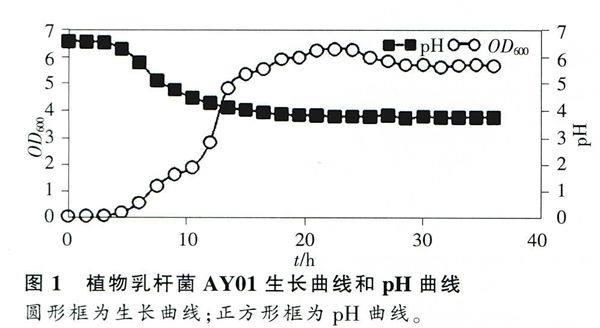
2.1生长曲线和pH相关曲线
以培养时间为横坐标,以OD600和pH值为纵坐标,制作Lb.plantarum AY01的生长曲线和产酸曲线,结果显示AY01具有典型微生物生长曲线特征(图1)。在O~3h,AY01的OD600≈0,说明AY01在该时间段处于延滞期;随后AY01进入指数期,3~4.5h处于指数早期,4.5~12h处于指数中期,12~18h处于指数晚期;大约从18h开始,AY01生长进入稳定期,持续时间约为22h(18~36h);最后OD600有下降的趋势,说明AY01开始进入衰亡期(图1)。Lb.plantarum AY01培养液的pH值具有和生长曲线完全相反的特征(图1)。在0~3h,pH稳定维持在6.5;在3~18h时间段,pH值处于迅速下降状态,由6.29下降到3.86;18h后,AY01培养液pH处于一个稳定的低pH值状态,pH≈3.8。
2.2生长阶段luxS基因表达分析
2.2.1RNA提取与分析
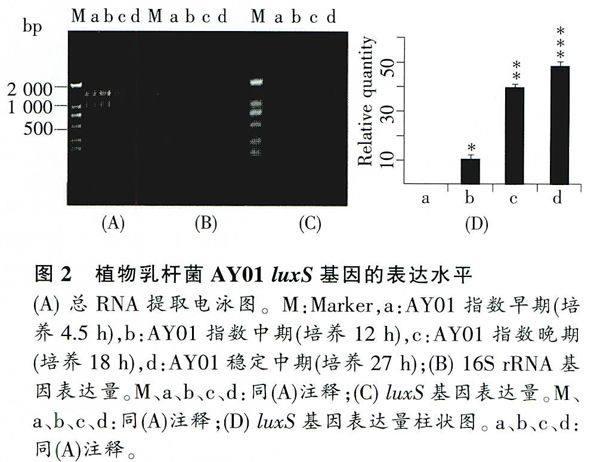
2%琼脂糖凝胶电泳结果显示,a、b、c、d 4点没有降解,且都具有清晰的两条带,根据Marker可判断该两条带分别为23S、16S rRNA(图2A)。此外,利用分光光度计测定a、b、c、d 4点的A260/A280比值分别为1.876、1.959、1.871、1.856,说明有微量DNA污染。因为mRNA selective PCR kit能去除少量DNA的干扰,所以对该RNA不需DNA酶处理,直接进行逆转录反应。
2.2.2 16S rRNA基因内参设定
运用半定量PCR方法扩增内参16S rRNA基因,确定a、b、c、d 4点内参16S rRNA PCR扩增量相同时模板cDNA的加样量。通过结果分析得知,当a、b、c、d 4点分别加1.26、1.52、1.05、0.94 μL模板后,其PCR扩增条带亮度基本一致(图2B)。
2.2.3luxS基因表达分析
根据内参设定结果,在luxS基因PCR扩增过程中,a、b、c、d 4点分别加入1.26、1.52、1.05、0.94 μL的模板cDNA,经25个循环后,发现Lb.plantarum, AY01 luxS基因的表达水平随生长时间的增加呈递增趋势,即指数早期没有表达,指数中期出现表达,相对表达量约为10,指数晚期表达量明显增加,相对表达量约为39.5,稳定期表达达到最大值,相对表达量约为48.5 (图2C、D)。
通过DPS数据处理系统一单因素试验统计分析,结果显示luxS基因a、b、c、d 4点表达量相互之间存在显著性差异(n=3,P<0.0)(图中*的多少表示它们之间具有显著性差异)。
2.3抑菌结果
Lb.plantarum AY01上清液对EHEC 0157:H7、L.monocytogenes、S.aureus均有抑菌效果,且具有随着生长时间的增加呈增大变化的特征(表2)。另外,AY01菌体在a、b、c、d 4点对3种病原菌(EHEC 0157:H7、L.monocytogenes、S.aureus)都没有抑菌效果(结果未显示1,说明AY01的抑菌物质可能主要是分泌型代谢产物或酶。
注:a:AYOl指数早期(培养4.5 h),b:AYOl指数中期(培养12h);c:AY01指数晚期(培养18h);d:AYOl稳定中期(培养27h)。
Notes:a:AYOl early exponential phase (cultured 4.5h);b:AY01 middle exponential phase (cultured 12h);c:AYOl lateexponential phase (cultured 18h);d:AYOl middle stationaryphase (cultured 27h).
3讨论
早在2010年,我们实验室从云南石林路南鲜羊奶中分离得到了一种益生效果较好的乳酸菌,16S rRNA基因序列分析证明其是植物乳杆菌,我们将该菌株命名为Lb. plantarum AY01。目前,AY01的全基因组序列已经测序完成[19]。本文研究发现,Lb.plantarum AY01 luxS基因表达在指数中期出现,随着生长的进行,表达水平一直增加,至稳定中期达到最大值。Moslehi-Jenabian等[13】在研究AI-2/LuxS QS系统与Lactobacillus酸适应关系中发现了相似结果,即随着Lactobacillus生长的进行,细胞数逐渐增多,造成的结果为luxS基因的表达水平和其合成产物-QS信号分子AI-2活性的逐渐增加,并于稳定期达到最大值。基于Lb.plantarum AY01的生长曲线和luxS基因表达相一致的趋势(当细胞生长到一定数量时luxS基因才出现表达,并且随着生长的进行,溶液中细胞浓度的增加,luxS基因表达也相应增加)以及luxS基因编码产物能合成QS信号分子AI-2的背景知识[11],说明luxS基因与Lb.plantarum AY01QS密切相关。在AYOI的生长过程中,luxS基因表达水平的增加是因为AY01细胞数量的增加引起的,还是随着合成的AI-2分子数目越来越多,最终启动QS系统,而该QS系统又能促进luxS基因的表达这样一种模型,还需要更深一步的研究,这也是我们下一步研究的方向。
牛津杯抑菌实验结果显示,Lb.plantarumAY01上清液的抑菌效果随着生长进行也呈现增强变化。这与Lee[2l]的一本书中讲到的类似,即乳酸菌与E.coli、L.monocytogenes、S.aureus等病原菌共培养时,随着生长进行乳酸菌的数量明显增加,而病原菌的数量明显减少并最终消失。在本实验中,随着Lb.plantarum AY01生长的进行,细胞的浓度越来越高,luxS基因的表达量也随之增加;在该过程中,AY01上清液对3种常见食源性病原菌的抑菌效果(EHEC 0157:H7、L.monocyto-genes、S.aureus)也越来越明显,说明AYOl luxS基因表达可能与其抑菌相偶联;此外,由产酸曲线得知,随着AY01生长的进行,pH值呈现显著下降,于18h后达到一个稳定的低pH值状态,说明在该过程中,AY01的产酸量越来越多。由我们的实验结果以及Moslehi-Jenabian[3].Diep[l5,16]和Man等[17,18]的前期研究,我们可以做如下推测:Lb.pLantarum AY01 luxS基因不但与QS密切相关,而且可能与发挥抑菌效果也有很大的关系,并且这些抑菌物质很可能是某些酸类或者细菌素等。Lb. plantarum AY01可能通过AI-2/LuxS QS系统调节着酸或者细菌素等物质的合成和分泌,最终介导着其对常见食源性病原菌的抑制。
参考文献(References):
[1]刘振民,骆承庠,乳酸菌发酵剂生物工程技术[J]食品与发酵工业(LIU Zhen-min, LUO Cheng-xiang. Progress in biotech—nology of lactic acid bacteria starter culters[J].Food and Fer-mentation Industries), 2000, 26(4): 68-72.
[2]刘振民.乳酸菌益生特性及应用[C].杭州:中国奶业协会(LIUZhen-min. Lactic acid bacteria probiotic properties and appli-cations[C]. Hangzhou: China Dairy Industry Association), 2009199-201.
[3]MOSLEHI-JEIANENAB S,VOGENSEN F,JESPERSEN L.The quorum sensing luxS gene is induced in Lactobacillusacidophilus NCFM in response to Listeria mnnocytogenes[J].In-ternational Journal of Food Microbiology, 2011, 149(3): 269-273.
[4]KIM Y,OH S,PARK S,et al.Lactobacillus acidophilus re-duces expression of enterohemorrhagic Escherichia coli O157:H7 virulence factors by inhibiting autoinducer-2-like activity[J].Food Control,2008, 19(11): 1042-1050.
[5]熊涛,宋苏华,黄涛,等,植物乳杆菌NCU116抑菌性能的研究[J].食品与发酵工业(XIONC Tao, SONC Su-hua,HUANGTao, et al.Antibacterial experimenb of Lactobacillus plan一tarum NCU116[J]. Food and Fermentation Industries), 2012, 38(6): 97-101.
[6] 熊骏.云南传统发酵豆豉由来乳酸菌中主要有机酸的测定及其抑菌效果研究[D].昆明:昆明理工大学(XIONC Jun.Analy-sis of major organic acids from Laetic acid bacteria isolatedfrom Yunnan traditional fermented Douchi and study on bacteriostasis[D]. Kunming: Kunming Univcrsity of Science and Tech-nology), 2011.
[7]DENG Y Y,WU J E,TAO F,et al Listening to a new lan-guage: DSF-based quorum sensing in gram-negative bacteria[J].Chemical Reviews, 2011,111(1):160-173
[8]赵丽萍,金黄色葡萄球菌AI-2群体感应系统的调控[D].合肥:中国科学技术大学 (ZHANG Li-ping. AI-2 quorum sensing regulation in Staphylococcus aureus[D]. Hefei: University ofScience and Technology of China), 2010.
[9]CHEN X. SCHAUDER S, POTIER N, et al. Structural identi-fication of a bacterial quorum sensing signal containing boron[J].Nature, 2002, 415(6871):545-549.
[10]de KEERSMAECKER S C J, SONCK K, VANDERLEYDEN J.Let LuxS speak up in AI-2 signaling[J]. Trends in Microbiolo-gy, 2006,14(3):114-119.
[11]BUCK B L. AZCARATE-PERIL M A, KLAENHAMMER T R.Role of autoinducer-2 0n the adhesion ability of Lactobacillusacidophilus[J]. Journal of Applied Microbiology, 2009, 107(1):269-279.
[12]di CAGNO R, de ANGELIS M, CALASSO M, et al. Proteomicsof the bacterial cross-talk by quorum sensing[J]. Journal of Pro-teomics,2011,74(1):19-34.
[13]MOSLEHI-JENABIAN S, GORI K, JESPERSEN L.AI-2 sig-naling is induced by acidic shock in probiotic strains of Lacto-bacillus spp[J]. International Journal of Food Microbiology, 2009,135(3):295-302.
[14]LEBEER S. CSLAES I J J, VERHOEVEN T L A, et al. Im-pact of luxS and suppressor mutations on the gastrointestinaltransit of Lactobacillus thamnosus GG[J]. Applied and Environ-mental Microbiology, 2008, 74(15):4711-4718.
[15]DIEP D B, MATHIESEN G, EIJSINK V G H, et al. Use ofLactobacilli and their pheromone-based regulatory mechanismin gene expression and drug delivery[J]. Current Pharmaceuti-cal Biotechnology, 2009, 10(1):62-73.
[16]DIEP D B, STRAUME D, KIOS M, et al. An overview of themosaic, bacteriocin pln loci from Lactobacillus plantarum[J].Peptides, 2009, 30(8):1562-1574.
[17]MAN L L, MENGX C, ZHAO R H. Induction of plantaricinMG under co-culture with certain lactic acid bacterial strainsand identification of LuxS mediated quorum sensing system inLactobacillus plantarum KLDSl. 0391[J]. Food Control, 2012,23(2):462-469.
[18]MAN L L, MENG X C, ZHAO R H, et al. The role ofplNC8HK-plnD genes in bacteriocin production in Lacto-bacillus plantarum KLDSl. 0391[J]. International Dairy Journal,2014,34(2):267-274.
[19]LI X R, GONG F M, ZHENG H J, et al. Draft genome se-quence of Lactobacillus plantarum strain AY01 from freshgoatso' milk[J]. Genome Announcements, 2013,1(5):1.
[20]钱存柔,黄仪秀.微生物学试验教程[M].北京:北京大学出版社
(QIN Cun-rou, HUANG Yi-xiu. Microbiology Course[M]. Bei-jing: Peking University Press), 1999.176-182.
[21]LEE C H. Fermebtation Technology in Korea[M]. Seoul: KoreaUniversity Press, 2001.
