N-乙酰半胱氨酸治疗重症肝病的临床疗效研究
2014-04-28朱婷聂青和李谨革曹义战赵保民高禄化王媛媛李汨
朱婷,聂青和,李谨革,曹义战,赵保民,高禄化,王媛媛,李汨
·论著·
N-乙酰半胱氨酸治疗重症肝病的临床疗效研究
朱婷,聂青和,李谨革,曹义战,赵保民,高禄化,王媛媛,李汨
目的探讨作为转化医学“华丽转身”的典范——N-乙酰半胱氨酸(N-acetylcysteine,NAC)治疗重症肝病的临床疗效及安全性。方法选取HBV感染引起的重症肝病266例,随机分为治疗组136例(其中肝硬化失代偿期87例,肝衰竭49例)和对照组130例(其中肝硬化失代偿期85例,肝衰竭45例)。对266例采取维护肝细胞膜稳定性及肝细胞膜修复(保肝)、抗病毒、合理应用抗生素、营养支持及输注新鲜血浆、全血或人血白蛋白等综合治疗措施,均未使用谷胱甘肽制剂。治疗组加用NAC(8 g,1次/d),治疗45 d为1个疗程。45 d后观察患者的肝功能、终末期肝病模型(model forend-stage liver disease, MELD)评分、Child-Pugh评分及药物不良反应。结果2组症状均有所改善,治疗组治疗45 d后肝功能(部分或全部)等均明显改善,MELD及Child-Pugh评分均明显下降,且改善幅度明显优于对照组(P<0.05)。治疗期间无NAC严重药物不良反应事件。结论NAC可明显改善重症肝病患者的各项肝功能指标,且无严重不良反应,可在临床上推广应用。
乙酰半胱氨酸;肝硬化;肝疾病;肝功能衰竭
N-乙酰半胱氨酸(N-acetylcysteine,NAC)为还原型谷胱甘肽(glutathione,GSH)的前体,最早应用于20世纪60年代,主要用于呼吸系统疾病,是一种经典的化痰药物[1]。近年来,国外学者经研究证实NAC具有显著保护肝细胞的作用,可最终降低多器官功能衰竭的发病率。2005年美国肝病研究学会(American Association for the Study of Liver Diseases, AASLD)发布的关于急性肝衰竭(acute liver failure, ALF)诊疗指南中推荐,NAC可用于治疗明确或怀疑对乙酰氨基酚(acetamidophenol,APAP)过量导致的ALF[2]。2011年对其指南进行更新,指出NAC除可用于APAP中毒引起的ALF外,对非APAP所致的ALF也有治疗作用,还可用于治疗药物诱发性肝损伤[3]。2012年欧洲肝脏研究学会指出NAC和皮质类固醇具有协同效应,进而改善重度酒精性肝炎[4]。2011年,NAC经美国食品药品监督管理局批准用于APAP中毒引起的ALF,其安全性和临床疗效已得到认可[5]。我国最新《肝衰竭诊治指南(2012年版)》[6]与AASLD指南一致,推荐NAC对药物性肝损伤所致ALF有益,确诊或疑似APAP过量引起的ALF和非APAP引起的ALF,应用NAC亦可改善结局。最近国外研究发现,NAC对其他原因引起的重症肝病同样有良好的临床疗效。
重症肝病在临床上常指肝硬化失代偿期及肝衰竭等相关肝病的总称[7]。重症肝病病情严重,变化较快,一旦确诊应立即救治,否则病死率极高[8]。目前尚缺乏治疗重症肝病的特效药,且临床疗效欠佳。NAC成为肝病治疗领域的闪亮点,作为转化医学“华丽转身”的典范,为重症肝病提供了重要治疗手段[9]。重症肝病患者在维护肝细胞膜稳定性及肝细胞膜修复(保肝)、抗病毒[10]、合理应用抗生素、营养支持及输注新鲜血浆、全血或人血白蛋白等综合内科治疗基础上,联合NAC,以期更高效率地改善临床症状,降低病死率,提高生存质量。现将我院联合NAC治疗HBV感染引起的重症肝病的疗效及安全性分析如下。
1 对象与方法
1.1 对象选择2013年3月—2014年3月我院收治的HBV感染引起的重症肝病266例,按照随机分组原则将其分为治疗组和对照组。治疗组136例,其中肝硬化失代偿期87例(男47例,女40例),年龄(42.8±6.7)岁;肝衰竭49例(男22例,女27例),年龄(45.6±9.7)岁。对照组130例,其中肝硬化失代偿期85例(男48例,女37例),年龄(42.2± 5.9)岁;肝衰竭45例(男24例,女21例),年龄(44.3±8.9)岁。2组在年龄、性别、病程及病情(临床症状和实验室指标)方面比较均衡(P均<0.05)。入组患者未出现脱落现象。
1.2 诊断标准重症肝病肝硬化失代偿期诊断符合2000年《病毒性肝炎防治方案》[11]和2010年更新的《慢性乙型肝炎防治指南(2010年版)》[12]:①Child-Pugh评级一般为B、C级;②实验室检查如ALB<35 g/L、血清清蛋白与球蛋白比值<1.0、TBIL>35 μmol/L,ALT和AST升高,PTA<60%;③临床表现有腹水、肝性脑病及门脉高压症引起的食管、胃底静脉明显曲张或破裂出血。肝衰竭诊断符合《肝衰竭诊治指南(2012年版)》[6],分为临床及病理学诊断标准。临床诊断根据病史、临床表现和辅助检查等综合评定将肝衰竭分为ALF、亚急性肝衰竭、慢加急性(亚急性)肝衰竭和慢性肝衰竭。
1.3 排除标准①同时合并2种或以上并发症;②ALF;③肝衰竭晚期;④患者因其他原因拒绝入组。
1.4 治疗方法按照相关指南推荐,2组均给予维护肝细胞膜稳定性及肝细胞膜修复(如多烯磷脂酰胆碱、前列地尔和腺苷蛋氨酸等)、抗病毒、输注新鲜血浆或人血白蛋白、合理应用抗生素及营养支持等综合治疗[13-14]。2组均未使用GSH制剂。治疗组在对照组常规用药的基础上加用NAC 8 g,加入10%葡萄糖注射液250ml,缓慢滴注,1次/d,疗程45 d。主要观察指标:治疗45 d后,2组ALT、AST、TBIL、ALB和PTA等水平的变化情况[15-16]。
1.5 统计学处理应用SPSS 17.0软件进行数据处理,计量资料用±s表示,组内治疗前后比较采用自身配对t检验,组间治疗前后差值比较采用成组t检验。P<0.05表示差异有统计学意义。
2 结果
2.1 2组肝硬化失代偿期患者治疗前后肝功能生化指标比较治疗45 d后,2组ALT、AST、TBIL和PTA较治疗前均显著改善(P均<0.05),ALB虽较治疗前有所上升,但差异无统计学意义(P>0.05)。治疗45 d后,治疗组TBIL和PTA的改善情况明显优于对照组(P均<0.05)(表1);而ALT、AST和ALB与对照组相比,差异无统计学意义(P均>0.05)(表1)。
表1 2组肝硬化失代偿期患者治疗前后肝功能生化指标变化(±s)Table 1 Comparison of variations of liver function parameters of decompensated cirrhotic patients before and after treatment between the treatment group and the control group(±s)
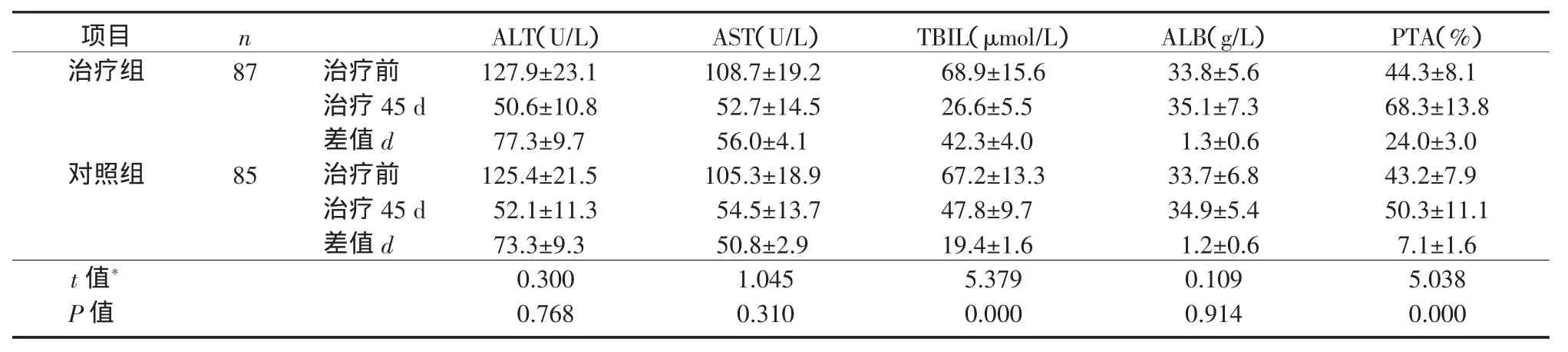
表1 2组肝硬化失代偿期患者治疗前后肝功能生化指标变化(±s)Table 1 Comparison of variations of liver function parameters of decompensated cirrhotic patients before and after treatment between the treatment group and the control group(±s)
注:*2组之间差值d比较用成组t检验。同组治疗前后比较用自身配对t检验。治疗组:ALT,t=7.961,P=0.000;AST,t=13.548,P=0.000;TBIL,t=10.692,P=0.000;ALB,t=2.019,P=0.074;PTA,t=8.171,P=0.000。对照组:ALT,t=7.858,P=0.000;AST,t=17.632,P=0.000;TBIL,t= 12.330,P=0.000;ALB,t=1.908,P=0.089;PTA,t=4.397,P=0.002
项目nALT(U/L)AST(U/L)TBIL(μmol/L)ALB(g/L)PTA(%)治疗组87治疗前127.9±23.1108.7±19.268.9±15.633.8±5.644.3±8.1治疗45 d50.6±10.852.7±14.526.6±5.535.1±7.368.3±13.8差值d77.3±9.756.0±4.142.3±4.01.3±0.624.0±3.0对照组85治疗前125.4±21.5105.3±18.967.2±13.333.7±6.843.2±7.9治疗45 d52.1±11.354.5±13.747.8±9.734.9±5.450.3±11.1差值d73.3±9.350.8±2.919.4±1.61.2±0.67.1±1.6 t值*0.3001.0455.3790.1095.038 P值0.7680.3100.0000.9140.000
2.2 2组肝硬化失代偿期患者治疗前后Child-Pugh评分比较治疗45 d后,2组Child-Pugh评分均降低,差异有统计学意义(P<0.05)。治疗组的疗效显著优于对照组(P<0.05)。见表2。
表2 2组肝硬化失代偿期患者治疗前后Child-Pugh评分变化(±s)Table 2 Com parison of variations of Child-Pugh scores of decom pensated cirrhotic patients before and after treatment between the treatment group and the control group(±s)
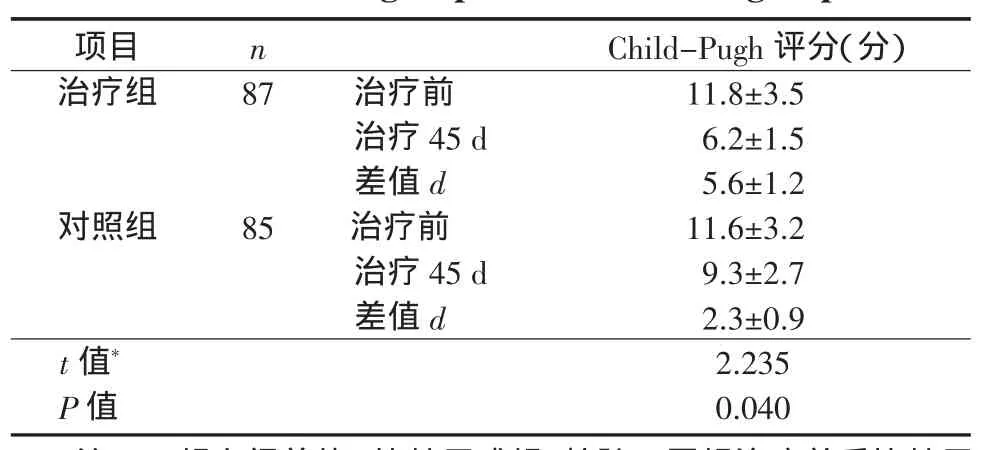
表2 2组肝硬化失代偿期患者治疗前后Child-Pugh评分变化(±s)Table 2 Com parison of variations of Child-Pugh scores of decom pensated cirrhotic patients before and after treatment between the treatment group and the control group(±s)
注:*2组之间差值d比较用成组t检验。同组治疗前后比较用自身配对t检验。治疗组Child-Pugh评分:t=4.635,P=0.001;对照组Child-Pugh评分:t=2.670,P=0.026
项目nChild-Pugh评分(分)治疗组87治疗前11.8±3.5治疗45 d6.2±1.5差值d5.6±1.2对照组85治疗前11.6±3.2治疗45 d9.3±2.7差值d2.3±0.9 t值*2.235 P值0.040
2.3 2组肝衰竭患者治疗前后肝功能生化指标比较治疗45 d后,2组ALT、AST、TBIL、ALB和PTA较治疗前均显著改善(P均<0.05),且治疗组TBIL和PTA改善情况显著优于对照组(P均<0.05)。治疗组ALT、AST和ALB与对照组比较差异无统计意义(P均>0.05)。见表3。
2.4 2组肝衰竭患者治疗前后终末期肝病模型(model for end-stage liver disease,MELD)和Child-Pugh评分比较治疗45 d后,2组MELD和Child-Pugh评分较治疗前明显降低(P均<0.05),且治疗组的变化幅度明显高于对照组(P均<0.05)。见表4。
2.5 不良反应应用不良反应观察表记录不良反应,本组未发生严重不良反应事件。治疗组出现皮疹和恶心呕吐各1例,分别给予减缓输液速度和抗酸药物处理后好转,并继续完成用药疗程。
表3 2组肝衰竭患者治疗前后肝功能生化指标变化(±s)Table 3 Comparison of variations of liver function parameters of patients w ith liver failure before and after treatment between the treatment group and the control group(±s)
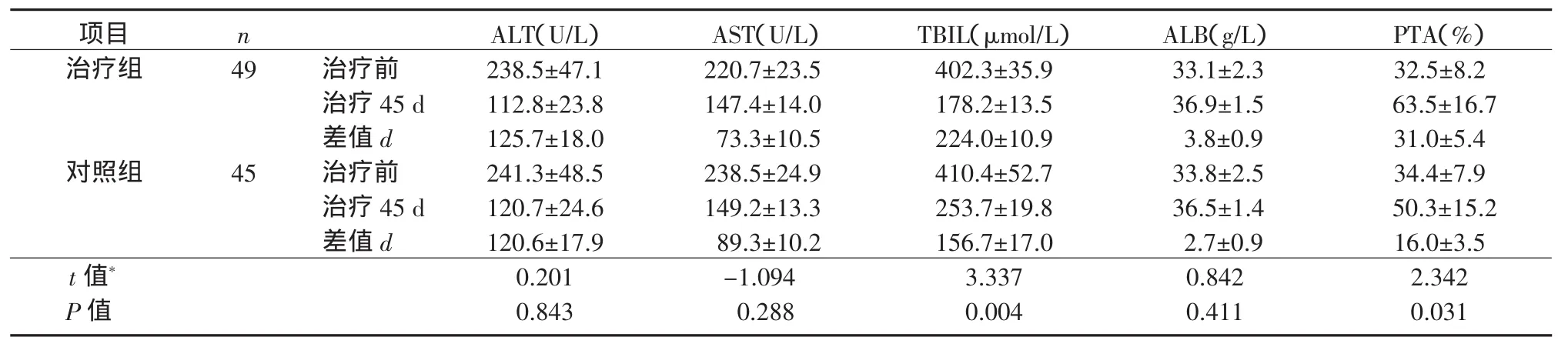
表3 2组肝衰竭患者治疗前后肝功能生化指标变化(±s)Table 3 Comparison of variations of liver function parameters of patients w ith liver failure before and after treatment between the treatment group and the control group(±s)
注:*2组之间差值d比较用成组t检验。同组治疗前后比较用自身配对t检验。治疗组:ALT,t=6.972,P=0.000;AST,t=7.005,P=0.000;TBIL,t=20.638,P=0.000;ALB,t=4.220,P=0.002;PTA,t=5.750,P=0.000。对照组:ALT,t=6.752,P=0.000;AST,t=8.788,P=0.000;TBIL,t= 9.215,P=0.000;ALB,t=2.852,P=0.019;PTA,t=4.562,P=0.001
项目nALT(U/L)AST(U/L)TBIL(μmol/L)ALB(g/L)PTA(%)治疗组49治疗前238.5±47.1220.7±23.5402.3±35.933.1±2.332.5±8.2治疗45 d112.8±23.8147.4±14.0178.2±13.536.9±1.563.5±16.7差值d125.7±18.073.3±10.5224.0±10.93.8±0.931.0±5.4对照组45治疗前241.3±48.5238.5±24.9410.4±52.733.8±2.534.4±7.9治疗45 d120.7±24.6149.2±13.3253.7±19.836.5±1.450.3±15.2差值d120.6±17.989.3±10.2156.7±17.02.7±0.916.0±3.5 t值*0.201-1.0943.3370.8422.342 P值0.8430.2880.0040.4110.031
表4 2组肝衰竭患者治疗前后MELD和Child-Pugh评分比较(±s)Table 4 Comparison of variations of MELD and Child-Pugh scores of patients w ith liver failure before and after treatment between the treatment group and the control group(±s)
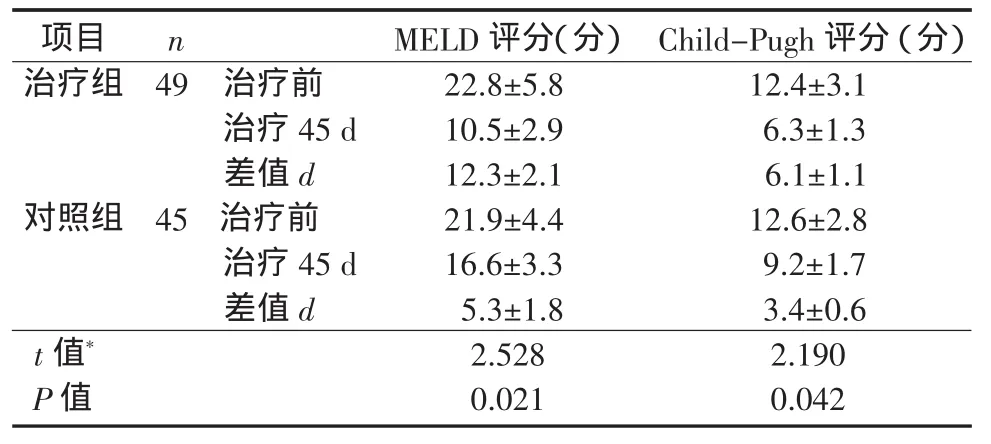
表4 2组肝衰竭患者治疗前后MELD和Child-Pugh评分比较(±s)Table 4 Comparison of variations of MELD and Child-Pugh scores of patients w ith liver failure before and after treatment between the treatment group and the control group(±s)
注:*2组之间差值d比较用成组t检验。同组治疗前后比较用自身配对t检验。治疗组:MELD评分,t=5.841,P=0.000;Child-Pugh评分,t=5.751,P=0.000。对照组:MELD评分,t=5.411,P=0.016;Child-Pugh评分,t=8.788,P=0.000
项目nMELD评分(分)Child-Pugh评分(分)治疗组49治疗前22.8±5.812.4±3.1治疗45 d10.5±2.96.3±1.3差值d12.3±2.16.1±1.1对照组45治疗前21.9±4.412.6±2.8治疗45 d16.6±3.39.2±1.7差值d5.3±1.83.4±0.6 t值*2.5282.190 P值0.0210.042
3 讨论
肝病是我国的常见病及多发病,严重威胁人类健康,应早发现、早诊断、早治疗。肝病患者早期如未能立即诊治,最终会发展为肝硬化失代偿期及肝衰竭等重症肝病。重症肝病目前主要以内科药物综合治疗为主,联合手术和人工肝等疗法[13,16]。然而,目前重症肝病的内科综合治疗因缺乏特效药,加之病情的复杂性和多变性,患者临床症状不能得到有效改善。随着肝损伤程度的加重,逐渐发生感染、上消化道出血、肝性脑病及肝肾综合征等多种并发症,加速病情恶化,病死率上升[17]。因此,积极寻求有效治疗重症肝病的药物至关重要,以期改善临床症状,降低病死率,提高患者生活质量。
NAC为单肽小分子,由L-半胱氨酸加乙酰基所形成[18]。截至目前为止,NAC仍然是治疗呼吸系统疾病的重要药物,在慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)、肺间质纤维化、急性肺损伤及急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)的治疗中发挥着关键作用[19]。NAC在COPD中的作用机制是通过降低血清/血浆中的中性粒细胞髓过氧化物酶,使外周多形核白细胞H2O2的释放减少,从而抑制肺泡巨噬细胞氧离子的产生,最终降低超氧化物歧化酶的含量,使氧化/抗氧化系统趋于动态平衡[20]。NAC还可应用于支气管哮喘的治疗,通过减少核转录因子-κB的合成,降低肿瘤坏死因子的产生,从而减轻肺组织的炎症反应。此外,NAC治疗急性肺损伤和ARDS时主要通过激活粒细胞内GSH的水平,减少氧自由基的产生,减轻氧自由基对肺组织的损伤,发挥辅助治疗作用。
近年来,国外学者提出“转化医学”一词,在临床医学中得到逐渐认可,其中一个成功案例是阿司匹林由镇痛药发展到心血管疾病的应用。NAC也由呼吸系统的广泛应用发展到消化系统疾病,尤其是重症肝病的应用中,国外学者将其称之为肝病转化医学“华丽转身”的典范[21]。大量基础研究证实,NAC除了作用于肺泡上皮细胞和红细胞外,还可作用于肝细胞、肝脏内皮细胞和库普弗细胞。NAC用于重症肝病的机制为:①NAC可提高机体内GSH的含量,GSH具有抗氧化、解毒等功能,分子中发挥活性作用的基团是半胱氨酸,而NAC因其分子量小可自由进入细胞,经脱乙酰基形成L-半胱氨酸GSH合成的前体,增加肝细胞内GSH的贮存,防止肝细胞坏死,减轻肝损伤[22];②NAC有增加NO的生物利用度和降低NO水平的双重作用,NAC作为NO的载体可提高NO的生物利用度,发挥其扩张微血管、增加氧的输送和释放、防止肝细胞损伤的作用;③NAC通过抑制诱导型一氧化氮合成酶,纠正过量NO生成保护肝细胞[23]。
基于美国研究组对173例NAC治疗非APAP引起的ALF的随机对照试验[24]和英国170例非APAP引起ALF儿童的回顾性研究[25],结果均提示NAC可提高患者生存率,药物不良反应少。本研究通过对266例重症肝病(包括肝硬化失代偿期和肝衰竭)采取维护肝细胞膜稳定性及肝细胞膜修复、抗病毒、合理应用抗生素、营养支持及输注新鲜血浆、全血或人血白蛋白等综合治疗,未使用GSH制剂,观察患者用药45 d(1个疗程)后的各项肝功能指标。研究结果显示,重症肝病治疗组和对照组的症状均有所改善,且治疗组改善情况明显优于对照组,差异有统计学意义。NAC治疗肝硬化失代偿期,可明显改善各项指标,其中TBIL、PTA和Child-Pugh评分这3项指标的变化幅度与对照组相比,差异有统计学意义。NAC治疗肝衰竭,TBIL、PTA、MELD及Child-Pugh评分指标的变化与对照组相比,差异有统计学意义。在治疗过程中虽然有极少数患者表现为皮疹和消化系统不良反应,但通过减慢滴速和抗酸药物治疗,不良反应消失[26]。
总之,目前重症肝病的治疗尚缺乏特效药和手段,其并发症的复杂性和多样性使肝衰竭临床表现变化多端,病情迅速恶化,病死率极高。在临床工作中应坚持早诊断、早治疗,强调综合治疗的重要性[27]。NAC作为重症肝病综合治疗方案中兴起的一种药物,仍须不断探索,以期达到更好的治疗效果,为循证医学寻找更多的临床研究证据。
[1]Santus P,Corsico A,Solidoro P,etal.Oxidative stress and respiratory system:pharmacological and clinical reappraisal of N-acetylcysteine[EB/OL].[2014-06-05].http://www.ncbi.nlm.nih.gov/-pubmed?term=Oxidative+Stress+and+Respiratory+System%3A+Pharmacological+and+Clinical+Reappraisal+of+N-Acetylcysteine&TransSchema=title&cmd=detailssearch.
[2]Polson J,LeeWM.AASLD position paper:themanagementof acute liver failure[J].Hepatology,2005,41(5):1179-1197.
[3]LeeWM,Larson AM,StravitzRT.AASLD position paper:themanagementofacute liver failure:update2011[EB/OL].[2014-06-01]. http://www.assld.org/practice guidlines/Document/Acute Liver Failure Update 2011.pdf.
[4]European Association for the Study of Liver.EASL clinical practical guidelines:management of alcoholic liver disease[J].JHepatol, 2012,57(2):399-420.
[5]Stravitz RT,Sanyal AJ,Reisch J,etal.Effects of N-acetylcysteine on cytokines in non-acetaminophen acute liver failure:potential mechanism of improvement in transplant-free survival[J].Liver Int, 2013,33(9):1324-1331.
[6]中华医学会感染病学分会肝衰竭与人工肝学组,中华医学会肝病学分会重型肝病与人工肝学组.肝衰竭诊治指南(2012年版)[J].实用肝脏病杂志,2013,16(3):210-216.
[7]李梦东,聂青和.重视肝衰竭并发症的诊治研究[J].实用肝脏病杂志,2014,17(2):113-116.
[8]Czaja AJ.Hepatic inflammation and progressive liver fibrosis in chronic liver disease[J].World JGastroenterol,2014,20(10):2515-2532.
[9]Woodhead JL,Howell BA,Yang Y,etal.An analysis of N-acetylcysteine treatment for acetaminophen overdoseusinga systemsmodel of drug-induced liver injury[J].JPharmacol Exp Ther,2012,342 (2):529-540.
[10]科技部十二五重大专项联合课题组专家.乙型肝炎病毒相关肝硬化的临床诊断、评估和抗病毒治疗的综合管理[J].传染病信息,2014,27(2):Ⅰ-Ⅹ,111.
[11]中华医学会传染病与寄生虫病学分会,中华医学会肝病学分会.病毒性肝炎防治方案[J].传染病信息,2000,13(4):141-150.
[12]中华医学会肝病学分会,中华医学会感染病学分会.慢性乙型肝炎防治指南(2010年版)[J].传染病信息,2011,24(1):Ⅲ-ⅩⅤ.
[13]聂青和.肝衰竭综合治疗进展[J].实用肝脏病杂志,2013,16(1): 17-19.
[14]臧红,辛绍杰.终末期肝病相关并发症的管理和规范诊治[J].传染病信息,2014,27(2):65-68.
[15]聂青和.肝衰竭实验室检测临床价值及新指标评价[J].临床肝胆病杂志,2013,29(9):666-669.
[16]聂青和.重型肝炎综合治疗进展的临床教学实践及体会[J].实用肝脏病杂志,2006,9(2):104-106.
[17]Zamora Nava LE,Aguirre Valadez J,Chávez-Tapia NC,et al.A-cute-on-chronic liver failure:a review[J].Ther Clin Risk Manag, 2014,10:295-303.
[18]Samuni Y,Goldstein S,Dean OM,et al.The chemistry and biological activities of N-acetylcysteine[J].Biochim Biophys Acta, 2013,1830(8):4117-4129.
[19]Lambert AA,Parker AM,Moon KK.High-dose N-acetylcysteine in chronic obstructive pulmonary disease,prone positioning in acute respiratory distress syndrome,and continuous positive airway pressure and exhaled nitric oxide in obstructive sleep apnea[J]. Am JRespir Crit Care Med,2014,189(2):223-224.
[20]Zheng JP,Zhong NS.N-acetylcysteine for COPD:the evidence remains inconclusive--authors'reply[J].Lancet Respir Med,2014, 2(4):e3-e4.
[21]李梦东,聂青和.肝衰竭的研究现状与展望[J].实用肝脏病杂志,2013,16(1):9-11.
[22]Bartlett DC,Hodson J,Bhogal RH,etal.Combined use of N-acetylcysteine and Liberase improves the viability and metabolic function ofhumanhepatocytes isolated from human liver[J].Cytotherapy,2014, 16(6):800-809.
[23]李谨革,聂青和.肝衰竭并发肝肾综合征临床诊治进展[J].实用肝脏病杂志,2014,17(2):198-201.
[24]Lee WM,Hynan LS,Rossaro L,et al.Intravenous N-acetylcysteine improves transplant-free survival in early stage non-acetaminophen acute liver failure[J].Gastroenterology,2009,137(3):856-864.
[25]Kortsalioudaki C,Taylor RM,Cheeseman P,et al.Safety and efficacy of N-acetylcysteine in children with non-acetaminophen-induced acute liver failure[J].Liver Transpl,2008,14(1):25-30.
[26]Abdoli N,Azarmi Y,Eghbal MA.Protective effects of N-acetylcysteine against the statins cytotoxicity in freshly isolated rat hepatocytes[J].Adv Pharm Bull,2014,4(3):249-254.
[27]聂青和.肝硬化慢性肝衰竭临床治疗实践[J].中国实用内科杂志,2013,33(9):698-701.
(2014-06-13收稿 2014-07-03修回)
(责任编委 张玲霞 本文编辑 陈玉琪)
Therapeutic efficacy of N-acetylcysteine in treatment of patientsw ith severe liver diseases
ZHU Ting,NIE Qing-he*,LIJin-ge,CAO Yi-zhan,ZHAO Bao-min,GAO Lu-hua,WANG Yuan-yuan,LIMi
Department of Infectious Diseases,PLA Center for Infectious Diseases Diagnosis and Treatment, Tangdu Hospital,Fourth Military Medical University,Xi'an,Shaanxi710038,China
*Corresponding author,E-mail:nieqinghe@163.com
Objective To investigate the therapeutic efficacy and safety of N-acetylcysteine(NAC),which is regarded as the model of“gorgeous turn”of translationalmedicine,in treatment of patients with severe liver diseases.M ethods A total of 266 patients with severe liver diseases due to HBV infection were enrolled in the study,and randomized into a treatment group(n=136, 87 with decompensated liver cirrhosis,and 49 with liver failure)and a control group(n=130,85 with decompensated liver cirrhosis, and 45 with liver failure).All of the 266 patients were given the comprehensive treatmentmeasures,such asmaintaining hepatocyte membrane stable and hepatocyte membrane repair,antiviral therapy,rational use of antibiotics,nutritional support and the transfusion of fresh plasma,whole blood or albumin.Neither the treatment group nor the control group was treated with glutathione preparation.Additionally,the treatment group was given a daily dose of 8 g NAC for 45 days.Liver function parameters,model for endstage liver disease(MELD)and Child-Pugh scoresand adverse reactionswere observed after 45 days of treatment.Results The symptoms were improved both in the treatment group and in the control group.In the treatment group,some or all of the liver function parameters were markedly improved,and the MELD and Child-Pugh scores decreased markedly after 45 days of treatment.The improvement of the treatment group was significantly greater than that of the control group(P<0.05).There were no severe adverse reactions associated with NAC during treatment.Conclusions NAC can improve liver function parameters of patients with severe liver diseasesmarkedly,and has no severe adverse reactions during treatment.NAC injection can be widely used in clinical practice.
acetylcysteine;liver cirrhosis;liver diseases;liver failure
R341.1;R575.2
A
1007-8134(2014)04-0209-05
710038西安,第四军医大学唐都医院传染病科全军感染病诊疗中心(朱婷、聂青和、李谨革、高禄化、王媛媛、李汨),急诊科(曹义战),消化内科(赵保民)
聂青和,E-mail:nieqinghe@163.com
