蛭龙活血通瘀胶囊对局灶性脑缺血大鼠脑组织促血管生成素-1及Tie-2表达的影响
2014-04-27杨思进黄帅金
吴 英 ,郑 直 ,白 雪 ,杨思进 ,黄帅金
(1.泸州医学院附属中医院,四川 泸州 646000; 2.泸州市人民医院,四川 泸州 646000)
脑梗死因高发病率、高死亡率、高致残率而成为严重威胁人 类生命健康的重大疾病之一,其预后与病灶微循环的改善及神经组织修复密切相关。研究发现,新形成的侧支血管可改善缺血区周围组织灌流,促进脑卒中后神经功能恢复[1]。因此,通过血管新生启动损伤区微血管网重建是脑组织修复的重要过程。蛭龙活血通瘀胶囊由黄芪、水蛭、地龙、大血藤等组方,具有益气、活血化瘀通络、祛风的功效。经研究发现,蛭龙活血通瘀胶囊能明显促进局灶性脑缺血大鼠神经功能恢复,其机制可能与促进缺血脑组织促血管生成素 -1(Ang-1)、酪氨酸激酶 -2(Tie-2)表达有关。
1 材料与方法
1.1 试药与动物
Ang-1兔抗鼠多克隆抗体(北京四正柏生物科技有限公司,批号为110601);Tie-2兔抗鼠多克隆抗体(北京博奥森生物技术有限公司,批号为YE1030W);磷酸盐缓冲液(PBS,北京四正柏生物科技有限公司);DAB显色试剂盒(北京四正柏生物科技有限公司)。蛭龙活血通瘀胶囊(泸州医学院附属中医院制剂室,批号为20121212);步长脑心通胶囊(咸阳步长制药有限公司,批号为120995)。健康雄性SD大鼠150只,体重250~300 g,由泸州医学院动物实验中心提供,动物合格证编号为SYXK(川2008-065),于室温普通饲料喂养。
1.2 方法
1.2.1 造模及分组
参照 Longa等[2-4]报道的线栓改良法造大脑中动脉阻塞(MCAO)动物模型,造模动物自然苏醒后,参照Zealonga评分标准[2]进行5分制评分。评分标准:无神经损伤症状,0分;不能完全伸展对侧前爪,1分;向外侧转圈,2分;行走时向对侧倾倒,3分;不能自发行走,意识昏迷,4分。将术后24 h评分为1~3分的大鼠选入组,剔除其余动物,作随机补充。用随机数字表法将120只造模大鼠分为6组,即蛭龙活血通瘀胶囊高剂量组、中剂量组、低剂量组,步长脑心通胶囊对照组,模型组,假手术组。
1.2.2 药物干预
蛭龙活血通瘀胶囊成人(体重按60 kg计算)的临床用药量为 4.8 g /d,按人体用量的 5,10,20 倍,换算动物低、中、高剂量组的用药量分别为0.4,0.8,1.6 g/kg;脑心通组按成人用量的10倍给药,即0.8 g/kg。各药物干预组均给予等体积(3mL)相应浓度的药物灌胃,假手术组及模型组给予等体积(3mL)的生理盐水灌胃,每日1次,连续7 d,并按体重调整给药量。
1.2.3 指标采集及检测方法
神经功能缺损评分:各组大鼠灌胃7 d后,依照Zealonga5分制评分方法进行神经功能缺损评分,判断各组大鼠神经功能恢复情况。
免疫组化标本制备及检测:脑缺血7 d后,各组大鼠以4%多聚甲醛进行脑组织固定后,SP法Ang-1及Tie-2免疫组化染色,DAB显色。任何被Ang-1及Tie-2抗体染成棕黄色或棕褐色的细胞均视为阳性表达。
计算机图像分析:采用Image-Pro-Plus 6.0图像分析软件进行图像分析,每只大鼠随机选取3张切片,每张切片随机选择3个不同视野,计数视野内阳性细胞数(被染成棕黄色或棕褐色为阳性细胞),每组所有照片的平均阳性细胞数代表该组的阳性细胞数。
1.2.4 统计学处理
采用SPSS 11.5统计软件,计量资料以表示,组间比较采用单因素方差分析(OneWay Aonva),两两对比采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 神经功能缺损评分
结果见表1。可见,与假手术组比较,模型组及给药各组大鼠出现明显神经功能缺损症状,神经功能缺损评分均升高。与模型组比较,活血通瘀胶囊高、中、低剂量组神经功能缺损症状均明显改善,以高剂量组尤为明显。
表1 各组大鼠神经功能缺损评分比较( ± s,n=20)

表1 各组大鼠神经功能缺损评分比较( ± s,n=20)
注:与假手术组比较,★P<0.05,▲P<0.01;与模型组比较,●P<0.05,◆P<0.01;与蛭龙活血通瘀胶囊低剂量组比较,◎P<0.05。
组别假手术组模型组蛭龙活血通瘀胶囊低剂量组蛭龙活血通瘀胶囊中剂量组蛭龙活血通瘀胶囊高剂量组步长脑心通对照组剂量(g/kg)001.60.80.40.8神经体征评分(分)02.98±0.98▲2.49±0.83★●2.15 ±0.87★◆◎1.94 ±0.53★◆◎2.01 ±0.74★◆◎
2.2 脑组织Ang-1及Tie-2阳性细胞计数
结果见图1、图2及表2。可见,Ang-1及Tie-2在假手术组脑组织血管内皮细胞阳性表达量极少。模型组大鼠脑缺血区血管内皮细胞阳性表达较假手术组增多,差异有统计学意义(P<0.05)。蛭龙高、中、低剂量组大鼠脑缺血皮层神经细胞和血管内皮细胞阳性表达明显增加,均强于模型组(P<0.01或P<0.05),以高剂量组尤为显著。
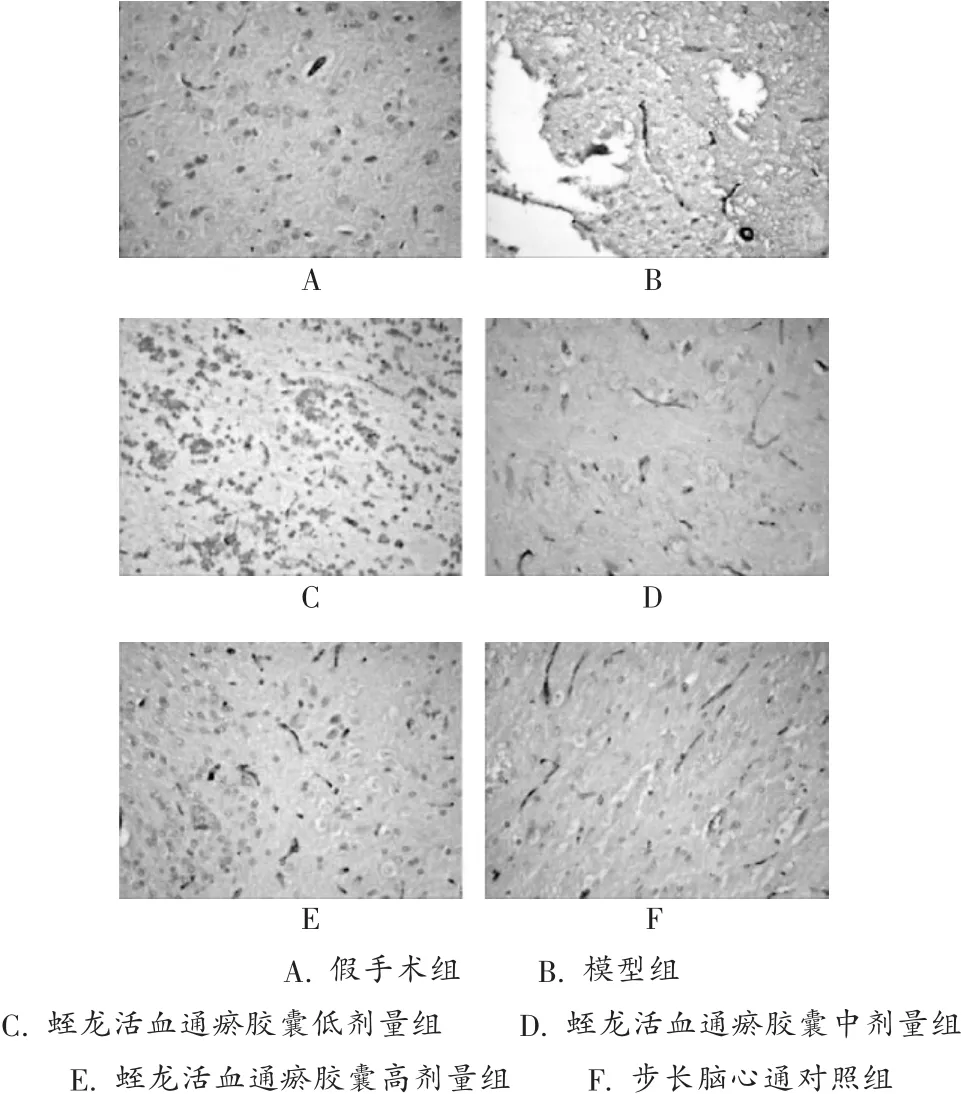
图1 大鼠脑组织Ang-1的表达图像(×400)
3 讨论

图2 大鼠脑组织Tie-2表达(×400)
表2 各组大鼠脑组织Ang-1及Tie-2表达比较( ± s,n=20)

表2 各组大鼠脑组织Ang-1及Tie-2表达比较( ± s,n=20)
注:与假手术组比较,▲P<0.05,◆P<0.01;与模型组比较,●P<0.05,■P<0.01;与蛭龙活血通瘀胶囊低剂量组比较,★P<0.05。
T i e-2组别 剂量(g/k g)A n g-14.06±1.017.87±0.73▲9.84±0.60◆●13.15±1.06◆■★13.47±0.99◆■★13.12±0.66◆■★假手术组模型组蛭龙活血通瘀胶囊低剂量组蛭龙活血通瘀胶囊中剂量组蛭龙活血通瘀胶囊高剂量组步长脑心通对照组0 00.40.81.60.84.47±1.3811.89±0.71▲13.88±1.37◆●19.01±0.59◆■★20.30±0.27◆■★19.48±0.58◆■★
Ang-1是一族特异性作用于血管内皮细胞的生长因子,含免疫球蛋白样环和上皮生长因子样域Tie-2。Tie-2为Ang-1内皮特异性酪氨酸激酶受体,Ang-1以旁分泌形式与Tie-2受体结合,触发血管内皮细胞和血管周细胞相互作用,促进血管稳定和成熟,并维持成熟血管的完整性及静息状态[5]。在对脑卒中的研究中发现,缺血缺氧可诱导Ang-1/Tie-2的表达,进而调节脑损伤区微血管新生过程[6]。研究发现,脑缺血-再灌注后Ang-1表达增加,与Tie-2结合,可抑制脑微血管内皮细胞凋亡[7],减轻血管内皮生长因子(VEGF)产生的血管通透作用,减少脑缺血后血脑屏障的渗漏,降低脑水肿的程度[8]。Ang-1除了促进脑缺血后血管新生,还可保护神经元、抑制神经细胞凋亡并刺激神经发生[9]。其机制可能为Ang-1促使PI-3激酶活化和激活丝氨酸-苏氨酸蛋白酶,抑制胞浆内特异性识别天冬氨酸位点蛋白 - 3(Caspase -3)裂解,干预神经细胞凋亡[10]。本研究结果显示,与模型组比较,蛭龙活血通瘀胶囊高、中、低剂量组大鼠Ang-1及 Tie-2表达明显升高(P<0.01或P<0.05),表明蛭龙活血通瘀胶囊可能通过促进脑缺血区Ang-1及Tie-2表达,促进缺血区形成稳定的成熟血管网,修复神经损伤,发挥脑保护作用。
参考文献:
[1]Zhang ZG,Zhang L,Jiang Q,et al.VEGF chances angiogenesis and promotes blood - brain barrier leakage in the ischemic brain[J].JClin Invest,2000,106(7):829 - 838.
[2]Longa EZ,Weinstin PR,Carlson S,et al.Reversiblemiddle cerebral artery occlusion withoutcraniectomy in rats [J].Stroke,1989,20(1):84 -91.
[3]黄 斌,王兴勇,匡凤梧,等.线栓法制备Wistar大鼠局灶性脑缺血模型的实验研究[J]. 现代医药卫生,2005,21(15):1935 -1937.
[4]刘运泉,戴 颖.线栓法大鼠局灶性脑缺血模型的改进[J].中国临床解剖学杂志,2005,23(2):222 -223.
[5] Sundberg C,Kowanetz M,Brown LF,et al.Stable expression of Angiopoietin-1 and othermarkers by cultured pericytes:phenotypic similarities to a subpopulation of cells in maturing vessels during later stages of Angiogenesis in vivo [J].Lab Invest,2002,2(4):387 - 401.
[6] Kampfer H,Pfeilschirer J,Frank S,etal.Eapression regulation of Angiopoietin-1 and-2 and the Tie-1 and-2 receptor tyrosine kinases during cutancouswound healing:a comparative study ofnormaland repair[J].Lab Invest,2001,81(3):361 - 373.
[7] Vonnahme KA,Radmer DA,Borowezyk E,et al.Vascular composition,apoptosis,and axpression of Angiogenic factors in the corpus luteum during prostaglandin F2 alpha - induced regression in sheep[J].Reproduction,2006,131(60):1115 - 1126.
[8] Lee SW,Kim WJ,Jun HO,et al.Angiopoietin-1 reduces vascular endothelial growth factor-induced brain endothelial permeability via upregulation of ZO - 2[J].Int JMolMed,2009,23(2):279 - 284.
[9]Bai Y,Cui M,Meng Z,et al.Ectopic expression of Angiopoietin-1 promotes neuronal differentiation in neural progenitor cells through the Akt pathway[J].Biochem Biophys Res Commun,2009,378(2):296 - 301.
[10]Valable S,Ballail A,Lesne S,et al.Angiopoietin-1-induced PI3-kinase activation prevents neuronal apotosis[J].Faseb J,2003,17(3):443-445.
