盐胁迫下植物细胞离子流变化的研究进展
2014-04-27左照江张汝民高岩
左照江,张汝民,高岩
(浙江农林大学林业与生物技术学院,浙江临安 311300)
盐胁迫下植物细胞离子流变化的研究进展
左照江,张汝民,高岩
(浙江农林大学林业与生物技术学院,浙江临安 311300)
土壤盐化是全球面临的最严峻的环境问题之一,盐离子在细胞内大量积累会对植物造成毒害。在盐胁迫下,钠离子(Na+)通过非选择性阳离子通道进入胞内并引起质膜去极化,进而激活外向钾离子(K+)通道使钾离子外流。在耐盐植物中,钾离子外流可被明显抑制,从而维持胞内较高的K+/Na+以降低盐胁迫伤害。植物细胞质膜上的H+-ATP酶可将氢离子(H+)泵到胞外,从而形成质子动力势以驱动Na+/H+反向运输体将胞内钠离子排出。钙离子(Ca2+)在盐胁迫条件下会流向胞内,使胞内钙离子浓度升高,进而调控钠离子和钾离子的跨膜流动。氯离子(Cl-)在盐胁迫下会流向胞外,这种流动可能与钠离子外流相偶联。主要就这几种离子在盐胁迫下的跨膜流动及其调控机制进行综述,以期对离子流的深入研究有所帮助。图2参60
植物学;离子流;盐胁迫;综述;盐过敏感调控途径;K+/Na+平衡
土壤盐化是影响作物生产的主要环境问题之一,目前全球约有7%的陆地正在发生不同程度的盐化[1],约1/3耕地受到盐化影响[2-3]。土壤盐化可通过直接和间接的方式影响植物生长,其直接影响主要是降低土壤水势阻碍植物根系吸水以及盐离子在植物体内过量积累所造成的毒害,间接影响主要是诱导植物体内产生大量的活性氧从而引起次生胁迫伤害[2,4-5]。在盐(氯化钠,NaCl)胁迫下,植物通过细胞内外离子的跨膜流动,从而减少盐离子在细胞内积累并达到新的离子平衡,进而提高其抵抗盐胁迫的能力[2,6-7]。随着非损伤微测技术的出现,离子跨膜流动的研究得到迅速发展。本文主要就盐胁迫下植物细胞内外的钠离子(Na+),钾离子(K+),氢离子(H+),钙离子(Ca+)和氯离子(Cl-)等的流动变化进行综述。
1 钠离子(Na+)流
钠离子(Na+)是盐胁迫的主要毒害离子,其吸收、运输和区域化储存决定了植物能否在盐胁迫下生存。植物除了抑制钠离子(Na+)吸收外,还可通过质膜上的Na+/H+反向运输体(SOS1)排出或通过液泡膜上的Na+/H+反向运输体(AtNHX)转运至液泡[2,4],从而降低细胞质中钠离子(Na+)浓度。
SOS1位于细胞质膜上,是植物盐过敏感调控途径[salt overly sensitive(SOS)signal-transduction pathway]中的反向Na+/H+运输体,在植物抵抗盐胁迫中具有重要的钠离子(Na+)排出作用[8-10]。拟南芥Arabidopsisthalianasos1突变体与野生型植株相比,在氯化钠(NaCl)胁迫下细胞内会积累较多钠离子(Na+),其抗盐性明显降低[11];而过表达SOS1拟南芥植株则具有较高的钠离子(Na+)排出能力,其抗盐性明显提高[12]。在高羊茅Festucaarundinacea同一植株中转入拟南芥SOS1,SOS2和SOS3等3种基因,其钠离子(Na+)排出速率显著提高,抗盐性明显增强[13]。
大豆Glycinemax叶肉细胞在氯化钠(NaCl)胁迫后,钠离子(Na+)迅速内流,然而几分钟后钠离子(Na+)内流显著降低,并且表现出钠离子(Na+)外流[14]。胡杨Pobuluseubhratica根在50 mmol·L-1氯化钠(NaCl)短时间(24 h)胁迫和100 mmol·L-1氯化钠(NaCl)长期(15 d)胁迫后均具有很高的钠离子(Na+)排出能力,同时其原生质体在短期盐胁迫中也具有明显的钠离子(Na+)排出能力[6]。由此可见,SOS1可在短时间被氯化钠(NaCl)胁迫所诱导激活,同时其钠离子(Na+)排出能力可长期保持。SOS1的激活可能存在多种方式,其中最主要的是钙离子(Ca2+)所介导的信号途径。钠离子(Na+)胁迫诱导胞内钙离子(Ca2+)浓度升高,从而活化具有类似于钙离子(Ca2+)依赖型磷酸酶特性的SOS3,SOS3再与SOS2结合进而激活SOS1(图1)[8]。Bose等[15]通过在拟南芥中过表达血红素氧化酶研究表明,活性氧可能具有激活SOS1的能力。此外,SOS1还有可能被钠离子(Na+)直接激活(图1),然而目前尚缺乏此方面的直接证据[8]。
NHX蛋白家族是位于液泡膜上的Na+/H+反向运输体,其转录水平可为脱落酸(ABA)和盐胁迫所调控[16]。小麦Triticumaestivum耐盐品种‘Kharchia 65'在盐胁迫下SOS1和NHX1活性及其基因转录水平均明显提高,因此,钠离子(Na+)可有效地排出细胞和排入液泡,从而降低细胞质中钠离子(Na+)浓度以提高耐盐性[17]。在多种植物中转入拟南芥NHX1基因以及在拟南芥中过表达液泡膜上的H+-焦磷酸酶基因均能有效提高植物抗盐性。这表明在盐胁迫下钠离子(Na+)可通过NHX流入液泡,同时在此过程中需要水解ATP提供能量[18,19]。对拟南芥sos1,sos2和sos3突变体植株进行盐胁迫处理,其NHX1表达量未受影响,这表明NHX1的表达与SOS途径无关[16]。

图1 SOS信号转导途径Figure 1 SOS signal-transduction pathway
2 氢离子(H+)流
在盐胁迫下,胞外氢离子(H+)顺着质子动力势内流从而驱动钠离子(Na+)通过SOS1排出,而质子动力势的形成则需要质膜上H+-ATP酶水解三磷酸腺苷(ATP)将胞内氢离子(H+)泵到胞外[10,12]。蚕豆Vacia faba叶肉组织在氯化钠(NaCl)胁迫后氢离子(H+)外流明显增加,采用原钒酸盐抑制质膜H+-ATP酶后,其氢离子(H+)外流的增加量也被明显抑制。这表明氯化钠(NaCl)胁迫可诱导质膜H+-ATP活化,从而促进氢离子(H+)外流以参与植物细胞对盐胁迫的应答反应[14]。胡杨是抗盐碱植物,其根尖在低盐胁迫下发生明显的氢离子(H+)外流,而不抗盐碱的群众杨Populuspopularis则无此现象;随着盐胁迫时间延长,氢离子(H+)从胡杨根尖和原生质体外流明显增加,而群众杨则无明显变化[6]。胡杨细胞经低盐胁迫后再用50mmol·L-1氯化钠(NaCl)进行胁迫处理,氢离子(H+)内流增加,同时此内流现象可为原钒酸盐和阿米洛利(SOS1抑制剂)所抑制,这可能是由于高浓度盐胁迫需要更多的氢离子(H+)内流以驱动钠离子(Na+)外流,因此,氢离子(H+)内流增加[6]。Guoa等[20]研究发现,氯化钠(NaCl)处理15min后,拟南芥sos1突变体根分生区氢离子(H+)外流,细胞碱性化;而sos2和sos3突变体以及野生型植株则表现为氢离子(H+)内流,细胞微弱酸化。这与Shabala等[8]的研究结果相一致,sos1突变体由于缺失Na+/H+反向运输体,被H+-ATP酶泵到胞外的氢离子(H+)不能迅速回流,因此表现为外流;而sos2和sos3突变体以及野生型植株具有Na+/H+反向运输体,泵到胞外的氢离子(H+)驱动钠离子(Na+)外排而发生内流。
3 钾离子(K+)流
植物在受到盐胁迫后,大量的钠离子(Na+)进入细胞,而细胞内的钾离子(K+)则发生外流,并且此种外流现象不仅存在于根中,同时也存在于叶片之中[21-23]。钾离子(K+)外流与质膜去极化密切相关[24],盐胁迫下进入细胞内的钠离子(Na+)会中和膜内负电荷使质膜发生去极化,进而活化外向钾离子(K+)通道(KORC)使钾离子(K+)外流[8,25-26]。耐盐大麦Hordeumvulgare在氯化钠(NaCl)胁迫下能保持很高的膜负电位,从而抑制质膜发生去极化,进而抑制KORC以阻止钾离子(K+)外流[27]。与盐胁迫不同,在渗透胁迫下K+发生内流。采用90mmol·L-1氯化钠(NaCl)处理大豆叶肉细胞,其细胞内钾离子(K+)发生明显外流;而采用甘露醇进行等渗胁迫,胞外的钾离子(K+)则发生明显内流[14]。这表明植物在感知和响应盐胁迫与渗透胁迫上存在明显差异。除高等植物外,在大肠埃希菌Escherichiacoli中也有此现象存在[28]。
在盐胁迫条件下,外源物质可通过抑制外向钾离子(K+)通道而阻止钾离子(K+)外流。Cuin等[24]测定了26种氨基酸对氯化钠(NaCl)诱导大麦根表皮细胞钾离子(K+)流的作用,其中21种氨基酸能明显缓解钾离子(K+)外流。采用多胺(精胺、亚精胺、腐胺)处理玉米Zeamay和拟南芥根后再进行氯化钠(NaCl)胁迫,根成熟区钾离子(K+)外流被明显抑制[29],其原因可能是多胺通过影响非选择性阳离子通道(NSCCs)而阻止了钾离子(K+)外流[30]。水杨酸处理可降低氯化钠(NaCl)胁迫引起的质膜去极化,从而抑制KORC活化,因此在短期胁迫后(1 h)可以减少钾离子(K+)外流,而在长期胁迫后(14 d)可提高细胞内钾离子(K+)浓度[31]。Shabala等[23]采用膜片钳技术研究发现拟南芥细胞质膜上存在2种对钙离子(Ca2+)敏感的K+通道,外施钙离子(Ca2+)可直接或间接[降低氯化钠(NaCl)诱导的质膜去极化]调控K+外流通道,从而减少细胞内钾离子(K+)外流。硫化氢(H2S)是重要的信号物质,参与植物体内多种生理过程的调控[32-34]。采用其处理胡杨和群众杨根后,在氯化钠(NaCl)胁迫条件下钾离子(K+)外流被明显抑制,其原因可能为硫化氢(H2S)通过上调SOS1,从而促进钠离子(Na+)外流,阻止质膜去极化,因此,抑制了KORC活化和钾离子(K+)外流[35]。
盐胁迫除了诱导钾离子(K+)外流外,还会降低细胞对钾离子(K+)的吸收,这可能与钾离子(K+)和钠离子(Na+)竞争细胞膜上的吸收位点有关[36-38]。钾离子(K+)外流增加、内流减少将会大大降低细胞内钾离子(K+)含量,改变细胞内适宜的K+/Na+比值,从而使植物受到盐胁迫伤害。Chen等[39]通过对70个品种的大麦进行研究发现,大麦幼苗根的净钾离子(K+)流[氯化钠(NaCl)处理40 min]与氯化钠(NaCl)胁迫1个月后植株的生理响应[生长速率、生物量、净二氧化碳(CO2)同化速率、叶绿素荧光等]之间密切相关(R>0.8)。在氯化钠(NaCl)胁迫下,耐盐和敏感大麦钾离子(K+)外流量之间存在明显差异,其中敏感植株钾离子(K+)外流现象明显[39-40]。在烟草Nicotianatabacum植株内转入动物抗凋亡基因CED-9后,可通过抑制钾离子(K+)外流来提高其耐盐和抗氧化胁迫能力。这可能与CDE-9调控KORC和NSCCs等2种钾离子(K+)通道有关[41]。耐盐植物通过减少钾离子(K+)外流以维持细胞内较高的钾离子(K+)含量和K+/Na+,从而维持正常的细胞代谢,进而提高其抵抗盐胁迫的能力[42-43]。
4 钙离子(Ca2+)流
钙离子(Ca2+)是植物细胞内重要的信号物质,在植物抵抗盐胁迫中具有重要的调控作用(图1):①钙离子(Ca2+)通过调控钠离子(Na+)进入细胞的主要通道NSCCs从而抑制钠离子(Na+)内流[37,44-45],并且此种调控作用与胞外钙离子(Ca2+)和钠离子(Na+)的比率无关,而与胞外钙离子(Ca2+)浓度有关[46-48];②通过抑制KORC而阻止钾离子(K+)外流[23];③启动SOS信号转导途径[49-50]。在氯化钠(NaCl)胁迫下,胞外钙离子(Ca2+)向细胞内流动,从而使胞内钙离子(Ca2+)浓度呈线性增加[51]。虽然渗透胁迫也会引起细胞质内钙离子(Ca2+)浓度升高,但是其来源于细胞内钙库释放,因此,其升高机制与盐胁迫不同[52]。Ma等[13]采用氯化钠(NaCl)处理转拟南芥SOS1+SOS2+SOS3基因的高羊茅植株发现,野生型和转基因植株均发生钙离子(Ca2+)内流现象,并且转基因植株钙离子(Ca2+)内流速率较高,其原因可能为转基因植株含有较多的SOS3蛋白,需要有较多的钙离子(Ca2+)进行活化,因此,钙离子(Ca2+)内流量明显高于野生型植株。
钙离子(Ca2+)内流与质膜上的钙离子(Ca2+)内流通道和羟自由基(OH·)密切相关,盐胁迫下质膜上的还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶在将电子传递给氧(O2)时会在胞外产生大量超氧阴离子自由基(O2-·),这些O2-·迅速转化为过氧化氢(H2O2)和OH·,其中OH·可活化质膜上的钙离子(Ca2+)内流通道,从而使胞外钙离子(Ca2+)通过其流入胞内[7,53]。Sun等[54]研究表明,过氧化氢(H2O2)活化了质膜上的钙离子(Ca2+)内流通道,从而使胞外钙离子(Ca2+)流入胞内(图2)。由此可见:活性氧在钙离子(Ca2+)+内流过程中具有重要的调控作用。采用二磷酸腺苷(ADP)处理拟南芥根后,钙离子(Ca2+)发生内流,胞内钙离子(Ca2+)浓度升高,同时此内流现象可在极短时间内(1 s)发生;三磷酸腺苷(ATP)处理则会引起钙离子(Ca2+)外流,因此,在植物细胞膜上可能存在有ADP与ATP调控的钙离子(Ca2+)通道,然而此通道在氯化钠(NaCl)胁迫后如何转运钙离子(Ca2+)目前尚无相关报道[55]。
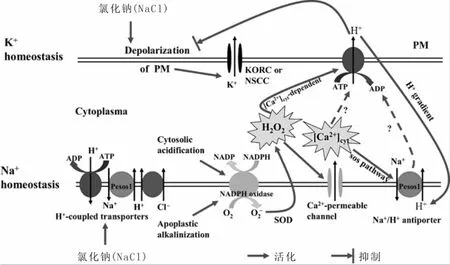
图2 氯化钠(NaCl)胁迫下植物细胞内的离子流[54]Figure 2 Plant cellular ion flux in response to NaCl stress
5 氯离子(Cl-)流
在木本植物中,氯离子(Cl-)的毒害作用比钠离子(Na+)更为严重[2,56],然而目前对氯离子(Cl-)流响应盐胁迫的研究则相对较少。在氯化钠(NaCl)胁迫下,大豆叶肉细胞[14]、拟南芥[57]和胡杨根细胞[6,58]内的氯离子(Cl-)会发生明显外流,并且随着氯化钠(NaCl)胁迫时间的延长,胡杨根细胞内氯离子(Cl-)外流逐渐增加[58-59]。Lorenzen等[55]推测氯离子(Cl-)外流可能与钠离子(Na+)外流相偶联,然而氯离子(Cl-)通过何种机制发生跨膜流动尚不清楚。采用甘露醇和山梨醇对拟南芥进行渗透胁迫,其根表皮细胞外的氯离子(Cl-)向胞内流动[60]。在高渗胁迫时胡杨根外的氯离子(Cl-)内流,其中在距根尖700~1 200μm处内流最为明显[6]。由此可见,植物细胞氯离子(Cl-)流对盐胁迫和渗透胁迫的响应机制存在明显差异。
6 结束语
在氯化钠(NaCl)胁迫下,细胞质膜发生去极化,进而活化KORC和NSCCs使钾离子(K+)发生外流。通过质膜上NADPH氧化酶产生的活性氧(H2O2和OH·)可活化钙离子(Ca2+)通道引起钙离子(Ca2+)内流,从而使胞内钙离子(Ca2+)浓度升高以激活SOS信号途径,进而通过Na+/H+反向运输体排出钠离子(Na+)。胞内H2O2可诱导依赖于钙离子(Ca2+)的H+-ATP酶活化,使胞内氢离子(H+)外流,从而促进Na+/H+反向运输体运转。氢离子(H+)外流还可阻止质膜去极化,抑制钾离子(K+)通过KORC和NSCCs外流(图2)[54]。在此过程中,植物细胞通过减少钾离子(K+)外流和促进钠离子(Na+)外流以维持胞内K+/Na+平衡,然而离子的跨膜流动是一个复杂的响应过程,除了已知的几种通道外,是否还有其他通道参与离子跨膜流动,尤其是氯离子(Cl-)通道尚不清楚,同时这些通道如何进行调控亦不明确,这些都需要进行深入研究。离子再平衡后对植物相关基因表达和细胞器有何影响、以及此过程如何调控尚不清楚。对这些问题进行系统研究,对揭示盐胁迫如何诱导植物进行迅速响应具有重要价值,同时对提高植物抗盐性研究也具有重要意义。
[1]MUNNSR.Comparative physiology of saltand water stress[J].PlantCellEnviron,2002,25(2):239-250.
[2]MUNNSR,TESTER M.Mechanisms of salinity tolerance[J].AnnuRevPlantBiol,2008,59:651-681.
[3]KRONZUCKER H J,BRITTO D T.Sodium transport in plants:a critical review[J].NewPhytol,2011,189(1):54-81.
[4]ZHU Jiankang.Plant salt tolerance[J].TrendsPlantSci,2001,6(2):66-71.
[5]WANG Ruigang,CHEN Shaoliang,ZHOU Xiaoyang,etal.Ionic homeostasis and reactive oxygen species control in leaves and xylem sap of two poplars subjected to NaCl stress[J].TreePhysiol,2008,28(6):947-957.
[6]SUN Jian,CHEN Shaoliang,DAISongxiang,etal.NaCl-induced alternations of cellular and tissue ion fluxes in roots of salt-resistant and salt-sensitive poplar species[J].PlantPhysiol,2009,149(2):1141-1153.
[7]LAOHAVISIT A,RICHARDS S L,SHABALA L,etal.Salinity-induced calcium signaling and root adaptation in Arabidopsis require the calcium regulatory protein annexin1[J].PlantPhysiol,2013,163(1):253-262.
[8]SHABALA L,CUIN T A,NEWMAN IA,etal.Salinity-induced ion flux patterns from the excised roots ofArabidopsissosmutants[J].Planta,2005,222(6):1041-1050.
[9]SHIHuazhong,ISHITANIM,KIM CS,etal.The Arabidopsis thaliana salt tolerance geneSOS1 encodes a putative Na+/H+antiporter[J].ProcNatlAcadSciUSA,2000,97(12):6896-6901.
[10]SHABALA S.Non-invasive microelectrode ion flux measurements in plant stress physiology[G].//VOLKOV A G.PlantElectrophysiology:TheoryandMethods.Berlin:Springer-Verlag,2006,35-71.
[11]PARDO J,CUBERO B,LEIDIE,etal.Alkali cation exchangers:roles in cellular homeostasis and stress tolerance[J].JExpBot,2006,57(5):1181-1199.
[12]SHIHuazhong,LEE B H,WU S J,etal.Overexpression of a plasmamembrane Na+/H+antiporter gene improves salt tolerance inArabidopsisthaliana[J].NatBiotechnol,2003,21(1):81-85.
[13]MA Dongmei,XUWeirong,LIHuiwen,etal.Co-expression of theArabidopsisSOS genes enhances salt tolerance in transgenic tall fescue(FestucaarundinaceaSchreb.)[J].Protoplasma,2014,251(1):219-231.
[14]SHABALA S.Ionic and osmotic components of salt stress specificallymodulate net ion fluxes from bean leafmesophyll[J].PlantCellEnviron,2000,23(8):825-837.
[15]BOSE J,XIE Yanjie,SHENWenbiao,etal.Haem oxygenase modifies salinity tolerance inArabidopsisby controlling K+retention via regulation of the plasmamembrane H+-ATPase and by altering SOS1 transcript levels in roots[J].JExpBot,2013,64(2):471-481.
[16]YOKOIS,QUINTERO F J,CUBERO B,etal.Differential expression and function ofArabidopsisthalianaNHX Na+/H+antiporters in the salt stress response[J].PlantJ,2002,30(5):529-539.
[17]CUIN T A,BOSE J,STEFANO G,etal.Assessing the role of root plasmamembrane and tonoplast Na+/H+exchangers in salinity tolerance in wheat:in planta quantification methods[J].PlantCellEnviron,2011,34(6):947-961.
[18]APASEM P,BLUMWALD E.Engineering salt tolerance in plants[J].CurrOpinBiotechnol,2002,13(2):146 -150.
[19]OHTA M,HAYASHIY,NAKASHIMA A,etal.Introduction of a Na+/H+antiporter gene fromAtriplexgmeliniconfers salt tolerance to rice[J].FEBSLett,2002,532(3):279-282.
[20]GUOA K M,BABOURINAA O,RENGELA Z.Na+/H+antiporter activity of theSOS1 gene:lifetime imaging analysis and electrophysiological studies onArabidopsisseedlings[J].PhysiolPlantarum,2009,137(2):155-165.
[21]SHABALA S,NEWMAN I.Salinity effects on the activity of plasmamembrane H+and Ca2+transporters in bean leaf mesophyll:masking role of the cellwall[J].AnnBot,2000,85(5):681-686.
[22]CUIN TA,SHABALA S.Exogenously supplied compatible solutes rapidly ameliorate NaCl-induced potassium efflux from barley roots[J].PlantCellPhysiol,2005,46(12):1924-1933.
[23]SHABALA S,DEMIDCHIK V,SHABALA L,etal.Extracellular Ca2+ameliorates NaCl-induced K+loss fromArabidopsisroot and leaf cells by controlling plasmamembrane K+-permeable channels[J].PlantPhysiol,2006,141(4):1653-1665.
[24]CUIN T A,SHABALA S.Amino acids regulate salinity-induced potassium efflux in barley root epidermis[J].Planta,2007,225(3):753-761.
[25]VERA-ESTRELLA R,BARKLA B J,BOHNERTH J,et al.Salt stress inMesembryanthemumcrystallinumL.cell suspensions activates adaptivemechanisms similar to those observed in the whole plant[J].Planta,1999,207(3):426-435.
[26]BEILBYM J,SHEPHERD V A.Modeling the current-voltage characteristics of charophytemembranes(Ⅱ)The effect of salinity onmembranes ofLamprothamniumpapulosum[J].JMembraneBiol,2001,181(2):77-89.
[27]CHEN Zhonghua,POTTOSIN I I,CUIN T A,etal.Root plasmamembrane transporters controlling K+/Na+homeostasis in salt stressed barley[J].PlantPhysiol,2007,145(4):1714-1725.
[28]SHABALA L,BOWMAN J,BROWN J,etal.Ion transport and osmotic adjustment inEscherichiacoliin response to ionic and non-ionic osmotic[J].EnvironMicrobiol,2009,11(1):137-148.
[29]PANDOLFIC,POTTOSIN I,CUIN T,etal.Specificity of polyamine effects on NaCl-induced ion flux kinetics and salt stress amelioration in plants[J].PlantCellPhysiol,2010,51(3):422-434.
[30]SHABALA S,CUIN T A,POTTOSIN II.Polyamines prevent NaCl-induced K+efflux from peamesophyll by blocking nonselective cation channels[J].FEBSLett,2007,581(10):1993-1999.
[31]JAYAKANNAN M,BOSE J,BABOURINA O,etal.Salicylic acid improves salinity tolerance inArabidopsisby restoringmembrane potentialand preventingsalt-induced K+loss via a GORK channel[J].JExpBot,2013,64(8):2255-2268.
[32]LISJAK M,SRIVASTAVA N,TEKLIC T,etal.A novel hydrogen sulfide donor causes stomatal opening and reduces nitric oxide accumulation[J].PlantPhysiolBiochem,2010,48(12),931-935.
[33]CHEN Juan,WU Feihua,WANG Wenhua,etal.Hydrogen sulphide enhances photosynthesis through promoting chloroplast biogenesis,photosynthetic enzyme expression,and thiol redox modification inSpinaciaoleracea seedlings[J].JExpBot,2011,62(13):4481-4493.
[34]ZHANG Hua,HU Shuli,ZHANG Zejun,etal.Hydrogen sulfide acts as a regulator of flower senescence in plants[J].PostharvestBiolTec,2011,60(3):251-257.
[35]朱会朋,孙健,赵楠,等.盐胁迫下硫化氢调控杨树根系的离子流[J].植物生理学报,2013,49(6):561-567. ZHU Huipeng,SUN Jian,ZHAO Nan,etal.Hydrogen sulfidemediates ion fluxes in root of poplars under NaCl stress[J].PlantPhysiolJ,2013,49(6):561-567.
[36]TYERMAN SD,SKERRETT IM.Root ion channels and salinity[J].SciHortic,1999,78(1/4):175-235.
[37]MAATHIUSF JM,AMTMANN A.K+nutrition and Na+toxicity:the basis of cellular K+/Na+ratio[J].AnnBot,1999,84(2):123-133.
[38]TESTER M,DAVENPORT R.Na+tolerance and Na+transport in higher plants[J].AnnBot,2003,91(5):503 -527.
[39]CHEN Zhonghua,ZHOU Meixue,NEWMAN IA,etal.Potassium and sodium relations in salinised barley tissues as a basisof differential salt tolerance[J].FunctPlantBiol,2007,34(2):150-162.
[40]SHABALA S,CUIN T A.Potassium transport and plant salt tolerance[J].PhysiolPlantarum,2008,133(4):651 -669.
[41]SHABALA S,CUIN T A,PRISMALL L,etal.Expression of animal CED-9 anti-apoptotic gene in tobaccomodifies plasmamembrane ion fluxes in response to salinity and oxidative stress[J].Planta,2007,227(1):189-197.
[42]ZHU Jiankang.Regulation of ion homeostasis under salt stress[J].CurrOpinPlantBiol,2003,6(5):441-445.
[43]CARDEN D E,WALKER D J,FLOWERS T J,etal.Single-cellmeasurements of the contributions of cytosolic Na+and K+to salt tolerance[J].PlantPhysiol,2003,131(2):676-683.
[44]AMTMANN A,SANDERSD.Mechanisms of Na+uptake by plant cells[J].AdvBotRes,1999,29:76-112.
[45]WHITE P J,DAVENPORT R J.The voltage-independent cation channel in the plasmamembrane of wheat roots is permeable to divalent cations and may be involved in cytosolic Ca2+homeostasis[J].PlantPhysiol,2002,130(3):1386-1395.
[46]TYERMAN SD,SKERRETT M,GARRILL A,etal.Pathway for the permeation of Na+and Cl-into protoplasts derived from the cortex ofwheat roots[J].JExpBot,1997,48(spec):459-480.
[47]MURATA Y,FUJITA M,NAKATANIT,etal.Effect of Na+on Ca2+-binding on the plasmamembrane of barley mesophyll cells:an electrophoretic study[J].PlantCellPhysiol,1998,39(4):452-457.
[48]KINRAIDE T B.Interactions among Ca2+,Na+,and K+in salinity toxicity:quantitative resolution ofmultiple toxic and ameliorative effects[J].JExpBot,1999,50(338):1495-1505.
[49]LIU Jiping,ZHU Jiankang.A calcium sensor homolog required for plant salt tolerance[J].Science,1998,280(5371):1943-1945.
[50]PARDO JM,REDDY M P,YANG Shuli,etal.Stress signaling through Ca2+/calmodulin-dependent protein phosphatase calcineurin mediates salt adaptation in plants[J].ProcNatlAcadSciUSA,1998,95(16):9681-9686.
[51]LYNCH J,POLITO V S,LÄUCHLIA.Salinity stress increases cytoplasmic Ca2+activity in maize root protoplasts[J].PlantPhysiol,1989,90(4):1271-1274.
[52]GAO Dongjie,KNIGHT M R,TREWAVASA J,etal.Self-reportingArabidopsisexpressing pH and[Ca2+]indicators unveil ion dynamics in the cytoplasm and in the apoplast under abiotic stress[J].PlantPhysiol,2004,134(3):898-908.
[53]LAOHAVISIT A,SHANG Z,RUBIO L,etal.Arabidopsis annexin1 mediates the radical-activated plasma membrane Ca2+-and K+-permeable conductance in root cells[J].PlantCell,2012,24(4):1522-1533.
[54]SUN Jian,WANGMeijuan,DING Mingquan,etal.H2O2and cytosolic Ca2+signals triggered by the PM H+-coupled transport system mediate K+/Na+homeostasis in NaCl-stressedPopuluseuphraticacells[J].PlantCellEnviron,2010,33(6):943-958.
[55]DEMIDCHIK V,SHANG Z,SHIN R,etal.Receptor-like activity evoked by extracellular ADP inArabidopsisroot epidermal plasmamembrane[J].PlantPhysiol,2011,156(3):1375-1385.
[56]SUN Jian,CHEN Shaoliang,DAISongxiang,etal.Ion flux profiles and plant ion homeostasis control under salt stress[J].PlantSignalBehav,2009,4(4):261-264.
[57]LORENZEN I,ABERLE T,PLIETH C.Salt stress-induced chloride flux:a study using transgenicArabidopsisexpressing a fluorescent anion probe[J].PlantJ,2004,38(3):539-544.
[58]CHEN Shaoliang,LIJinke,FRITZ E,etal.Sodium and chloride distribution in roots and transport in three poplar genotypes under increasing NaCl stress[J].ForestEcolManag,2002,168(1/3):217-230.
[59]CHEN Shaoliang,LIJinke,WANG Shasheng,etal.Effects of NaCl on shoot growth,transpiration,ion compartmentation,and transport in regenerated plants ofPopuluseuphraticaandPopulustomentosa[J].CanJForRes,2003,33(6):967-975.
[60]SHABALA S,LEW R R.Turgor regulation in osmotically stressedArabidopsisepidermal root cells:direct support for the role of inorganic ion uptake as revealed by concurrent flux and cell turgormeasurements[J].PlantPhysiol,2002,129(1):290-299.
Advances in plant cell ion flux with salt stress:a review
ZUO Zhaojiang,ZHANGRumin,GAO Yan
(School of Forestry and Biotechnology,Zhejiang A&FUniversity,Lin'an 311300,Zhejiang,China)
Soil salinization,one of the severest environmental problems,results in accumulation of salt ions in cells that poisons plants.With NaCl stress,Na+enters into the cell via non-selective cation channels leading to plasmamembrane depolarization.This activates the outward K+channel draining K+.In salt-tolerant plants,K+efflux is inhibited,so cellsmaintain a higher K+/Na+to reduce salt stress damage.In plasma membranes,H+-ATPase transports H+out the cell,so that the H+can form a proton inducing force to drive the Na+efflux via an Na+/H+antiporter.With salt stress,Ca2+flows into the cell playing an important role in the regulation of Na+and K+flux.At the same time,Cl-outflow from the cellwith salt stressmay couple with Na+efflux.To aid in helping the further study of ion flux,the flux of these ions and their regulationmechanism with salt stress are summarized in this paper.[Ch,2 fig.60 ref.]
botany;ion flux;salt stress;review;salt overly sensitive signal-transduction pathway;K+/Na+homeostasis
S718.43;Q948.113
A
2095-0756(2014)05-0805-07
2013-11-02;
2014-02-19
国家自然科学青年基金资助项目(31300364);国家自然科学基金资助项目(31270756)
左照江,讲师,博士,从事植物逆境生理、植物化学生态等研究,E-mail:zuozhaojiang@126.com
