迷走神经反射对心房颤动消融效果的预测作用
2014-04-27聂绍平曾亚平
艾 辉,孟 旭,聂绍平,李 岩,曾 文,曾亚平*
(首都医科大学附属北京安贞医院:1急诊综合病房,2心外科九病房,3心内科,北京 100029)
心房颤动(atrial fibrillation,AF)是最常见的心律失常,AF的治疗进展有赖于AF发生机制的研究。AF的神经学说,尤其是迷走神经学说,成为研究的热点。迷走神经通过延长动作电位和增加复极化离散度参与AF的触发和维持[1,2]。因此,对于迷走反射(vagal reflex)阳性的AF患者,尽可能完全地去神经化可以减少AF的复发。本研究通过对209例持续性或慢性AF合并其他心脏病患者的迷走神经的术中标测和长期随访,观察迷走反射阳性患者附加去神经化的治疗及可能的机制,以及消融效果是否优于迷走反射阴性者;迷走反射与左房大小的关系;心脏迷走神经节的分布特征,及以上研究的临床意义。
1 对象与方法
1.1 对象
对209例AF患者进行射频消融,其中男性63例,女性146例;年龄24~77(53±10)岁。术中标测103例为迷走反射阳性,106例为迷走反射阴性。术前纽约心脏联合会(New York Heart Association,NYHA)心功能分级Ⅲ级或Ⅳ级的患者144例。AF病史55~61(36±43)个月,超声心动图示左心房(left atrium,LA)29~167(67±17)mm,左室舒张末径(left ventricular end-diastolic dimension,LVEDD)34~85(51±9)mm,左室射血分数(LVEF)27%~80%(59%±8%),瓣膜手术174例。随访6~34(18.9±9.0)个月。
1.2 射频消融方法
所有患者均在全身麻醉、中度低温、体外循环下进行手术。常规正中切口,采用上下腔静脉及主动脉插管建立体外循环的方法。迷走反射阳性组和迷走反射阴性组二尖瓣置换术分别为90例(87.4%)和89例(84%,P=0.480);二尖瓣成型术分别为7例(6.8%)和12例(11.3%,P=0.255);主动脉瓣置换术分别为26例(24.5%)和29例(28.2%,P=0.552);二尖瓣+主动脉瓣置换术分别为2例(1.0%)例和0例(0.0%,P=0.900);搭桥术分别为14例(6.3%)和9例(4.3%,P=0.670);房缺修补术分别为6例(2.7%)和2例(0.9%,P=0.420)。
全麻下先行双极射频消融术,再做瓣膜或其他心脏病手术。射频消融采用美国Atricure公司提供的(AtriCure TM;Ohio,USA)双极射频消融钳,主机(Isolator,Atricure Inc),功率为25~30J。射频消融径线采用改良的modified Cox mini-maze。消融径线包括双侧环肺静脉连线,左、右上肺静脉之间连线,左下肺静脉−二尖瓣后瓣环连线,左房后壁放射状消融线,右房切口,即上下腔静脉之间连线,右房切口−冠状静脉窦间连线,冠状静脉窦−三尖瓣后瓣环连线,切断Marshall韧带,左心耳外部结扎或内侧缝合。消融终点:肺静脉电隔离双向阻滞;迷走反射阳性转阴性。术后常规放置心表临时起搏导线。
1.3 术中标测
心脏直视手术,除二次手术,术前超声证实有左房血栓,及左房巨大、标测视野暴露困难外,所有患者术前及心脏复跳后均进行肺静脉隔离的双向检测和神经节的标测。
1.3.1 肺静脉隔离(pulmonary vein isolation,PUI)双向检测 “感知”阳性定义:肺静脉前庭隔离前在肺静脉前庭可记录到快速而紊乱的心房电位,PVI后在肺静脉前庭相同位置快速的心房电位消失,此为“传入阻滞”。“起搏”阳性定义为心房夺获,PVI后起搏阴性定义为在相同位置不出现心房夺获,此为“传出阻滞”。
1.3.2 高频刺激标测神经节 使用Atricure公司提供的oscor刺激仪,刺激输出电压18mV,刺激频率1000次/min,依据图1神经节的分布位置逐个刺激。阳性定义:RR间期延长≥2倍,同时血压进行性下降,若出现阳性,待血压和心率恢复后再测定下一位点,同一位点的重复刺激需在2min后进行,以排除递质耗竭的影响。
1.4 术后处理
术后即日静点胺碘酮,前6h用量为1mg/min,以后0.5mg/min维持3d,术后第1天同时开始口服胺碘酮,200~600mg/d,至少6个月(《2008年胺碘酮抗心律失常治疗应用指南》)[3]。如果出现稳定的窦性心律,停用胺碘酮。出院前及随访期间AF复发≥12h者给予直流电复率。住院期间每天行12导联心电图检查。术后1个月、3个月、6个月、1年回门诊复查,复查项目包括12导联心电图检查和超声心动图。复查有症状,提示有心率失常发生,则行心电图或24h Holter检查,将结果邮寄或传真给独立的内科医师。机械瓣置换术后常规华法林抗凝治疗,生物瓣置换术后华法林抗凝3个月,维持国际标准化比值2.0~2.5。
1.5 统计学处理
应用SPSS12.0统计学软件对数据进行分析,计量资料以±s 表示,计数资料以率表示。组间比较采用t检验和Pearson卡方检验。风险因素分析采用cox单因素和多因素回归分析。变量之间的非线性相关性采用logistic回归分析。随访资料分析采用Kaplan-Meier法。P<0.05为差异有统计学意义。
2 结果
2.1 临床资料比较
两组患者除大LA者所占比例有差异外(P=0.008),年龄、性别、术前心功能、AF病史,LVEDD、LVEF、主动脉阻断时间等,差异均无统计学意义(表1)。

表1 迷走反射阳性组和迷走反射阴性组的术前资料Table1 Preoperative data of positive vagal reflex group and negative vagal reflex group
2.2 死亡率及术后并发症
全组住院期间无死亡病例。迷走反射阳性组和迷走反射阴性组发生切口感染分别为12例(11.6%)和8例(7.5%,P=0.23);肾衰竭分别为2例(1.9%)和4例(3.8%,P=0.21);呼吸衰竭分别为0例(0.0%)和1例(0.9%,P=0.27);插管分别为3例(2.9%)和3例(2.8%,P=0.97);主动脉内球囊反搏分别为3例(2.9%)和3例(2.8%,P=0.97);体外膜肺氧合使用分别率3例(2.9%)和7例(6.6%,P=0.21);开胸止血分别为7例(6.8%)和5例(4.7%,P=0.52);起搏器植入分别为0例(0.0%)和3例(2.8%,P=0.08)。
2.3 自主神经节标测结果
术中标测结果,迷走反射阳性103例(103/209,49.2%)。阳性点均位于右肺静脉者52例(50.5%),均位于左肺静脉者8例(7.8%),两侧均分布有阳性神经节者占43例(41.7%)。阳性点的总数为327个,每例平均1~11(3.6±2.2)个,其中右肺静脉232个(70.9%),左肺静脉95个(29.1%),右侧肺静脉前庭心房侧190个(190/232,81.9%),左侧肺静脉前庭心房侧67个(67/95,70.5%)。双侧肺静脉前庭侧257个(78.6%)。具体每个位点的分布如图1所示。
2.4 术后及随访心律
最近一次随访为术后6~34(18.9±9.0)个月,共有15例失访,其中迷走反射阳性组5例,迷走反射阴性组10例。迷走反射阳性组和迷走反射阴性组的非AF心律分别为67例(67/98,68.4%)和51例(51/96,53.1%;χ2=12.45,P=0.0004)。迷走反射阳性组98例患者的心律分别为窦性心律62例(63.3%),起搏心律1例(1.0%),AF心律31例(31.6%),阵发性室上性心动过速1例(1.0%),房性心动过速1例(1.0%),心房扑动(atrial flutter,AFL)2例(2.0%)。迷走反射阴性组96例患者的心律分别为窦性心律49例(51.0%)SR,AF心律45例(46.9%),起搏心律2例(2.1%),AFL4例(4.2%)。随访心律如图2所示。

图1 迷走反射阳性组和迷走反射阴性组阳性迷走神经位点的分布Figure1 The positive vagus nerve distribution sites in positive vagal reflex group and negative vagal reflex group
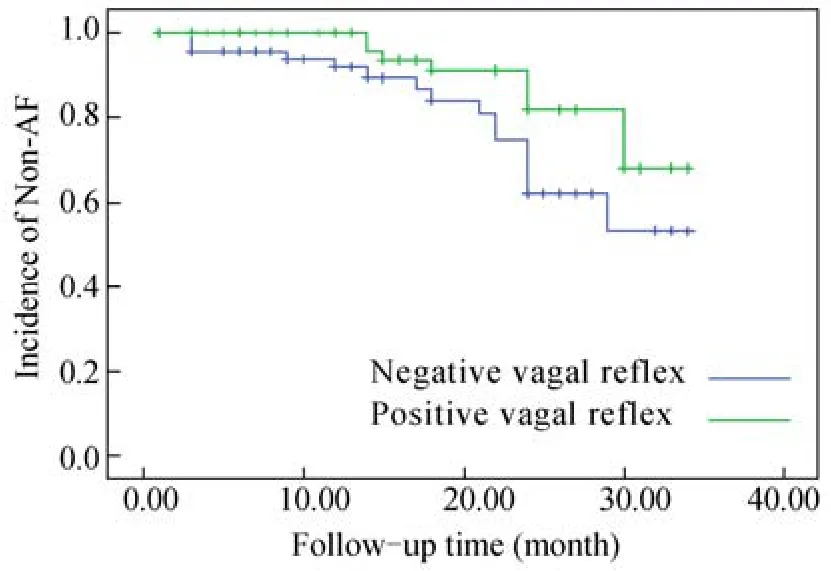
图2 迷走反射阳性组和迷走反射阴性组的射频消融术后的Kaplan-Meier曲线Figure2 Kaplan-Meier curves of positive vagal response group and negative vagal reflex group after ablation techniques
2.5 AF复发的预测因子
Cox单因素和多因素回归模型分析表明,LA大小和迷走反射是影响AF复发的两个预测因子,LA的标测结果是AF随访强的预测因子[Wald=7.78,P=0.005,95%CI:1.009~1.053]。迷走反射阳性组的复发率显著小于阴性组(Wald=9.71,P=0.002,95% CI:0.081~0.563)。LA大小和迷走反射有交互作用(Wald=4.45,P=0.035,95%CI:0.965~0.999),迷走反射阴性组中LA径线>70mm的比例大于迷走反射阳性组(48.1%vs30.1%,P=0.008)。对LA大小分层分析结果显示,不同LA层内,迷走反射阳性组AF复发率均显著低于阴性组;随LA增大,两组的复发率均增加;迷走反射的预测价值随着LA增大有增高的趋势(表2)。

表2 对迷走反射阳性组和迷走反射阴性组的消融效果的分层分析Table2 Stratification analysis of the ablation effect in positive vagal reflex and negative vagal reflex groups(n)
3 讨论
AF是最常见的心律失常,在中国有大约100万AF患者。>50%的二尖瓣狭窄患者或其他器质性心脏疾病患者常合并AF[4]。消融策略的改良有赖于对AF机制的认识和发展。目前,占主导地位的学说是“局灶驱动伴颤动样传导”[5]。近年来,越来越多的研究表明心脏自主神经节在AF的触发和维持中起重要作用,而且认为自主神经节与肺静脉相互作用,降低AF诱发阈值,肺静脉的触发最初也是源于肺静脉周围迷走神经张力的改变[6,7]。根据以上临床研究,我们认为迷走神经节可能参与AF的发生和维持。对于迷走反射阳性的AF患者,应该尽可能完全地去神经化以减少AF的复发。但是对于迷走反射阴性的AF,效果如何?很多研究认为有迷走反射并且去神经化的AF随访效果明显好于迷走反射阴性的AF[7,8]。但迷走神经节阳性患者的消融效果为何优于阴性者?左房大小是AF治疗效果独立的预测因子,迷走神经节阳性与左房大小有何关系?目前还不完全清楚。本研究通过对209例AF患者临床资料的详细分析,得出以下结论:迷走反射阳性并且完全去神经化的AF患者,其随访效果明显好于迷走反射阴性患者,这与其他研究结果一致;迷走反射是影响AF治疗效果的又一独立的预测因子;迷走反射与LA大小是相互关联的,迷走反射阳性组大LA所占比例明显小于迷走反射阴性。这些结论可能有利于进一步阐述迷走神经节在AF中的作用。其内在的关联可能与神经重构有关,迷走反射是AF病程进展和心房重构的又一指标。
迷走反射可以作为AF病程进展和心房重构的一个指标。很多研究表明AF射频消融术中出现迷走反射,并去神经化的患者远期复发明显减少[9,10]。这与本研究的结果是一致的。通过cox单因素和多因素回归分析发现LA和迷走反射是AF复发的两个预测因子,logistic回归分析表明LA和迷走反射具有相关性,迷走神经节阳性组LA>70mm的比例明显小于迷走神经节阴性组(30.1%vs48.1%,P=0.008)。神经重构理论是可能的机制:(1)迷走神经系统在AF时张力发生改变,可能参与所有AF的发生,只是迷走反射阳性的兴奋性更强;(2)由于神经节确认方法和技术均有局限,高频刺激不能完全反映神经节的位置和功能特征,但却是目前检测神经节的唯一方法[10];(3)只有当迷走神经末梢释放的神经递质——乙酰胆碱与相应的受体相互作用,才能出现迷走反射;(4)随着AF病程的进展,心房组织在发生结构和电生理重构的同时,也出现了神经的重构;(5)心脏迷走神经的重构体现在,随着AF的进展,乙酰胆碱受体的绝对数量发生适应性下调,作为对迷走神经兴奋性增强的代偿性调节[11];(6)随着LA的增大,心房组织乙酰胆碱受体的相对分布密度也减小,迷走神经反射也相应减弱。迷走反射强弱的衰减代表AF病程的进展和心房重构的程度。迷走反射是AF消融效果的独立预测因子。
本研究发现左右肺静脉前庭侧均分布有阳性神经节者占41.7%,单纯右侧分布者50.5%,仅在左侧分布者仅占7.8%。其中以R1,R3,R5,即右上肺静脉附近最多。这与其他研究结果一致[12,13]。其临床意义:PVI应远离肺静脉口部,尽可能靠近前庭左房侧。结合近年来的研究原因总结如下:(1)肺静脉前庭隔离可以隔离肺静脉异位触发灶;(2)肺静脉与左房之间具有形成折返的结构和电生理基础(后者是AF维持的重要驱动);肺静脉前庭隔离能同时打断肺静脉前庭的微折返[14];(3)肺静脉前庭隔离还包括25%~30%的左房后壁,而后者在AF的维持中起重要作用[15];(4)肺静脉前庭隔离与肺静脉口部消融相比,肺静脉狭窄的概率大大减少[16];(5)本研究肺静脉前庭左房侧自主神经节的分布占78.6%,多于肺静脉口部。肺静脉前庭隔离靠近肺静脉前庭左房侧,能最大程度地去神经化,提高AF治疗效果。
【参考文献】
[1]Pappone C, Santinelli V, Manguso F,et al.Pulmonary vein denervation enhances long-term benefit after circumferential ablation for paroxysmal atrial fibrillation[J].Circulation, 2004, 109(3): 327−334.
[2]Gillinov AM, Saltman AE.Ablation of atrial fibrillation with concomitant cardiac surgery[J].Semin Thorac Cardiovasc Surg, 2007, 19(1): 25−32.
[3]Chinese Heart Rhythm Society of Chinese Biomedical Engineering Association, Chinese Society of Cardiology of Chinese Medical Aociation, and Amiodarone Application in the Anti- Arrhythmia Guide Working Group.Amiodarone Application in the Anti Arrhythmia Guide[J].Chin J Card Pacing Electrophysiol, 2008, 22(5):377−385.[中国生物医学工程学会心律分会, 中华医学会心血管病学分会, 胺碘酮抗心律失常治疗应用指南工作组.胺碘酮抗心律失常治疗应用指南(2008)[J].中国心脏起博与心电生理杂志, 2008, 22(5): 377−385.]
[4]Nitta T, Ishii Y, Miyagi Y,et al.Concurrent multiple left atrial focal activations with fibrillatory conduction and right atrial focal or reentrant activation as the mechanism in atrial fibrillation[J].J Thorac Cardiovasc Surg, 2004,127(3): 770−778.
[5]Lemola K, Chartier D, Yeh YH,et al.Pulmonary vein region ablation in experimental vagal atrial fibrillation:role of pulmonary veinsversusautonomic ganglia[J].Circulation, 2008, 117(4): 470−477.
[6]Scherlag BJ, Nakagawa H, Jackman WM,et al.Electrical stimulation to identify neural elements on the heart: their role in atrial fibrillation[J].J Interv Card Electrophysiol,2005, 13(Suppl 1): 37−42.
[7]Nakagawa JA, Scherlag BJ, Wu R,et al.Addition of selective ablation of autonomic ganglia to pulmonary vein antrum isolation for treatment of paroxysmal and persistent atrial fibrillation[J].Circulation, 2004,110(Suppl 3): 543.
[8]Scanavacca M, Pisani CF, Hachul D,et al.Selective atrial vagal denervation guided by evoked vagal reflex to treat patients with paroxysmal atrial fibrillation[J].Circulation,2006, 114(9): 876−885.
[9]Cui YQ, Sun LB, Li Y,et al.Intraoperative modified Cox mini-maze procedure for long-standing persistent atrial fibrillation[J].Ann Thorac Surg, 2008, 85(4): 1283−1289.
[10]Sarmast F, Kolli A, Zaitsev A,et al.Cholinergic atrial fibrillation: I(K,ACh) gradients determine unequal left/right atrial frequencies and rotor dynamics[J].Cardiovasc Res, 2003, 59(4): 863−873.
[11]Mehall JR, Kohut RM Jr, Schneeberger EW,et al.Intraoperative epicardial electrophysiologic mapping and isolation of autonomic ganglionic plexi[J].Ann Thorac Surg, 2007, 83(2): 538−541.
[12]Onorati F, Curcio A, Santarpino G,et al.Routine ganglionic plexi ablation during Maze procedure improves hospital and early follow-up results of mitral surgery[J].J Thorac Cardiovasc Surg, 2008, 136(2):408–418.
[13]Cui YQ, Li Y, Gao F,et al.Video-assisted minimally invasive surgery for lone atrial fibrillation: a clinical report of 81 cases[J].J Thorac Cardiovasc Surg, 2010,139(2): 326 −332.
[14]Dong JZ, Liu XP.Maintenance mechanism of atrial fibrillation—“a pulmonary vein-left atrium reentry”hypothesis[J].Adv Cardiovasc Dis, 2006, 27(1): 9−12.[董健增, 刘兴鹏.心房颤动维持机制的新观点: “肺静脉-左心房折返”假说[J].心血管病学进展, 2006, 27(1):9−12.]
[15]Todd DM, Skanes AC, Guiraudon G,et al.Role of the posterior left atrium and pulmonary veins in human lone atrial fibrillation: electrophysiological and pathological data from patients undergoing atrial fibrillation surgery[J].Circulation, 2003, 108(25): 3108−3114.
[16]Roux JF, Gojraty S, Bala R,et al.Effect of pulmonary vein isolation on the distribution of complex fractionated electrograms in humans[J].Heart Rhythm, 2009, 6(2):156−160.
