姜黄素毒性作用研究
2014-04-26卢婉怡
卢婉怡
(广东省食品药品职业技术学校 制药系,广东 广州 510520)
姜黄素毒性作用研究
卢婉怡
(广东省食品药品职业技术学校 制药系,广东 广州 510520)
目的:研究姜黄素对奥尼罗非鱼(Mossabica tilapia)的毒性作用。方法:在无法获得LD-50和蓄积系数的情况下,以小鼠NOEL剂量(320mg/kg bw)的20倍进行灌喂,做一次性最大耐受试验,测定奥尼罗非鱼对姜黄素的最大耐受量。采集血清和肝胰脏用于测定抗氧化能力(T-AOC)、过氧化物歧化酶(SOD)活性及过氧化氢酶(CAT)活性。结果:在口服的条件下,高剂量姜黄素不会引起鱼体死亡。一次性口服小鼠NOEL剂量(320mg/kg bw)20倍的姜黄素,能短时间增强奥尼罗非鱼血清中SOD活性和前期CAT活性,但也显著抑制其T-AOC和后期CAT活性,且在96h内不能恢复到正常水平。结论:一次性口服小鼠NOEL剂量(320mg/kg bw)20倍的姜黄素,对奥尼罗非鱼具有一定的毒性,但是毒性极低。
姜黄素;毒性;生物学功能
1 姜黄素生物学功能及毒理性质
1.1 姜黄素生物学功能
姜黄素(Curcumin)是从中草药姜黄中提取的一类多效的天然活性物质,其特殊的化学结构决定其重要的经济价值,可作色素、香料、染料、化妆品等;它具有特殊的生理功能,具有抗炎、抗氧化、清除氧自由基、抗过氧化脂质损伤、抗衰老、抗纤维化、保护肝脏和肾脏、防癌抗癌、降血脂、抗动脉粥样硬化等作用,同时还可增加胆汁的分泌和生成、增强胆囊收缩、提高网状系统吞噬力、增强免疫功能和改善生物体消化系统的功能。目前姜黄已被世界卫生组织(WHO)/食品药品管理局(FAD)批准为天然食品添加剂[1]。
1.2 姜黄素毒理性质
大鼠和猴分别口服单剂量姜黄素1 800mg/kg及口服多剂量姜黄素800mg/(kg·d)6个月,未产生任何毒性;另有报道大鼠口服高剂量(直至5g/kg)未引起毒性[2]。沃兴德等[3]以人口服剂量的600倍对小鼠作1次性最大耐受量,各项指标均正常,未见1只动物死亡;试验在确定姜黄素无急性毒性作用的前提下,又进行了姜黄素的长期毒性试验,发现姜黄素高剂量组(500mg/(kg·d))、低剂量组(100mg/(kg·d))各项指标与正常对照组相比均无显著差异,说明姜黄素在上述剂量下连续服用80天是安全的[4]。
2 材料与方法
2.1 试验材料
实验动物选用体长20cm左右和体重为(150±15)g的同一批奥尼罗非鱼,鱼体健康,无体表损伤。试验鱼驯养7~14天,观察鱼体的情况,驯养开始48h后开始记录死亡数,死亡数小于5%方可进行实验;试验前禁食24h。以下各项试验均采用上述试验材料。姜黄素购于Hangzhou Greensky Biological Tech Co. Ltd.,产品编号:GS060722。
2.2 试验时间、条件及受试物制备
2.2.1 试验时间和条件 养殖用水使用前曝气除氯3天,罗非鱼的驯养及毒性试验在水循环系统中进行,24h充气使水体COD保持在5mg/L左右。驯养及试验期间投喂的饲料为相应规格的罗非鱼商品颗粒料。
2.2.2 受试物制备 精确称取30g姜黄素,加入50mL蒸馏水中,搅拌溶解,得到浓度为0.375g/mL的姜黄素悬浮液80mL。
2.3 实验方法
2.3.1 染毒方法 采用经口灌喂方法:用长约15cm 医用静点胶管,一端套在2mL注射器上,吸取姜黄素悬浮液,将胶管由口腔轻插入鱼胃中,并按不同剂量组及按鱼体的大小推入相应体积的姜黄素悬浮液。
2.3.2 预试验 采用小鼠NOEL(320mg/kg bw)的1、3、5、7、10倍五个浓度梯度组进行灌喂,每组放入3条试验鱼,不设平行组,试验持续96h,每日2次,记录各容器的死亡数。
2.4 最大耐受量试验(Ⅰ)
2.4.1 试验分组 设立试验组和对照组,每组2个平行,每个平行10尾鱼。
2.4.2 试验限期 试验持续7天。
2.4.3 染毒剂量及途径 以小鼠NOEL剂量(320mg/kg bw)的20倍进行灌喂,做一次性最大耐受试验。
2.4.4 试验管理 染毒后,前8h连续观察,并记录下鱼体的活动情况和死亡情况;之后,分别在24h、48h、72h和96h时进行观察,记录同类型的数据。染毒后第4天开始,每天下午投喂少量饲料。
2.4.5 试验样品处理 试验期间,死鱼应及时捞出,并进行解剖,观察内脏的中毒症状。鱼体死亡的判定标准:鱼体呼吸及鳍摆动停止,侧卧于缸底或腹部体侧朝上漂浮于水面,用小镊子夹住鱼的尾柄,5min内不出现任何反应可判定为死亡。
2.5 最大耐受量试验(Ⅱ)
设立试验组和对照组,不设平行,每组30尾鱼。操作步骤、实验管理均按上述方法。
2.5.1 试验样品处理
分别在12h、24h、48h、72h和96h时,于试验组的未死亡的个体中随机取5尾鱼静脉抽血,部分凝血离心得到血清后置于零下20℃保存备用。试验开始时,在对照组中随机取5尾鱼作为初始样,静脉抽血并凝血离心得到血清后置于零下20℃保存备用。
3 结果
3.1 预试验结果
预试验各组均未出现死亡个体,且鱼体均无明显中毒或异常症状出现;采样解剖观察,未见鱼体脏器出现中毒症状。
3.2 最大耐受量试验鱼体死亡情况
试验Ⅰ和Ⅱ期间,对照组与试验组均无一尾鱼中毒死亡;试验Ⅱ中,在12h、24h、48h、72h和96h采样解剖观察时,未见鱼体脏器出现中毒症状。
3.3 姜黄素对鱼体肝胰脏及血清中T-AOC、CAT和SOD的毒性作用
3.3.1 姜黄素对鱼体肝胰脏和血清中T-AOC的毒性作用
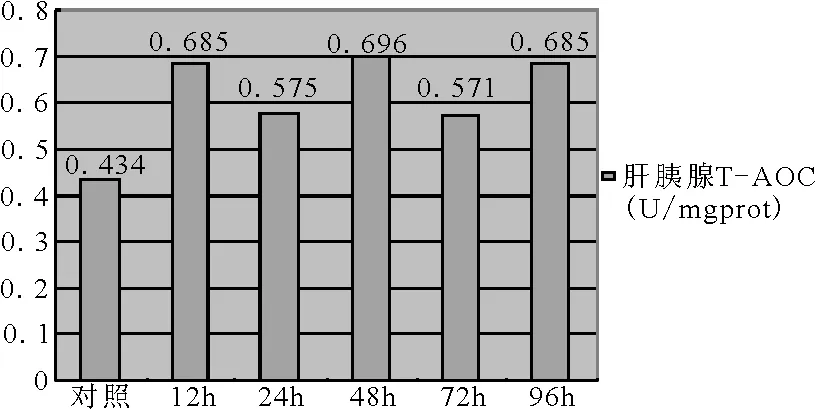
图1 鱼体肝胰腺总抗氧化能力(T-AOC)

图2 鱼体血清总抗氧化能力(T-AOC)
对照组和试验组12h、、24h、48h、72h和96h时间点的肝胰腺和血清的T-AOC数据经SAS8.0软件进行方差分析,并做了邓肯检验(以下的数据均按此分析)。经方差分析,肝胰腺T-AOC和血清组间比较均具有统计学意义(P均小于0.05)。由邓肯检验的结果来看,试验组各时间点的数据,除血清的12h组外,与对照组差异均显著。从图1、图2可以看出,肝胰脏的T-AOC对照组显著低于试验各组,而24h和72h两组的数据低于12h、48h和96h组且存在着显著的差异;血清的T-AOC对照组高于试验各组,达到最高值12.019;血清的T-AOC在前24h下降迅速,24h时已降至最低值6.131,而后缓慢回升到96h时的7.744。
3.3.2 姜黄素对鱼体肝胰脏和血清中SOD的毒性作用 经方差分析,得到肝胰腺SOD和血清组间比较差异均具有统计学意义(P均小于0.05)。由邓肯检验的结果来看,肝胰腺和血清的SOD活性在12h和72h时与对照组存在显著差异,且12h组均显著高于对照组,72h组显著低于对照组;从图3、图4可以看出,肝胰脏的SOD活性在初期迅速上升,在12h时便达到峰值29.23,随后缓慢下降,到72h时到达最低值21.319,96h时回升;血清中SOD的变化趋势总体与肝胰腺中的相似,稍有区别的是12h后下降迅速,到24h时达到另一个较低值90.456。

图3 鱼体肝胰腺过氧化物歧化酶(SOD)活性
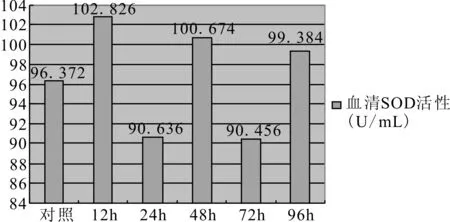
图4 鱼体血清过氧化物歧化酶(SOD)活性
3.3.3 姜黄素对鱼体肝胰脏和血清中CAT的毒性作用
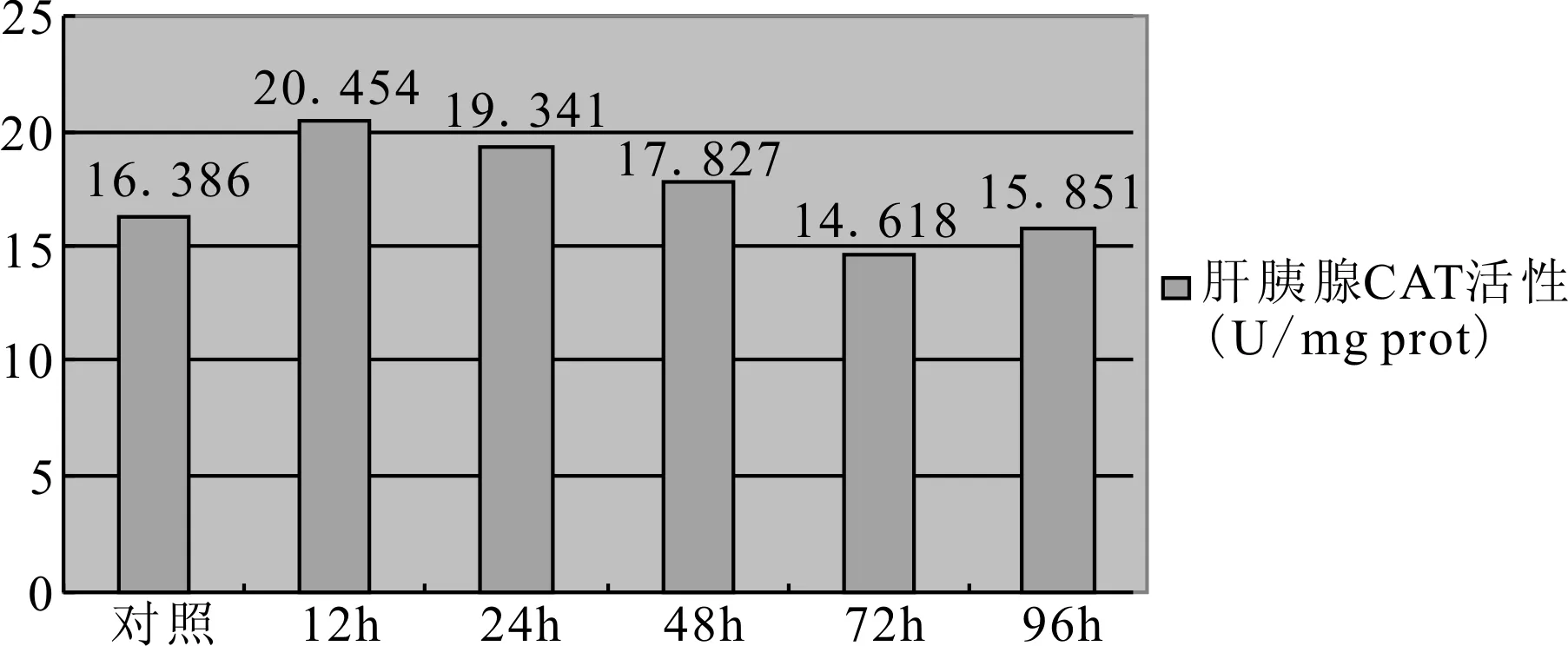
图5 鱼体肝胰腺过氧化氢酶(CAT)活性

图6 鱼体血清过氧化氢酶(CAT)活性
经方差分析,得到肝胰腺CAT和血清组间比较差异均具有统计学意义(P均小于0.05)。由邓肯检验的结果来看,肝胰腺的CAT活性在12h和24h时与对照组存在显著性差异,而血清中的CAT活性则在12h、72h及96h时与对照组存在显著性差异,且12h与72h、96h两组均存在显著差异;从图5、图6可以看出,肝胰脏的CAT活性在12h时便达到峰值20.454,随后缓慢下降,到72h时到达最低值14.618,96h时又有所回升,但在48h、72h及96h时与对照组均无显著差异;血清中CAT的变化趋势与肝胰腺中的相似,但是变化比较剧烈。血清中的CAT活性在初期急剧上升,到12h时便达到了峰值16.35,而后又迅速下降,48h和72h时恢复到与对照组相当水平,接着继续降低至72h时达最小值3.004,最后在96h时虽有所回升,但仍显著低于对照组。
4 分析
预试验中,各组均未出现死亡个体,说明姜黄素的毒性极低,同时也无法确定急性毒性试验的组距,因此本试验进行了姜黄素对奥尼罗非鱼经口的最大耐受量试验。
最大耐受量试验Ⅰ和Ⅱ期间,对照组与试验组均无中毒死亡。从剂量上来看,每尾染毒的鱼口服的剂量已达到6.4g/kg bw,而在急性毒性试验中,口服剂量大于5g/kg bw的药物,便不必再准确地测定其LD50,而其毒性评级为无毒[5]。
5 结论
一次性口服小鼠NOEL剂量(320mg/kg bw)20倍的姜黄素,不会对奥尼罗非鱼肝胰腺的T-AOC、SOD活性和CAT活性产生抑制作用或毒性作用,而是具有显著的增强作用,但持续时间不会超过96h。
一次性口服小鼠NOEL剂量(320mg/kg bw)20倍的姜黄素,能在短时间内增强奥尼罗非鱼血清中SOD活性和前期CAT活性;但也显著抑制其T-AOC和后期CAT活性,且在96h内不能恢复到正常水平。
[1] 刘兆金,黄瑞林,印遇龙,等.姜黄素的营养生理作用综述[J].安徽农业科学,2006,34(7):1287-1288,1291.
[2] 朱晓薇.姜黄的药理作用[M].国外医药·植物药分册,1999,14(2):58-61.
[3] 沃兴德,洪行球,高承贤,等.姜黄素最大耐受量试验[J].浙江中医学院学报,2000a,24(2):55,82.
[4] 沃兴德,洪行球,高承贤,等.姜黄素长期毒性试验[J].浙江中医学院学报,2000b,24(1):61-65.
[5] 沈建忠.动物毒理学[M].北京:中国农业出版社,2002:96-99.
[6] 吴若菁,陈奋飞,庄捷,等.SO2的衍生物对泥鳅的急性毒性和染色体损伤研究[J].水生生物学报,2007,31(4):585-589.
(责任编辑:李岚春)
Study on the Toxicity of Curcumin
Lu Wanyi
(Guangdong Food and Drug Vocational Colldge,Guangdong Guangzhou 510520)
The experiments were conducted to study the biological function of curcumin in mossabica tilapia The investigation was conducted to study the effect of toxicity of curcumin on tilapia. The acute toxicity test of curcumin couldn’t measure LD-50, so the adunam vicem leration test on tilapia f rom mouse, taking 20 times of the no observed effect level (NOEL) dosage taken by an Mus musculus albus was conducted to determine the maximum tolerable dose (MTD.) toxicity effect on T-AOC, SOD, CAT with blood serum and hepatopancreas. Results suggest that as follows: curcumin taken high dose from mouse didn’t cause any death of tilapia; didn’t cause damage or teratogenic effect of erythrocyte chromosome, and didn’t cause tissue pathological change of stomachus, anterior intestine and hepatopancreas. Taking 20 times of NOEL dosage(320mg/kg bw) of curcumin taken by an Mus musculus albus, enhanced the SOD activity and the prophase of CAT activity in a short period; which, However, inhibitted the T-AOC and the anaphase of CAT activity lasting more than 96h. So Taking 20 times of NOEL dosage(320mg/kg bw) of curcumin taken by an Mus musculus albus, is hypotoxicity for tilapia.
Curcumin;Aquaculture;Biological Function
2014-03-28
卢婉怡(1977-),女,广东省食品药品职业技术学校化工工艺工程师,研究方向为生物技术教学及研发。
R285.1
A
1673-2197(2014)12-0012-03
