RNA干扰PPT1基因表达对小鼠Sertoli细胞功能的影响*
2014-04-22周婉格周任王统菲应倩李倩刘悦丁之德
周婉格周 任王统菲应 倩李 倩刘 悦丁之德
1. 上海交通大学医学院 2009级临床医学八年制(上海 200025);
2. 上海交通大学医学院人体解剖与组织胚胎学系
RNA干扰PPT1基因表达对小鼠Sertoli细胞功能的影响*
周婉格1周 任1王统菲1应 倩1李 倩1刘 悦2**丁之德2**
1. 上海交通大学医学院 2009级临床医学八年制(上海 200025);
2. 上海交通大学医学院人体解剖与组织胚胎学系
目的探索PPT1基因在小鼠支持细胞(Sertoli细胞)中的功能。方法采用RNA干扰技术下调小鼠Sertoli细胞株TM4中PPT1基因的表达,并运用MTS法检测细胞活力,Annexin V染色结合流式细胞技术检测细胞凋亡,Mito Tracker Red染料染色细胞,并在激光共聚焦显微镜下观察线粒体且测得荧光强度以检测线粒体活性,透射电镜观察线粒体超微结构变化。结果抑制小鼠TM4细胞中PPT1基因的表达可降低其细胞活力和线粒体活性,导致线粒体超微结构发生改变,并增加细胞凋亡率。结论PPT1基因对维持小鼠Sertoli细胞的功能具有重要作用。
RNA干扰; 棕榈酰蛋白硫酯酶1(PPT1); 塞尔托利细胞(Sertoli); 线粒体; 细胞凋亡
肥胖是一种严重的慢性病,可以引起包括心血管疾病,Ⅱ型糖尿病,高血压,癌症以及不育症[1,2]在内的许多健康问题。最近的研究数据表明在美国有超过35%的男性有肥胖问题(即BMI≥30 kg/m2)[3,4]。另一方面,目前在我国的适龄生育夫妇中,据统计有12.5%的夫妇患有不孕和不育,患者总数已超过4000万,其中由男性因素引起的不育约占一半左右,男性不育症的发病率呈快速上升趋势。近期的流行病学调查研究发现:肥胖与男性不育症的发生密切相关[5-7]。动物实验也证实肥胖可致雄性不育[8-10]。然而,迄今为止,肥胖所致雄性不育的研究都基于现象的描述,涉及其分子机制的研究很少。
前期研究中,我们构建了高脂饮食引起的肥胖大鼠动物模型,运用蛋白组学技术从雄性肥胖大鼠的睾丸蛋白中筛选出若干差异蛋白。发现棕榈酰蛋白硫酯酶-1(Palmitoyl protein thioesterase-1,PPT1)在肥胖大鼠睾丸组织中的表达明显升高;间接免疫荧光分析结果显示,PPT1主要定位于生精小管的Sertoli细胞和部分生精细胞;体外加入脂类物质如胆固醇、游离脂肪酸等可引起大鼠睾丸支持细胞(Sertoli细胞)的PPT1表达量显著增加。在本实验中,我们通过体外RNA干扰技术下调小鼠Sertoli细胞株TM4中PPT1基因的表达,进而检测其对TM4细胞各项功能性指标的影响,从而进一步了解PPT1基因的功能。
材料与方法
一、实验细胞
小鼠Sertoli细胞株TM4细胞(由上海市生殖医学重点实验室提供)。
二、主要试剂与仪器
(一)试剂
PPT1 shRNA表达质粒(上海吉玛制药技术有限公司提供)、DMEM培养液(Hyclone)、抗生素G418(Sigma)、质粒抽提试剂盒(Takara)、无内毒素大抽质粒试剂盒(Omega)、转染试剂FugENE HD(Roche)、Annexin V细胞凋亡检测试剂盒(Calbiochemistry)、MTS细胞活力检测试剂盒(Promega)、兔抗PPT-1抗体(Abgent)、羊抗兔HRP抗体(Abgent)。
(二)仪器
无菌操作台(SANYO),恒温培养箱(Thermo Fisher Scientific),PCR仪(Ependorf),荧光定量PCR仪(Applied Biosystems 7500),流式细胞仪(Becton Dickinson),透射电镜(Philips CM-120),激光共聚焦显微镜(Carl Zeiss LSM510),荧光光谱仪(PERKIN ENMER LS50)。
三、方法
(一)细胞培养、RNA干扰和荧光定量PCR
小鼠Sertoli细胞株TM4细胞以DMEM高糖培养液(含10% 胎牛血清)培养。
以PPT1基因序列GCAAGCACAGTACTGGCA TGA为靶序列设计shRNA引物,并从小鼠cDNA文库中扩增该序列。将shRNA片段克隆到目的表达载体后,经测序无误,转入DH5α感受态大肠杆菌。按照无内毒素大抽质粒说明书进行质粒抽提。
质粒转染TM4细胞:转染前1d,将细胞传代至6孔板中,细胞密度约105/mL。当细胞密度达到90%左右进行转染。将2 μg质粒与100 μL无血清的DMEM培养液柔和混匀,加入8 μL FuGENE转染试剂,混匀,室温静置20 min后加入各孔细胞培养液中。37℃5% CO2培养箱中培养。24 h后更换为含400 μg/mL G418的DMEM培养液,连续培养7d,从而获得稳定表达shRNA的TM4细胞。
荧光定量PCR检测:以5’ GGGAAGAACATGA TGGAGGAT 3’和5’ CTGGGAGAAGCCAATAGCA 3’为引物,采用Takara SYBR Green Realtime PCR试剂和ABI 7500荧光定量PCR仪检测PPT1基因表达情况。每组细胞PPT1及内参GAPDH各重复4次。随后,运用2-ΔΔCT法(Livak法)分析实验结果。
(二)细胞活力检测
采用MTS细胞活力检测试剂盒,每500 μL细胞培养液中加入100 μL MTS试剂,37℃,5%CO2培养箱中孵育60min,吸取200μL培养液置于96孔酶标板中,检测A490吸光值,从而判断细胞活力。
(三)线粒体荧光染色
Mito Tracker Red染料以DMEM培养液稀释至1 μg/ mL,与细胞孵育30 min。PBS洗去染色液。在激光共聚焦显微镜下观察,荧光生物发光仪测量荧光强度。
(四)线粒体电镜观察
TM4细胞以电镜固定液,4℃固定过夜。组织处理、包埋、切片及透射电镜检测由上海交通大学医学院生化与分子细胞系电镜室完成,主要观察线粒体超微结构变化。
(五)细胞凋亡检测
采用Annexin V细胞凋亡检测试剂盒检测细胞凋亡情况,具体操作如下:细胞消化为悬液,各组分别取500 μL细胞悬液,加入10 μL Media Binding Reagent, 随后加1.25 μL Annexin V,室温避光孵育20min,离心5 min吸去上清,加500 μL Binding Buffer重悬细胞,置于冰上,进行流式细胞检测。
结 果
一、shRNA对TM4细胞PPT1基因表达的抑制
通过荧光定量PCR方法在mRNA水平检测了RNA干扰对细胞PPT1基因表达的影响,结果显示:实验组(RNA干扰组)PPT1mRNA表达量是对照组(非RNA干扰组)的8.4%(图1A),即通过RNA干扰实验可以抑制TM4细胞中91.6%的PPT1基因mRNA表达。
二、shRNA对TM4细胞活力的影响
细胞增殖/活力检测试剂盒检测细胞活力显示:实验组细胞活力(A490:1.13±0.03)相对于对照组细胞活力(A490:1.46±0.03)显著下降(n = 6,P<0.01)(图1B)。
三、shRNA对TM4 细胞凋亡的影响
运用Annexin V染色结合流式细胞技术检测细胞凋亡率显示:实验组的细胞凋亡率为(19.07 ±6.33)%,而对照组细胞凋亡率仅为(9.68± 5.22)%,实验组较对照组细胞凋亡率显著增加(n = 5,P<0.05)(图1C)。
四、shRNA对TM4细胞线粒体活性的影响
Mito Tracker Red可对细胞活性线粒体进行荧光染色。在激光共聚焦显微镜下观察显示:正常TM4细胞线粒体具有良好的荧光染色,而表达绿色荧光蛋白的实验组TM4细胞线粒体荧光强度减弱(图2A),表明RNA干扰抑制PPT1表达可导致细胞线粒体活性下降。进一步采用荧光生物发光仪检测显示:实验TM4细胞线粒体荧光强度(77.14±14.22)较对照组(120.75 ±10.20)显著降低(n= 6,P<0.01)(图2B)。
五、shRNA对TM4细胞线粒体超微结构的影响
运用透射电镜观察TM4细胞线粒体的超微结构显示:实验组细胞线粒体呈明显的空泡化且线粒体嵴消失(图3)。

图1 TM4细胞PPT1 RNA干扰后细胞活力、细胞凋亡的比较
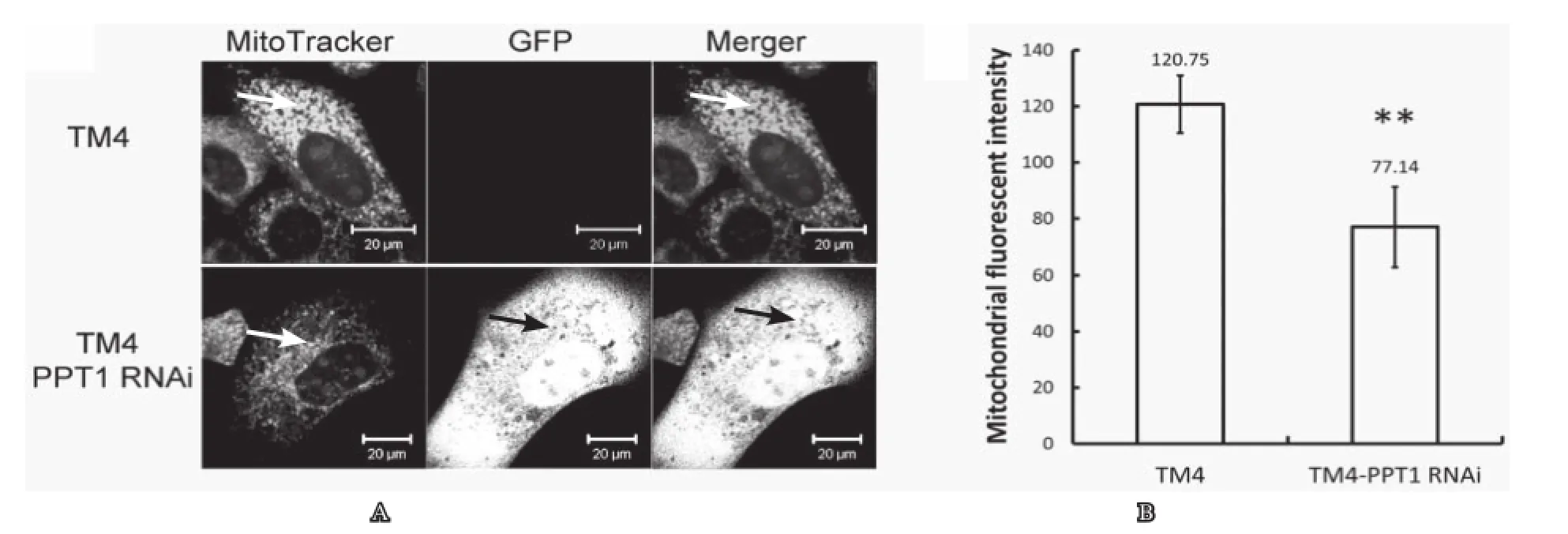
图2 PPT1 RNA干扰组和对照组线粒体荧光强度比较

图3 RNA干扰TM4细胞PPT1表达后线粒体超微结构的变化
讨 论
棕榈酰化是一种重要的蛋白翻译后修饰形式,目前已知有100多种蛋白质发生棕榈酰化修饰,赋予蛋白重要的生物学功能[11,12]。棕榈酰化蛋白在降解和回收利用过程中,需要去除棕榈酰修饰。这一工作由PPT1在溶酶体中完成[9]。PPT1功能缺失会造成神经元蜡样脂褐质沉积症[13,14]及胆固醇代谢的异常[15,16]。在生精上皮中,Sertoli细胞胞质内富含溶酶体并在精子发生过程中扮演了极为重要的角色,构成了生精细胞发育成熟的微环境。
实验中,我们运用RNA干扰技术成功抑制小鼠Sertoli细胞株TM4中PPT1基因的表达,基因沉默效率达到91.6%。在此基础上,我们检测了细胞活力的变化。运用MTS试剂处理细胞后测A490吸光值的方法可测量细胞活力。实验组的A490吸光值是1.13± 0.03,而对照组为1.46±0.03,表明RNA干扰PPT1基因会使TM4细胞活力显著下降。
线粒体为一双层膜围成的囊状结构,由内膜、外膜、外室、基质构成,存在于内膜的质子泵将基质内质子泵入外室,从而形成内负外正的线粒体跨膜电位(△ψm)。△ψm对维持线粒体正常功能是必要的[17],它的存在使一些正电荷荧光染料,如JC-1、CMX ROS可结合到线粒体基质。本实验中用的Mito Tracker Red染料对线粒体的染色效果与△ψm有关,而△ψm又可以反映线粒体的活性,因而可以用荧光的强度代表线粒体活性。荧光染色结果显示实验组TM4细胞线粒体荧光强度相对于对照组而言显著降低,表明实验组影响了细胞线粒体活性。另外,透射电镜结果也显示实验组细胞线粒体呈空泡化且线粒体嵴消失。这两项实验都表明RNA干扰PPT1基因会影响细胞线粒体的结构和功能。
线粒体的结构和功能与细胞凋亡有着密切的联系。在细胞凋亡早期,线粒体会出现内膜通透性增加、跨膜电位降低 、Ca2+摄入等改变。这些改变可导致线粒体通透孔道的开放和线粒体促凋亡蛋白释放[18],引起caspase非依赖的细胞凋亡[19];还可导致凋亡诱导因子(AIF)、细胞色素C(cyt-c)、凋亡蛋白酶激活因子-1(Apaf-1)的释放,激活caspase依赖的细胞凋亡途径[20]。
由于RNA干扰PPT1基因可使TM4细胞的线粒体结构和功能发生变化,而细胞线粒体的结构和功能直接影响细胞的凋亡过程,因此我们猜测RNA干扰PPT1同样能使TM4细胞的凋亡增加。运用Annexin V细胞染色结合流式细胞技术显示,实验组的细胞凋亡率为19.07%,而对照组细胞凋亡率为9.68%,实验组相比对照组TM4细胞凋亡显著增加,从而验证了我们的猜测。
综上所述,运用RNA干扰技术可使Sertoli细胞株TM4的PPT1基因沉默并造成细胞活力减退,细胞凋亡增加,线粒体活力以及超微结构改变,这些实验结果充分表明了PPT1基因对于维持细胞活力和抑制细胞凋亡具有重要作用。
1 Adams JP, Murphy PG. Obesity in anaesthesia and intensive care.Br J Anaesth2000; 85(1): 91-108
2 Practice Committee of American Society for Reproductive Medicine. Obesity and reproduction: an educational bulletin.Fertil Steril2008; 90(5 Suppl): S21-S29
3 Flegal KM, Carroll MD, Kit BK,et al. Prevalence ofobesity and trends in the distribution of body mass index among US adults, 1999-2010.JAMA2012; 307(5): 491-497
4 Cabler S, Agarwal A, Flint M,et al. Obesity: modern man's fertility nemesis.Asian J Androl2010; 12(4): 480-489
5 Pasquali R, Patton L, Gambineri A. Obesity and infertility.Curr Opin Endocrinol Diabetes Obes2007; 14(6): 482-487
6 Kort HI, Massey JB, Elsner CW,et al. Impact of body mass index values on sperm quantity and quality.J Androl2006; 27(3): 450-452
7 Hammoud AO, Gibson M, Peterson CM,et al. Obesity and male reproductive potential.J Androl2006; 27(5): 619-626
8 Bakos HW, Mitchell M, Setchell BP,et al.The effect of paternal diet-induced obesity on sperm function and fertilization in a mouse model.Int J Androl2011; 34(5 Pt 1): 402-410
9 Ghanayem BI, Bai R, Kissling GE,et al. Diet-induced obesity in male mice is associated with reduced fertility and potentiation of acrylamide-induced reproductive toxicity.Biol Reprod2010; 82(1): 96-104
10 Arsov T, Silva DG, O'Bryan MK,et al. Fat aussie-A new alström syndrome mouse showing a critical role for ALMS1 in obesity, diabetes, and spermatogenesis.Mol Endocrinol2006; 20(7):1610-1622
11 Rocks O, Gerauer M, Vartak N,et al. The palmitoylation machinery is a spatially organizing system for peripheral membrane proteins.Cell2010; 141(3): 458-471
12 Fukata Y, Fukata M. Protein palmitoylation in neuronal development and synaptic plasticity.Nat Rev Neurosci2010; 11(3): 161-175
13 Ramadan H, Al-Din AS, Ismail A,et al. Adult neuronal ceroid lipofuscinosis caused by def ciency in palmitoyl protein thioesterase 1.Neurology2007; 68(5): 387-388
14 Takano K, Shimono M, Shiota N,et al. Infantile neuronal ceroid lipofuscinosis: the first reported case in Japan diagnosed by palmitoyl-protein thioesterase enzyme activity def ciency.Brain Dev2008; 30(5): 370-373
15 Ahtiainen L, Kolikova J, Mutka AL,et al. Palmitoyl protein thioesterase 1 (Ppt1)-deficient mouse neurons show alterations in cholesterol metabolism and calcium homeostasis prior to synaptic dysfunction.Neurobiol Dis2007; 28(1): 52-64
16 Lyly A, Marjavaara SK, Kyttälä A,et al. Def ciency of the INCL protein Ppt1 results in changes in ectopic F1-ATP synthase and altered cholesterol metabolism.Hum Mol Genet2008; 17(10): 1406-1417
17 Kroemer G, Zamzami N, Susin SA. Mitochondrial control of apoptosis.Immunol Today1997; 18(1): 44-51
18 Norberg E, Gogvadze V, Ott M,et al. An increase in intracellular Ca2+is required for the activation of mitochondrial calpain to release AIF during cell death.Cell Death Differ2008; 15(12): 1857-1864
19 Norberg E, Orrenius S, Zhivotovsky B. Mitochondrial regulation of cell death: Processing of apoptosis-inducing factor (AIF).Biochem Biophys Res Commun2010; 396(1): 95-100
20 Reed JC. Cytochrome c: Can’t live with it-can’t live without it.Cell1997; 91(5): 559-562
(2013-11-11收稿)
The influence of PPT1 gene expression by RNA interference on Sertoli cells of mice*
Zhou Wange1, Zhou Ren1, Wang Tongfei1, Ying Qian1, Li Qian1, Liu Yue2**, Ding Zhide2**
1. Department of Clinical Medicine, School of Medicine, Shanghai Jiao Tong University, Shanghai 200025, China; 2. Department of Human Anatomy, Histology and Embryology, School of Medicine, Shanghai Jiao Tong University
Liu Yue, E-mail: liuyue@shsmu.edu.cn; Ding Zhide, E-mail: zding@shsmu.edu.cn
ObjectiveTo investigate the function ofPPT1gene in mose sertoli cells.MethodsThe expression ofPPT1gene in Sertoli cell line TM4 was inhibited using RNAi technique. Viability of transfected cells was measured by MTS. Meanwhile, cell apoptosis was detected by Flow Cytometry. The cells were stained by Mito Tracker Red and their mitochondrial activity was observed under the laser scanning confocal microscope.The ultrastructure of cell mitochondria was observed by transmission electron microscopy (TEM).ResultsThe inhibition ofPPT1gene expression decreased cell viability and mitochondrial activity, and resulted in the ultrastructural changes of the mitochondria as well as enhanced cell apoptosis rate.ConclusionPPT1plays a critical role in maintaining the structure and function of Sertoli cells.
RNA interference; palmitoyl protein thioesterase 1; Sertoli cells; mitochondria; apoptosis
10.3969/j.issn.1008-0848.2014.04.002
R 698.2
资助: 第五期上海市大学生创新项目和第五期上海交通大学医学院大学生创新项目(编号: 2011025)
**共同通讯作者: 刘悦, E-mail: liuyue@shsmu.edu.cn; 丁之德, E-mail: zding@shsmu.edu.cn
