去甲斑蝥素主动肝靶向性药物设计研究进展
2014-04-21赵岩蒋洪嘎鲁米雪杨慧
赵岩 蒋洪 嘎鲁 米雪 杨慧
肝脏肿瘤是常见的恶性肿瘤之一,它病程短,死亡率高,对人类健康威胁极大。去甲斑蝥素(norcantharidin,NCTD)是斑蝥素的衍生物,是中国自主研发的具有较强抗肿瘤活性和独特升高白细胞、保护肝细胞、调节免疫等作用的新型抗肿瘤药物[1],其毒性明显比斑蝥素低,而抗肿瘤作用优于斑蝥素[2],临床上用于肝癌的治疗或辅助治疗,显示出较好的疗效[3]。
NCTD 主要以片剂和注射剂应用于临床,魏春明等[4]研究了去甲斑蝥素小鼠体内药代动力学与组织分布,研究结果显示,小鼠口服3H-去甲斑蝥素吸收迅速,肝脏分布少且消除快,肾脏则分布多,但消除也快。体内分布结果表明NCTD 用于治疗肝癌到达靶器官的浓度低,因此不仅药效减弱,而且对其他脏器有较大的毒性。为更好的发挥其疗效,降低毒副作用,延长作用时间,药学工作者就其肝靶向性药物设计进行大量的研究,取得了一定进展。靶向药物设计是通过优化药物传输过程,使药物按照预定目标到达某器官、组织或靶点,增加药物在靶点或作用部位的生物利用度,同时减少在其他部位的作用,以减少毒副作用,提高治疗效果的一种设计方法[5]。实现药物的主动肝靶向传输过程的靶向药物设计是依据受体—配体结合或抗原—抗体结合等生物特异性相互作用原理。近几年进行的去甲斑蝥素主动肝靶向的研究主要有单克隆抗体导向药物,去唾液酸糖蛋白受体介导的前体药物及表面修饰的纳米粒和脂质体等。
1 单克隆抗体导向NCTD 主动肝靶向药物研究
将单克隆抗体作为特异性载体与药物的功能基或与经过修饰后的功能基团相连结,生成单克隆抗体—药物偶联物,制成导向药物,利用单克隆抗体特异性趋向于抗原的特性,将药物高浓度地输送到靶点细胞表面,再经化学或酶催化方式断裂偶联键分解出药物原型,在作用靶点细胞局部形成可以产生药理活性所需要的药物浓度而发挥作用,从而减少药物向非靶位的分布和结合,降低药物的毒副作用。
梁福佑等[6]采用抗人肝癌大鼠单克隆抗体3A5与去甲斑蝥素偶联,以克隆生成法观察偶联物经静脉给药和肿瘤局部给药对肿瘤的治疗作用,结果显示偶联物对裸鼠移植人肝癌BEL-7402 细胞具有比去甲斑蝥素更强的细胞毒性。静脉给药时,去甲斑蝥素和其偶联物对肿瘤的抑制率分别为15% 和63%,瘤结周围给药时,去甲斑蝥素和其偶联物对肿瘤的抑制率分别为47%和78%,提示偶联物对靶细胞的杀伤力强于游离去甲斑蝥素,说明单克隆抗体3A5 与去甲斑蝥素偶联物对肝脏肿瘤具有良好的导向性。单抗偶联物虽具有体内分布特异性,但因单抗偶联物为大分子物质,较难穿过细胞外间隙到达实体瘤的深部,因此到达肿瘤细胞的药物量仍属有限,这也是研究单抗偶联物时需解决的问题之一。
2 受体介导NCTD 主动肝靶向药物研究
受体与配基的结合具有高度的专一性,受体的结合部位能够专一性的识别相应配基并与之结合,这种局部结构的专一性匹配是受体介导靶向药物的理论基础[5]。
2.1 去唾液酸糖蛋白受体介导NCTD 的研究
去唾液酸糖蛋白受体(asialoglycoprotein receptor,ASGPR)是一种表达在肝实质细胞表面的专一性识别末端含有半乳糖或乙酰氨基半乳糖的糖蛋白去唾液酸糖蛋白受体,又称半乳糖受体。由于半乳糖残基修饰药物在体内具有较强的稳定性,以及其修饰较为方便,且其修饰物具有较好的靶向性等诸多优点,以半乳糖残基为配体修饰药物来实现肝靶向是去唾液酸糖蛋白受体介导的肝靶向研究中最多的[7-10]。通常将药物或载体等经半乳糖糖基化制成以ASGPR 受体为介导的肝靶向前体药物或半乳糖基修饰的载药微粒[11-13]。
2.1.1 NCTD 半乳糖化前药 前体药物简称前药,是活性药物经过化学修饰后得到的化合物,在体内通过酶的作用又转化为原来的药物而发挥药效,以利于药物的吸收、分布、代谢和排泄[1]。因此,能通过改变靶器官的pH 值和某些酶的活性来实现母药的定位释放。
范峰等[14]以去甲斑蝥素为原料,以各种小分子氨基酸修饰后,过酰化、氢解、糖苷化和脱乙酰基反应,合成了去甲斑蝥素—半乳糖衍生物(见图1),期望得到肝靶向抗癌前药。对产物a(见图1)进行初步小鼠体内抗肿瘤实验的结果显示,化合物a 中、高剂量组抑瘤率明显高于NCTD 组,表明半乳糖苷化对NCTD 的抗癌作用有一定提高,肝靶向性有待进一步的研究。
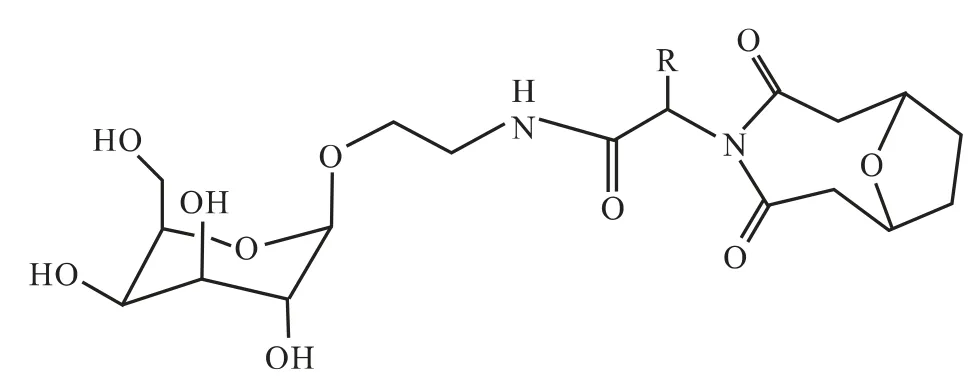
图1 范峰等合成的去甲斑蝥素—半乳糖衍生物
胡展红等[11]以乙二胺为连接臂将去甲斑蝥素和乳糖酸连接合成了前体药物乳糖化—去甲斑蝥素(1actosyl-norcantharidin,Lac-NCTD)(见图2),期望利用分子结构上的半乳糖残基被体内肝细胞的AS-GP-R 特异性识别,达到主动肝靶向性的目的。急性毒性研究结果显示Lac-NCTD 的毒性远小于NCTD,是一种安全无毒的新化合物[12]。
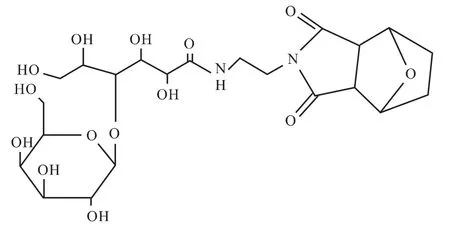
图2 胡展红等合成的乳糖化去甲斑蝥素
2.1.2 半乳糖修饰的NCTD 纳米粒 纳米粒是大小在10~1000 nm 之间的固态胶体颗粒,可作为传输药物的载体,将药物包封于纳米粒中,可调节释药速度、增加生物膜的通透性、改变药物在体内的分布以及提高药物生物利用度等[13]。对纳米粒进行表面修饰,如在其表面耦联特异性的靶向分子(特异性的配体、单克隆抗体等),纳米粒可通过靶向分子与细胞表面特异性受体结合从而实现主动靶向治疗[15]。
胡展红等[16]、管敏等[17]采用噻唑基四唑比色法考察NCTD、Lac-NCTD 及乳糖化-去甲斑蝥素纳米粒(Lactose-oriented-to cantharidin nanoparticles,Lac-NCTD-NPs)对肿瘤细胞株HepG2、SMMC-7721 和SGC-7901 的细胞毒作用;通过H22 荷瘤小鼠模型考察药物体内对肝癌的抑制作用。体外细胞毒试验结果显示,Lac-NCTD 及Lac-NCTD-NPs 对上述肿瘤细胞具有强抑制活性;小鼠体内抑瘤实验结果显示Lac-NCTD-NPs 中剂量的抑瘤率为63.9%,显著高于相同浓度的NCTD 和Lac-NCTD。说明Lac-NCTD-NPs 能有效地靶向于肝肿瘤组织,抑制肿瘤的生长,是一种较强的具有体内外抗癌活性的新型肝靶向性制剂。
管敏等[18]采用Caco-2 细胞单层模型,研究了Lac-NCTD 及Lac-NCTD-NPs 的细胞摄取、转运机制。得到结论:Lac-NCTD 主要以主动转运方式被吸收,少部分通过旁路转运被Caco-2 细胞摄取和转运,此过程受P-糖蛋白和多药耐药相关蛋白2 外排蛋白的影响,且药物纳米粒的摄取和转运较其溶液均有增加。在细胞摄取和转运中,Lac-NCTD-NPs 的摄取量、渗透系数均比相同质量浓度Lac-NCTD 溶液的对应值要大,提示壳聚糖包裹的Lac-NCTD 纳米粒制剂有利于细胞的药物吸收。
壳聚糖是生物可降解并和生物相容、天然无毒的高分子碱性氨基多糖,带正电荷,具有独特的跨细胞膜能力。肿瘤细胞具有比正常细胞表面更多的负电荷,壳聚糖在酸性环境中选择性吸附肿瘤细胞表面并起电中和作用,能直接抑制肿瘤细胞,通过活化免疫系统抑制肿瘤细胞活性,文献研究报道[19-21]将半乳糖基引入到壳聚糖的结构有望成为潜在的肝靶向载体。
匡长春等[22]研究去甲斑蝥素壳聚糖纳米粒在小鼠体内的分布并以靶向指数targeting index,TI)判断其对主要脏器的靶向性。结果显示去甲斑蝥素壳聚糖纳米粒在肝脏中的浓度明显高于去甲斑蝥素,具有明显的靶向作用,对其他组织则无靶向作用。
胡玮等[23]以N-乳糖酰壳聚糖为载体,制备去甲斑蝥素N-乳糖酰壳聚糖纳米粒(Norcantharidin Nlactose-chitosan nanoparticles,NCTD-GC-NPs),去甲斑蝥素壳聚糖纳米粒(norcant-haridin chitosan nanoparticles,NCTD-CS-NPs)并以H22 荷瘤小鼠为肿瘤模型动物,考察NCTD,NCTD-CS-NPs 及NCTD-GCNPs 在小鼠体内的抗肿瘤活性,实验显示,NCTDGC-NPs 在体内具有良好的肝靶向抗肿瘤活性;组织切片直观反映出纳米粒制剂尤其是乳糖酸壳聚糖纳米可增强NCTD 对肿瘤的杀伤作用,表明去甲斑蝥素N-乳糖酰壳聚糖纳米粒在体外可发挥双重靶向作用,显著提高药物的抗肿瘤作用。
2.1.3 半乳糖修饰的NCTD 脂质体 脂质体作为药物被动靶向的一种主要载体,经静脉给药后,主要被肝脏的非实质细胞所吞噬并进一步消除,极少到达肝实质细胞。采用受体介导实现脂质体的肝实质细胞靶向是一种非常有效的措施,其中半乳糖受体的研究最为广泛和深入[24]。
姜华等[7]制备半乳糖衍生物修饰去甲斑蝥酸钠脂质体(galactose norcantharidin liposomes,GNL),以半乳糖为起始物,经乙酰化、溴代、缩合、置换后得化合物Galβ1-(CH2-CH2-O)2-C14-H29 作为修饰靶向材料,制备了去甲斑蝥酸钠脂质体和GNL,利用RP-HPLC 测定小鼠尾静脉注射给药后小鼠肝脏中的药物浓度。实验表明脂质体表面经化合物Galβ1-(CH2-CH2-O)2-C14-H29 修饰后,GNL 肝脏靶向效率是去甲斑蝥酸钠脂质体的1.8 倍,是去甲斑蝥酸钠注射液的2.9 倍。由此说明在脂质体表面结合能被肝细胞特异识别的半乳糖苷,形成半乳糖受体介导的脂质体,有望成为更为理想的肝靶向药物载体。
Lac-NCTD 的水溶性高,使其脂质体的包封率极低,直接影响了药物的生物利用度。周奕等[25]将乳糖化-去甲斑蝥素与磷脂按一定配比,制备成乳糖化去甲斑蝥素磷脂复合物,旨在改善药物的脂溶性进而提高其在体内的吸收,同时制备pH 敏感型脂质体可控制脂质体在肿瘤部位的释放,从而提高药效,降低毒性。
2.2 甘草次酸受体介导的NCTD 脂质体的研究
近年来,一种新型的肝特异性配基甘草皂苷及其苷元甘草次酸正在引起人们的关注[24]。Negishi证实了大鼠肝细胞膜上含有丰富的甘草次酸及甘草酸特异性结合位点[26],随后的研究也证实甘草次酸/甘草酸修饰的载体有趋肝性[27]。
吴超等[28]利用薄膜分散法制备甘草次酸衍生物甘草次酸硬脂醇酯-3-O-半乳糖苷(Stearin glycyrrhetinic acid ester-3-O-galactosidase,Gal-GAOSt)修饰去甲斑蝥素脂质体后,经小鼠尾静脉给药,采用HPLC 法检测去甲斑蝥素在小鼠肝肾中的浓度随时间的变化,与去甲斑蝥素水溶液组进行比较血药浓度-时间曲线下面积(area under concentration-time curve,AUC)并以靶向指数TI=(AUC)NC-SOL/(AUC)Gal-GAOStNC-LP来判断甘草次酸衍生物修饰去甲斑蝥素脂质体(Gal-GAOStNC-LP)对主要器官的靶向性。结果显示,Gal-GAOStNC-LP 具有肝靶向性,并且被修饰的脂质体靶向性明显,能提高药物疗效,降低毒副作用。
3 结语与展望
去甲斑蝥素单抗偶联物,半乳糖介导的肝靶向前体药物,半乳糖基修饰的纳米粒及脂质体等,它们都不同程度地提高了肝靶向性,增加了药物在肝肿瘤细胞中的浓度,降低了毒副作用,但也存在着一些需解决的问题,如不能口服,需注射给药;载药量有限,投放的药物到达靶组织浓度低,难以达到足够治疗剂量等。这也促使人们寻找更佳的主动肝靶向载体,如新型的甘草次酸衍生物,胆酸等都可作为去甲斑蝥素主动肝靶向传输系统中的载体进行研究。相信通过广泛深入的研究,有望开发出应用于临床的主动肝靶向去甲斑蝥素药物。
[1]娄田田,杜娟,陈祥盛,等.斑蝥素及衍生物抗肿瘤机制的研究进展[J].亚太传统医药,2012,10(8):206.
[2]李先茜,李晓丽,吴嘉熙,等.去甲斑蝥素诱导肿瘤细胞凋亡的研究进展[J].检验医学与临床,2013,10(9):1145-1146.
[3]胡卫,谭复成,去甲斑蝥素抗肝癌的研究概况[J].辽宁中医药大学学报,2007,9(2):39-40.
[4]魏春敏,王本杰,马娅,等.3H-去甲斑蝥素小鼠体内药代动力学与组织分布[J].药学学报,2007,42(5):516 -519.
[5]仇缀百.药物设计学[M].第二版高等教育出版社,2008,215-226.
[6]梁福佑,张胜华,潘颖,等.去甲斑蝥素与单克隆抗体偶联物治疗肝癌实验研究[J].动物学杂志,1999,2(2):1-7.
[7]姜华,杨景明.半乳糖衍生物修饰去甲斑蝥酸钠脂质体的主动靶向性研究[J].数理医药学杂志,2009,22(3):277-279.
[8]郭波红,程怡,林绿萍,等.去唾液酸糖蛋白受体介导的肝靶向脂质体配体的酶促催化合成研究[J].中国药学杂志,2012,47(1):40-43.
[9]孙军,王宇哲,宗义强,等.脱唾液酸糖蛋白受体介导的vP3基因靶向性治疗肝癌的实验研究[J].医学分子生物学杂志,2004,1(1):5-9.
[10]乔健,黄建萍,曹利民,等.去唾液酸糖蛋白受体H1 亚基CRD 的原核表达、纯化及特性分析[J].苏州大学学报,2006,26(5):717-724.
[11]胡展红,肇良,周奕,等.肝靶向去甲斑螯素修饰物的合成及其纳米粒的制备[J].中国药学杂志,2009,44(9):679-684.
[12]胡展红,张全英,张学农,等肝靶向去甲斑蝥素修饰物的结构确证及急性毒性研究[J].时珍国医国药,2012,23(1):39-40.
[13]史涛,陈建清.负载抗肿瘤药物的天然高分子纳米粒研究进展[J].世界临床药物,2012,33(12):748-751.
[14]范锋,孙晓飞.去甲斑蝥素-半乳糖衍生物的合成与抗癌活性[J].药学学报,2008,43(2):157-161.
[15]郑延波.徐克纳米载药系统靶向治疗肝癌的研究进展[J].中国介入影像与治疗学,2008,4:143-146.
[16]胡展红,周奕,张学农,等.乳糖化-去甲斑蝥素纳米粒的肝靶向抗癌活性研究[J].中草药,2010,41(12):2005-2010.
[17]管敏,周奕,贝永燕,等.乳糖化一去甲斑蝥素抗肿瘤药效学及急性毒性试验研究[J].抗感染药学,2010,7(3):171-175.
[18]管敏,贝永燕,陈晓艳,等.乳糖化-去甲斑蝥素及其纳米粒在Caco-2 细胞模型中的跨膜转运机制[J].中草药,2011,42(4):722-726.
[19]张灿,丁娅,沈健,等.新型肝靶向载体N-乳糖酰化壳聚糖的制备与表征[J].中国药科大学学报,2003,34(5):387-390.
[20]张灿,丁娅,平其能.水溶性6-O-琥珀酰-N-半乳糖化壳聚糖衍生物的制备与表征[J].中国药科大学学报,2005,36(4):291-295.
[21]赵晓威.肝靶向性壳聚糖基纳米载药体系的研究与应用[J].中国组织工程研究与临床康复,2010,38(14):7193-7196.
[22]匡长春,何文,罗顺德,等.去甲斑蝥素壳聚糖纳米粒在小鼠体内分布及肝靶向作用[J].中国医院药学杂志,2005,25(6):527-530.
[23]胡玮,章良,张学农,等.去甲斑蝥素N-乳糖酰壳聚糖纳米粒的肝靶向抗肿瘤药效学评价[J].中国新药杂志,2010,19(19):1814-1820.
[24]杨山麦,周方成,顾云娣,等.离体鼠肝细胞膜上甘草次酸和甘草酸受体的表达.中华肝脏病杂志,1999,7(增刊):27.
[25]周奕,许静玉,张学农,等.乳糖化-去甲斑蝥素磷脂复合物及其PH 敏感型脂质体的制备[J].中国新药杂志,2011,20(17):1631-1638.
[26]Negisbi M,lrie A,Nagata N,et al.Specific binding of glycyrrhetinic acid to the rat liver membrane[J].Bioehim Biophys Aeta,199l,1066:77.
[27]Tian Q,Wang XH,Wang W,et al.Understanding the role of the C3-hydroxyl group in glycyrrhetinic acid on liver targeting[J].J Control Release,2011,152:237-239.
[28]吴超,郭伟英,张磊,等.甘草次酸衍生物修饰去甲斑蝥素脂质体在小鼠体内肝靶向性研究[J].辽宁医学院学报,2008,29(6):490-495.
