化肝通络方对胆汁性肝硬化模型大鼠的抗纤维化作用及其机制研究
2014-04-18宣佶田耀洲曹鹏胡春萍蔡雪婷张伟
宣佶 田耀洲 曹鹏 胡春萍 蔡雪婷 张伟
(1.南京中医药大学,江苏南京 210023;2.解放军81医院,江苏南京 210002;3.江苏省中医药研究院,江苏南京 210028)
化肝通络方对胆汁性肝硬化模型大鼠的抗纤维化作用及其机制研究
宣佶1,2田耀洲1,3曹鹏3胡春萍3蔡雪婷3张伟3
(1.南京中医药大学,江苏南京 210023;2.解放军81医院,江苏南京 210002;3.江苏省中医药研究院,江苏南京 210028)
目的:探讨化肝通络方对胆汁性肝硬化模型大鼠的抗纤维化作用及其机制。方法:大鼠随机分为假手术组、模型组、熊去氧胆酸(UDCA)组和化肝通络方高、中、低剂量组,除假手术组外,其余各组大鼠均利用结扎大鼠胆总管方法制造胆汁淤积肝硬化模型。于造模后第2周开始分别给药,给药4周后取大鼠血清测总胆红素(T-Bil)、直接胆红素(D-Bil)、谷丙转氨酶(ALT)、谷草转氨酶(AST)等肝功能指标,取部分肝脏行HE染色观察肝脏病理形态变化,ELISA法测定血清α-平滑肌肌动蛋白(α-SMA)、金属蛋白酶组织抑制因子-1抗体(TIMP-1)、细胞间黏附分子(ICAM-1)的表达,免疫组化方法测定肝组织转化生长因子β1(TGF-β1)、信号传导蛋白3(Smad3)、Smad7的表达。结果:与假手术组相比,模型组大鼠T-Bil、D-Bil、ALT、AST等肝功能指标均明显升高,且血清中α-SMA、TIMP-1、ICAM-1高表达。模型组大鼠肝脏出现炎性细胞活动及纤维组织增生等病理改变。化肝通络方各剂量组、UDCA组与模型组比较,各项肝纤维化指标均有明显下降,肝组织中TGF-β1、Smad3蛋白表达亦明显下降,Smad7表达明显升高。结论:化肝通络方对胆汁性肝硬化模型大鼠具有明显的抗纤维化作用,其机制可能与TGF-β/smad信号通路有关。
胆汁性肝硬化 化肝通络方 肝功能 肝纤维化指标 病理学 实验研究
胆汁性肝硬化分为继发性胆汁性肝硬化和原发性胆汁性肝硬化(primary biliary cirrhosis,PBC),前者由肝外胆管长期梗阻引起。PBC是一种慢性进展性自身免疫病,因肝内长期、持续性的胆汁淤积,引起肝脏纤维化、肝硬化并最终导致肝衰竭,其起病隐匿,早期常常无明显症状,部分患者到已达肝功能失代偿期时才就诊,因而预后较差[1-2]。药物治疗方面熊去氧胆酸(UDCA)是目前公认的对PBC具有确实疗效的首选治疗药物,但迄今尚无特异性药物,而UDCA也仅仅对部分患者有效[3]。田耀洲教授通过中医辨证论治研究总结了中药化肝通络方,治疗本病获得了较好的疗效。本研究拟对化肝通络方的疗效进行科学评价,并探索其作用机制。
1 实验材料
1.1 药品与试剂熊去氧胆酸(UDCA),Losan Pharma GmbH生产;化肝通络方(药物组成:人工牛黄0.1g、红花15g、五灵脂15g、余甘子30g、印度獐牙菜15g、肉豆蔻10g、黄芪25g、木香10g、伞梗虎耳草15g、芫荽果10g、沉香3g、石榴子20g、烈香杜鹃8g、冬葵果15g、甘草10g),由江苏省中西医结合医院提供;血清α-平滑肌肌动蛋白(α-SMA)ELISA测定试剂盒,BioSource公司(Lot No20120709);金属蛋白酶组织抑制因子-1抗体(TIMP-1)ELISA测定试剂盒,R&D Systems China(Lot No291100);细胞间黏附分子(ICAM-1) ELISA测定试剂盒,R&D Systems China(Lot No295330);抗TGF-β1、Smad3、Smad7多克隆抗体,Cell Signaling Technology。
1.2 实验动物清洁级SD大鼠72只,全雄,体重(180±20)g,购于南京青龙山动物繁殖场,合格证号:SCXK(苏)2010-0001。
1.3 主要仪器全自动生化分析仪:日本日立公司;光学显微镜:日本Olympus公司;自动放射免疫计数机:中国科学技术大学中佳公司;台式高速冷冻离心机:Eppendorf centrifuge 5417R,德国Eppendorf公司;电热恒温水槽:DK-8D型,上海医用恒温设备厂;酶联免疫检测仪:Thermo公司。
2 实验方法
2.1 分组与造模取72只大鼠标号后,随机分为假手术组12只与造模组60只。大鼠予10%水合氯醛溶液(300mg/kg)腹腔注射麻醉后,沿腹正中线开腹,找到并暴露胆总管,假手术组仅分离胆总管后关腹,造模组在肝门部胆管周围的近端结扎胆总管后,常规关腹。术后连续3d注射青霉素40万单位/只,正常喂养[4]。
将造模成功的60只胆汁性肝硬化模型大鼠随机分为模型组、熊去氧胆酸(UDCA,58.3mg·kg-1·d-1)组和化肝通络方高剂量(4.36g·kg-1·d-1)、中剂量(2.18g·kg-1·d-1)、低剂量(1.09g·kg-1·d-1)组,每组12只,并于第8天开始各组大鼠按10mL/kg的体积灌胃相应药物,1次/d,共7d。假手术组及模型组给等体积生理盐水。于最后1次灌胃后24h处死各组大鼠测定相关指标。
2.2 检测指标
2.2.1 肝功能按照南京建成生物工程研究所试剂盒的方法检测总胆红素(T-Bil)、直接胆红素(D-Bil)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、γ-谷氨酰转肽酶(GGT)及碱性磷酸酶(ALP)。
2.2.2 肝组织学观察肝组织经4%中性甲醛固定,石蜡切片,按常规方法行HE染色,光镜下观察肝组织的病理变化。
2.2.3 血清α-SMA、TIMP-1、ICAM-1测定将检测血清严格按照酶联免疫吸附(ELISA)试剂盒操作步骤进行,分别测定血清中α-SMA、TIMP-1、ICAM-1的含量。
2.2.4 肝组织转化生长因子β1 (TGF-β1)、信号传导蛋白3(Smad3)、Smad7的表达检测免疫组化染色采用SP法,处死后的大鼠肝脏经10%的甲醛溶液固定,石蜡包埋,4μm连续切片,脱蜡至水,枸橼酸缓冲液高压修复抗原3.5min,待切片晾至室温后滴加3%H2O2,37℃孵育15min,PBS洗3次,每次5min,滴加胰酶消化15min,PBS洗片3次,每次5min。分别滴加TGF-β1、Smad3、Smad7一抗工作液(工作液浓度分别为1∶100、1∶50,用PBS稀释),4℃孵育过夜。次日取出切片,PBS洗片3次,每次5min;滴加二抗工作液,37℃孵育40min。蒸馏水洗2次,每次5min,用现配制的DAB溶液显色10min,苏木精衬染2min,分化、返蓝各30s,梯度乙醇脱水,二甲苯透明,中性树胶封片,计算机扫描分析蛋白的阳性数目、灰度值和相对光密度。
3 实验结果
3.1 治疗后各组大鼠血清肝功能指标测定见表1。
3.2 各组大鼠肝脏组织HE染色病理形态假手术组大鼠肝小叶结构存在,肝板排列整齐,个别结构稍紊乱,以中央静脉为中心向周围放射状排列,肝细胞多边形,浆丰富,核大而圆,少见双核;模型组大鼠肝脏散在炎性细胞浸润,纤维结缔组织增生将肝小叶分割成假小叶结构;UDCA组大鼠肝脏无明显炎性细胞浸润,纤维结缔组织增生明显改善;化肝通络方低剂量组大鼠肝脏炎性细胞浸润存在,纤维结缔组织轻度增生;化肝通络方中剂量组大鼠肝脏炎性细胞浸润减少,少许纤维结缔组织增生;化肝通络方高剂量组大鼠肝脏无明显炎性细胞浸润,纤维结缔组织增生明显改善。见图1。
3.3 各组大鼠血清α-SMA、TIMP-1、ICAM-1表达比较见表2。
3.4 各组大鼠肝组织TGF-β1、Smad3、Smad7表达比较见表3。
表1 各组大鼠治疗后肝功能生化指标(±s)

表1 各组大鼠治疗后肝功能生化指标(±s)
注:与模型组比较,**P<0.01;与假手术组比较,##P<0.01;与UDCA组比较,△P<0.05,△△P<0.01。
组别动物数(只)ALT(U/L)AST(U/L)假手术组8 T-Bil(μmol/L)30.8±11.559.4±11.4 D-Bil(μmol/L)GGT(U/L)0.84±0.29 ALP(U/L)0.25±0.4258.38±1.8747.67±16.42 567.0±238.8##611.6±283.4##模型组854.06±9.70##40.38±4.90##254.43±23.37##318.38±198.90##UDCA组842.6±26.6**128.2±73.4**0.88±0.27**0.68±0.37**58.08±1.91**53.70±19.60**化肝通络方高剂量组845.2±31.0**109.9±48.1**0.97±0.39**0.85±0.35**△59.04±3.14**55.90±26.13**化肝通络方中剂量组834.6±18.3**△99.0±36.7**△1.07±0.28**△0.84±0.19**△57.66±3.71**49.78±23.19**化肝通络方低剂量组8228±125.9**△△209.0±73.2**△1.56±0.62**△1.26±0.49**△58.20±1.84**114.56±95.29**△

图1 各组大鼠肝组织病理变化(HE,200×)
表2 各组大鼠治疗后血清α-SMA、TIMP-1、ICAM-1水平比较(±s)pg/mL
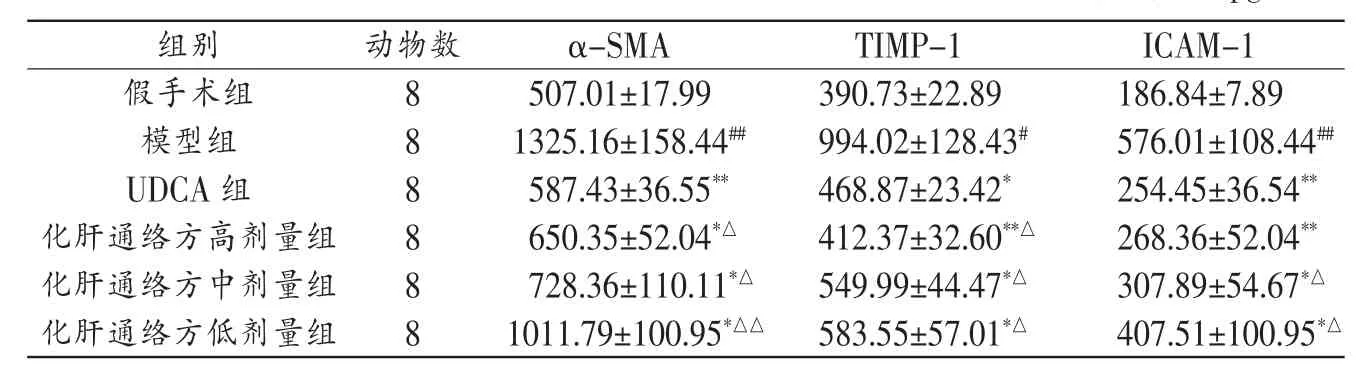
表2 各组大鼠治疗后血清α-SMA、TIMP-1、ICAM-1水平比较(±s)pg/mL
注:与模型组比较,*P<0.05,**P<0.01;与假手术组比较,#P<0.05,##P<0.01;与UDCA组比较,△P<0.05,△△P<0.01。
组别动物数假手术组α-SMATIMP-1 8 ICAM-1 507.01±17.99390.73±22.89186.84±7.89模型组81325.16±158.44##994.02±128.43#576.01±108.44##UDCA组8587.43±36.55**468.87±23.42*254.45±36.54**化肝通络方高剂量组8650.35±52.04*△412.37±32.60**△268.36±52.04**化肝通络方中剂量组8728.36±110.11*△549.99±44.47*△307.89±54.67*△化肝通络方低剂量组81011.79±100.95*△△583.55±57.01*△407.51±100.95*△
表3 各组大鼠肝组织TGF-β1、Smad3、Smad7免疫组化染色的比较(±s)
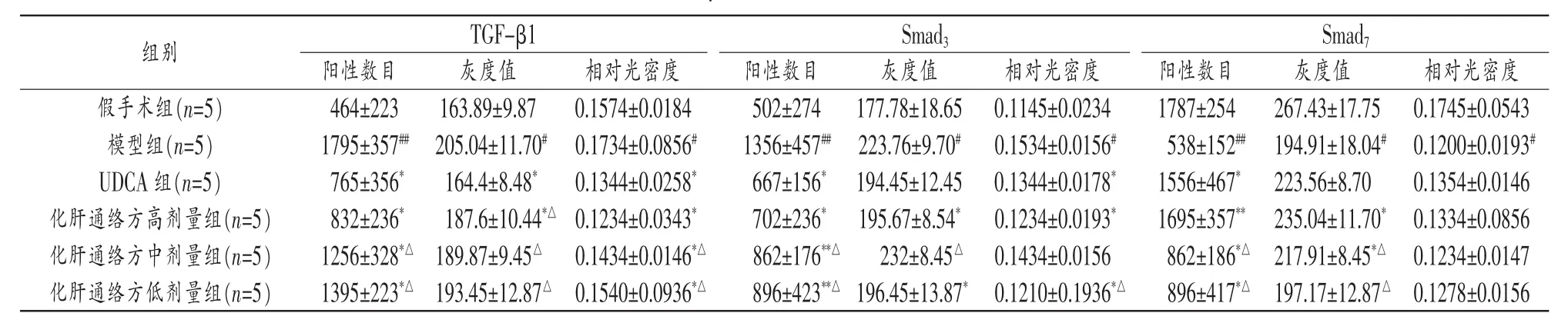
表3 各组大鼠肝组织TGF-β1、Smad3、Smad7免疫组化染色的比较(±s)
注:与模型组比较,*P<0.05,**P<0.01;与假手术组比较,#P<0.05,##P<0.01;与UDCA组比较,△P<0.05。
Smad3组别假手术组(n=5)灰度值相对光密度267.43±17.750.1745±0.0543 1795±357##1356±457##538±152##TGF-β1阳性数目阳性数目464±223502±274灰度值相对光密度163.89±9.870.1574±0.0184灰度值相对光密度177.78±18.650.1145±0.0234 Smad7阳性数目1787±254模型组(n=5)205.04±11.70#0.1734±0.0856#223.76±9.70#0.1534±0.0156#194.91±18.04#0.1200±0.0193#UDCA组(n=5)765±356*164.4±8.48*0.1344±0.0258*667±156*194.45±12.450.1344±0.0178*1556±467*223.56±8.700.1354±0.0146化肝通络方高剂量组(n=5)832±236*187.6±10.44*△0.1234±0.0343*702±236*195.67±8.54*0.1234±0.0193*1695±357**235.04±11.70*0.1334±0.0856化肝通络方中剂量组(n=5)1256±328*△189.87±9.45△0.1434±0.0146*△862±176**△232±8.45△0.1434±0.0156862±186*△217.91±8.45*△0.1234±0.0147化肝通络方低剂量组(n=5)1395±223*△193.45±12.87△0.1540±0.0936*△896±423**△196.45±13.87*0.1210±0.1936*△896±417*△197.17±12.87△0.1278±0.0156
4 讨论
近年来,中医药辨证施治治疗胆汁性肝硬化取得了一定疗效。现代医家多依据病程的不同阶段将本病分别归属于“皮肤瘙痒”、“黄疸”、“胁痛”、“鼓胀”、“积聚”、“水肿”、“血证”、“虚劳”等范畴[5]。本病虚实夹杂,本虚标实。本虚以肝、脾、肾三脏为主,标实以气滞、湿浊(热)、血瘀、水停等为主。肾主骨,肝主筋,肝肾精血不足,失于濡养,则患者多骨节疼痛、腰膝酸软、发枯齿摇、经水早闭、目涩口干。脾主运化,运化水谷精微及水湿,脾虚则纳少便溏,湿浊内阻,湿聚水停,腹胀足肿,久之则乏力倦怠,萎黄神疲。肝主疏泄,与胆腑互为表里,烦劳则肝失条达,气滞血瘀、湿热熏蒸则致黄疸[5-6]。化肝通络方由红花、五灵脂、牛黄、印度獐牙菜、黄芪、木香等组成,其中红花、五灵脂等活血通络,牛黄、印度獐牙菜等清热解毒、疏肝利胆,黄芪、木香等健脾理气。全方具有清热解毒、活血利水、理气健脾、补益肝肾等功效。
肝纤维化是胆汁性肝硬化的重要中间环节,目前研究表明,肝纤维化的显著特征是细胞外基质(Extra cellular matrix,ECM)的增加和成分的改变,而肝星状细胞(hepatic stellate cells,HSCs)的活化和增殖是其关键和中心环节[7]。α-SMA是肝星状细胞活化的特征性标志物[8];TIMP-1与肝纤维化密切相关,TIMPs可选择性地结合MMPs,抑制MMPs降解ECM的活性[9];ICAM-1的表达是HSC活化的固有的生物学特性之一,ICAM-1为免疫球蛋白超家族的一种黏附分子,能表达于淋巴细胞及中性粒细胞等表面,在炎症反应中,ICAM-1是细胞与细胞接触过程中起中心作用的一种细胞黏附分子[10]。
TGF-β/smad细胞信号通路与肝纤维化的发生、发展密切相关,TGF-β1参与活化肝星状细胞并促进胶原蛋白基因表达,肝脏纤维化使TGF-β1合成明显增多,肝脏组织表达TGF-β1增强,而Smads蛋白家族作为TGF-β1膜受体的特异性底物,根据功能分为三类:膜受体激活Smad、通用Smad和抑制性的Smad。Smad3属于激活的Smad,在肝纤维化发生时其表达显著增加,具有活化、促进胶原合成等效应。与之相反,肝纤维化的进展常常伴随有抑制性激活的Smad7表达水平低下,因而不能有效地抑制激活的Smad磷酸化,并阻止TGF-β1的刺激信号向下游传导,导致TGF-β1信号通路持续激活,最终发生肝纤维化、肝硬化甚至肝细胞癌[11]。
本实验采用经典方法复制胆汁性肝硬化模型。与假手术组比较,模型组大鼠血清中AST、ALT、ALP、T-Bil,D-Bil,GGT均显著升高,α-SMA、TIMP-1、ICAM-1蛋白的表达也明显升高,结合肝脏组织病理学改变,证实动物模型复制成功。本研究发现,化肝通络方各剂量组能明显降低胆汁性肝硬化模型大鼠血清中异常升高的肝功能指标和α-SMA、TIMP-1、ICAM-1蛋白的表达。与模型组比较,化肝通络方给药浓度与疗效呈正相关,其中以高剂量组最为显著,存在浓度依耐性,表现出明显的量效关系。与UDCA组比较,化肝通络方高剂量组血清指标差异无统计学意义,而中、低剂量组差异显著,说明化肝通络方高剂量组与阳性药UDCA疗效相近。同时病理组织学检查结果显示,化肝通络方高、中剂量组对模型大鼠肝纤维组织增生、肝组织炎性细胞活动有显著的改善作用,进一步证实化肝通络方具有明显的抗纤维化作用。肝组织免疫组化结果提示,模型组较假手术组TGF-β1、Smad3蛋白的阳性数目和灰度值、相对光密度表达增高,抑制性激活蛋白Smad7表达明显降低,化肝通络方及UDCA均可显著抑制模型大鼠TGF-β1、Smad3蛋白的表达,上调抑制性激活蛋白Smad7表达,说明化肝通络方具有治疗胆汁性肝硬化的作用,其作用机制可能与TGF-β/smad信号通路相关。
[1]Kyung-Ah Kim,Sook-Hyang Jeong.The diagnosis and treatment of primary biliary cirrhosis.Korean J Hepatology,2011,17(3):173
[2]CorpechotC,Poujol-RobertA,Wendum D,etal.Biochemical markers of liver fibrosis and lymphocytic piecemeal necrosis in UDCA-treatedpatientswithprimarybiliarycirrhosis.Liver International,2004,24(3):187
[3]Kuiper EM,Hansen BE,de Vries RA,et al.Improved prognosis ofpatientswithprimarybiliarycirrhosisthathavea biochemical response to ursodeoxycholic acid.Gastroenterology,2009,136(4):1281
[4]Weiler-Normann C,herkel J,Lohse AW.Mouse models of liver ifbrosis.ZGmstroentero1,2007,45(1):43
[5]蒋健,何淼.原发性胆汁性肝硬化的中医证候特点及疗效分析.上海中医药大学学报,2003,17(3):15
[6]李林,钟德珍,钟德雄,等.中西医结合诊治胆汁性肝硬化32例临床观察.北京中医杂志,2002,21(5):287
[7]FriedmanSL.Mechanismsofhepaticfibrogenesis.Gastroentero logy,2008,134:1655
[8]Carpino G,Morini S,et al.Alpha-SMA expression in hepatic stellate cells and quantitative analysis of hepatic fibrosis in cirrhosisandinrecurrentchronichepatitisafterliver transplantation.Dig Liver Dis,2005,37(5):349
[9]Stefanie Hemmann,Jürgen.Expression of MMPs and TIMPs in liver fibrosis-a systematic review with special emphasis on anti-fibrotic strategies.Journal of Hepatology,2007,46(5):955
[10]Wen YA,Liu D.Biliary intervention aggravates cholestatic liver injury,andinduceshepaticinflammation,proliferationand fibrogenesis in BDL mice.Exp Toxicol Pathol,2011,63(3):277
[11]Liu Y,Liu H,Meyer C,et al.Transforming growth factor-β (TGF-β)-mediated connective tissue growth factor(CTGF)expression in hepatic stellate cells requires Stat3 signaling activation.J Biol Chem,2013,288(42):30708
R575.205文献识别码A
1672-397X(2014)03-0073-03
宣佶(1982-),男,硕士研究生,主治医师,消化内科专业。
田耀洲,tianyaozhou1960@163.com
2013-12-31
编辑:吴宁

国家自然科学基金(81060255);“江苏省六大人才”高峰项目(2013-WS-048);江苏省科技厅技术基础设施建设计划项目(BM2008152)
