黄芪甲苷对内皮祖细胞生物学功能影响的实验研究
2014-04-18陈声荣吕作陪甘艳艳
陈声荣 吕作陪 甘艳艳
(洞头县人民医院,浙江洞头 325700)
黄芪甲苷对内皮祖细胞生物学功能影响的实验研究
陈声荣 吕作陪 甘艳艳
(洞头县人民医院,浙江洞头 325700)
目的:观察黄芪甲苷对内皮祖细胞(endothelial progenitor cells,EPCs)生物学功能的影响。方法:采用密度梯度离心法获取外周血单个核细胞培养内皮祖细胞,培养7d后,收集贴壁细胞并随机分为对照组及黄芪干预组(黄芪甲苷浓度分别为5、25和75μg/mL),各自干预24h后采用细胞计数试剂盒(Cell Counting Kit-8,CCK-8)、黏附能力测定试验、Matrigel体外成血管试验及Transwell小室法观察黄芪甲苷对EPCs增殖、黏附、成血管及迁移能力的影响。结果:与对照组比较,黄芪甲苷各剂量干预组内皮祖细胞增殖能力、黏附细胞数、血管数、迁移细胞数均明显增加。结论:黄芪甲苷可显著提高内皮祖细胞多种细胞生物学功能。
内皮祖细胞 黄芪甲苷 体外实验
内皮祖细胞因其独特的促血管新生及内膜修复作用近几年成为研究热点[1-3]。通过不同方法提高内皮祖细胞各种生物学功能有助于其发挥促血管新生及内膜修复作用,从而有益于动脉粥样硬化及缺血性血管疾病的防治。黄芪临床上用于治疗心脑血管疾病,但深入的机制研究尚待开展。本研究观察黄芪有效成分黄芪甲苷对内皮祖细胞生物学功能的影响,探讨黄芪治疗缺血性心脑血管病的可能机制。
1 材料与方法
1.1 材料细胞计数试剂盒(Cell Counting Kit-8,CCK-8)购自日本同仁化学研究所,基质凝胶matrigel购自美国Becton Dickson公司,Transwell小室购自美国Corning公司,胎牛血清、M199培养基、PBS液购自Gibco公司,人淋巴细胞分离液购自天津灏洋生物公司,黄芪甲苷购自上海融禾公司。
1.2 方法
1.2.1 内皮祖细胞(endothelial progenitor cells,EPCs)的培养
采用贴壁培养法培养内皮祖细胞[2]。取健康志愿者外周血20mL,密度梯度离心,将分离的单个核细胞接种于预包被纤维连接蛋白的六孔板中,每孔加入1mL M199培养基[含胎牛血清(10%)、VEGF(10ng/mL),bFGF(10ng/mL)],置37℃、5% CO2饱和湿度培养箱中培养。3d后更换培养液并清洗未贴壁细胞,以后每隔3d换半液。
1.2.2 鉴定将终浓度为2.4μg/mL的DiI-ac-LDL加入预装盖玻片的6孔板中,与细胞避光孵育1~2h,吸弃培养液,4%多聚甲醛固定15min,PBS冲洗,加入FITC-UEA-I lectin(10mg/L),继续避光孵育1h,取出盖玻片,PBS轻洗,加抗卒灭剂后置荧光显微镜下拍片。
1.2.3 分组培养7d后,以0.25%胰酶将各孔细胞消化制成细胞悬液,以同等数量细胞接种,随机分为对照组与黄芪甲苷各剂量组(黄芪甲苷浓度分别为5、25、75μg/mL),培养24h后,进行以下细胞生物学功能检测。
1.2.4 增殖能力检测用0.25%胰蛋白酶消化收集贴壁细胞,悬浮在500μL培养液中,计数,将等量EPC接种到包被纤维连接蛋白的96孔培养板,添加含10%CCK-8溶液的培养基,培养4h后,置酶标仪450nm处测OD值。
1.2.5 黏附能力检测收集培养细胞,悬浮在500μL培养液中,计数,然后将同等数目的EPC接种在包被纤维连接蛋白的培养板上,在37℃培养30min,PBS洗弃未贴壁细胞,计数贴壁细胞。
1.2.6 成血管能力检测4℃溶解Matrigel胶,取50μL/孔加入96孔板中(冰上操作),37℃孵育1h成胶待用。各组细胞按10000个/孔的细胞密度接种于铺被有Matrigel凝胶的96孔板中,每组设6个复孔,置于37℃、5%CO2饱和湿度培养箱中培养约24h。取出96孔板,置于倒置显微镜下观察、拍片,各组均随机选取5个视野(×100)计数小管形成数量。
1.2.7 迁移能力检测消化收集各组贴壁细胞,制成5×105/mL的单细胞悬液。于24孔板中放入transwell小室。下室加入600μL含10%FBS的培养基,上室加入100μL上述细胞悬液,置于37℃、5%CO2饱和湿度培养箱中孵育24h。取出transwell小室,D-Hank's液淋洗2次,用棉签擦去微孔膜上层的细胞,4%多聚甲醛固定10min,0.25%结晶紫染色,各组均随机选取5个视野(×400),计数EPCs的迁移数量。
1.2.8 统计学方法用SPSS16.0统计软件进行统计分析,计量资料以(±s)表示,组间资料比较采用方差分析,P<0.05为有显著性差异。
2 结果
2.1 EPCs的培养及鉴定培养细胞呈现典型的集落形态,单个六孔板中可见多个细胞集落(图1-A)。双荧光染色试验显示细胞摄取Dil-ac-LDL且结合FITC-UEA-1 lectin:融合图像显示胞膜结合lectin呈绿色荧光,而胞质的黄色荧光是吞噬ac-LDL后红色荧光与胞膜绿色荧光融合而成(图1-B)。

图1 EPCs的培养及鉴定
2.2 黄芪甲苷对EPCs增殖黏附、成血管能力的影响见表1、图2。与对照组比较,不同浓度黄芪甲苷干预24h后,呈浓度依赖性地提高EPCs的增殖黏附和成血管能力。
2.3 黄芪甲苷恢复EPCs受损的迁移能力与对照组比较,经过24h黄芪甲苷干预后,EPCs迁移能力呈浓度依赖性地提高。见图3及表1。
表1 黄芪甲苷对内皮祖细胞生物学功能的影响(±s)
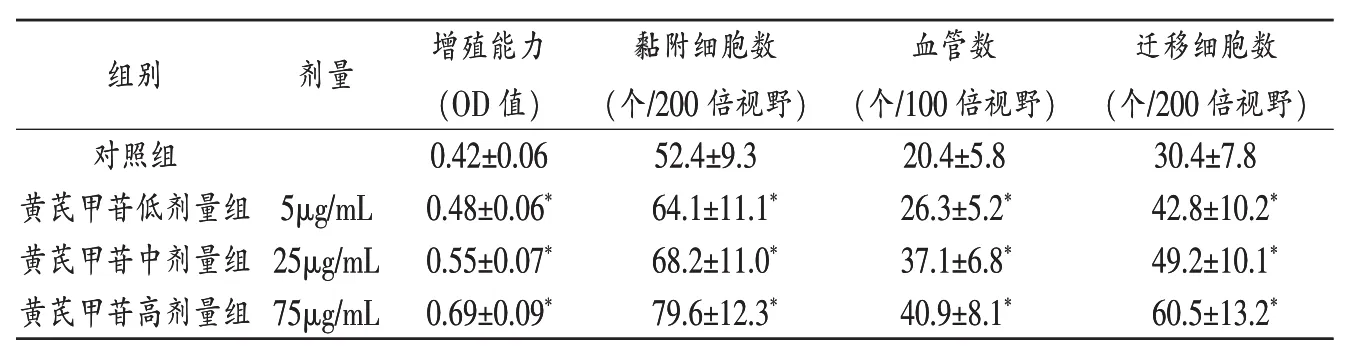
表1 黄芪甲苷对内皮祖细胞生物学功能的影响(±s)
注:与对照组比较,*P<0.01。
组组别别剂量增殖能力(OD值)剂量增殖能力(OD值)血管数(个/100倍视野)对照组粘附细胞数(个/200倍视野)0.42±0.06黏附细胞数(个/200倍视野)0.42±0.06迁移细胞数(个/200倍视野)52.4±9.3迁移细胞数(个/200倍视野)52.4±9.3血管数(个/100倍视野)对照组20.4±5.830.4±7.8 20.4±5.830.4±7.8黄芪甲苷低剂量组64.1±11.1*26.3±5.2*42.8±10.2*5μg/mL0.48±0.06*黄芪甲苷中剂量组25μg/mL0.55±0.07*68.2±11.0*37.1±6.8*49.2±10.1*黄芪甲苷高剂量组75μg/mL0.69±0.09*79.6±12.3*40.9±8.1*60.5±13.2*黄芪甲苷低剂量组64.1±11.1*26.3±5.2*42.8±10.2*5μg/mL0.48±0.06*黄芪甲苷中剂量组25μg/mL0.55±0.07*68.2±11.0*37.1±6.8*49.2±10.1*黄芪甲苷高剂量组75μg/mL0.69±0.09*79.6±12.3*40.9±8.1*60.5±13.2*

图2 黄芪甲苷对EPCs成血管能力的影响
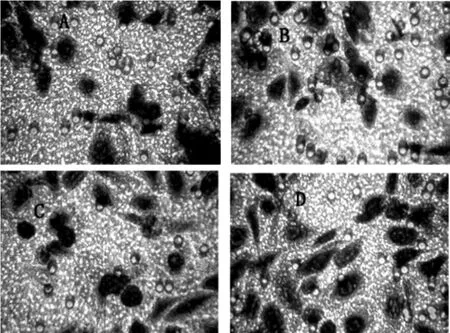
图3 黄芪甲苷对EPCs迁移能力的影响
3 讨论
自1997年Arasaha发现循环中存在能促进血管新生的的内皮祖细胞以来[1],有关EPCs的研究不断深入。EPCs具有血管新生及内膜修复两大功效[2-3],能响应局部损伤与缺血,定向归巢修复血管促进血管新生。大量研究表明,EPCs是心血管疾病的一个生物标志物,循环中EPCs数量及功能与心血管危险相关,其数量及功能受损可导致血管内皮修复功能下降,血管新生能力减弱,并加速心血管事件的进程[4-6]。而通过不同方法提高循环EPCs数量及生物学功能将有助于心脑血管疾病的防治。因此EPCs正在成为缺血性心血管疾病的干预新靶点。
黄芪为临床常用中药,性温,味甘,具有补气固表、敛疮生肌等功效。黄芪中的主要活性成分为黄芪多糖、黄芪皂苷及黄芪异黄酮,而黄芪皂苷中的黄芪甲苷有保护血管内皮、抗衰老、抗氧化等作用[7-8]。本实验以不同浓度黄芪甲苷干预EPCs,观察其对EPCs增殖、黏附、成血管及迁移能力的影响,结果发现黄芪甲苷呈浓度依赖性提高EPCs的多种细胞生物学功能,提示黄芪甲苷可能通过提高循环EPCs的数量,增强EPCs的血管新生能力,提高EPCs迁移至损伤内皮并黏附修复的能力以发挥其临床功效,这为临床应用黄芪治疗缺血性心脑血管疾病提供了新依据。
[1]Arasaha T,masuda H,Takahashi T,et al.Isolation of putative progenitor endothelial cells for angiogenesis.Science,1997,275:964
[2]WernerN,JunkS,LaufsU,etal.Intravenous Transfusion of Endothelial Progenitor Cells Reduces Neointima Formation After Vascular Injury.Ciculation Reserch,2003,93(2):e17
[3]GrieseDP,EhsanA,MeloLG,etal.Isolationand Transplantationof Autologous Circulating Endothelial CellsInto Denuded Vessels and Prosthetic Grafts:Implications for Cell-Based Vascular Therapy.Circulation,2003,108(21):2710
[4]Shantsila E,Watson T,Lip GY.Endothelial progenitor cells in cardiovascular disorders.J Am Coll Cardiol,2007,49(7):741
[5]WernerN,KosiolS,SchieglT,etal.Circulatingendothelial progenitor cells and cardiovascular outcomes.N Engl J Med,2005,353(10):999
[6]Fritzenwanger M,Lorenz F,Jung C,et al.Differential number of CD34+,CD133+and CD34+/CD133+cells in peripheral blood of patientswithcongestiveheartfailure.EurJMedRes,2009,14(3):113
[7]LiHB,GeYK,ZhangL,etal.Astragaloside I V improved barrier dysfunction induced by acute high glucose in human umbilical vein endothelia l cells.Life Sci,2006,79(12):1186
[8]高卫真,康毅,娄建石,等.黄芪苷对心肌细胞氧化损伤的保护作用.中国心血管杂志,2005,10(3):166
编辑:吴宁
R282.710.5文献识别码A
1672-397X(2014)03-0076-02
陈声荣(1973-),男,本科学历,主治医师,中西医结合临床专业。csr654@163.com
2013-10-29
