2010年夏、秋季胶州湾浮游动物对表层海水中DMS分布的影响*
2014-04-17杨桂朋
董 园,于 娟,杨桂朋
(中国海洋大学化学化工学院,山东 青岛266100)
二甲基硫(CH3SCH3,dimethysulfide,DMS)是海水中重要的挥发性硫化物[1]。自1987年Charlson等人[2]在Nature上提出的CLAW假说指出DMS的释放对全球气候变化有“负反馈”作用以来,DMS因其对环境变化和酸雨产生的重要影响而引起了国内外的广泛关注[3-4]。海洋中DMS的前体β-二甲基巯基丙酸内盐(DMSP)主要由浮游植物产生,是海洋食物链中重要的碳源和硫源[5-6]。虽然DMSP在全球气候中的重要性已经得到了很好的印证,但是DMSP的产生机制及DMSP转化为DMS的机理还不是很清楚。
浮游动物在海洋生态系统中具有重要作用,作为海洋食物链的中间环节,浮游动物直接决定海洋大型动物和浮游植物的种类及生物量的变化。浮游动物与DMSP之间动力学的研究早在1980年代就已经引起学者的关注[2],Dacey和 Wakeham[7]发现浮游动物的摄食行为极大地促进了海水中DMS的释放。Tang等[8]研究发现,即使浮游动物在肠道排空几小时后,体内依然可以检测到DMSP的存在,说明浮游动物可以将DMSP同化吸收储存在组织细胞中,是海水DMSP的源。Wolfe[9]研究表明,北太平洋海域的桡足类体内DMSP含量占总DMSP含量的10%。浮游动物对DMSP的生物降解和转化影响错综复杂,捕食者可以通过多种途径影响颗粒态DMSP(DMSPp)的释放及溶解态DMSP(DMSPd)的转化。Leck等[10]通过现场观测发现DMS浓度与浮游动物丰度呈显著正相关[11],而地中海海域的现场调查[12]和围隔实验[13]研究发现DMS和浮游动物丰度并没有显著相关性。国外针对浮游动物对DMS释放影响的研究较多[7-8],但主要是基于开放型海域及实验室培养,浮游动物对DMS释放的作用机制尚不明确,而国内关于浮游动物与DMS释放之间的关系研究尚未见报道。
胶州湾属于青岛近岸海域(35°55′N~36°18′N,120°04′E~120°23′E),是山东半岛重要的经济港口和养殖基地。刘光兴和张志南[14]及孙军等[15]对胶州湾浮游动物种类、分布及摄食进行了相关研究,结果表明浮游动物生物量具有显著的季节变化,平面分布不均匀。由于浮游植物细胞大小和优势种摄食习性的不同造成了胶州湾湾内、湾外和湾口浮游动物摄食压力的不同。张洪海和杨桂朋[16]对胶州湾DMS的研究发现,DMS分布呈现由湾内到湾外递减的趋势,陆源物质的输入又使其浓度升高。本文于2010年7~11月在胶州湾进行系统采样分析,通过研究胶州湾夏、秋季浮游动物丰度、分布与环境因子(水深、温度、盐度、叶绿素a)的相关性及其对DMS、DMSP分布的影响,以期为胶州湾生源硫的生物地球化学循环提供基础资料,并且可以为明确浮游动物在海洋硫循环中的重要作用提供帮助。
1 材料与方法
1.1 样品采集
2010年7月20日、8月21日、9月20日、10月19日和11月22日随“青钓275号”在胶州湾海域采集表层海水样品,航次共设8个站位(见图1)。用塑料水桶采集表层海水,读取温度计现场测定海水温度,水深由船用测深仪测定获得。水样盛于经海水润洗过的玻璃瓶中,溢流后加盖,并贮于装有冰袋的塑料保温箱中,带回实验室当天使用SYA2-2型盐度计进行盐度的分析。

图1 胶州湾调查区域和站位分布图Fig.1 Location of sampling stations in the Jiaozhou Bay
1.2 浮游动物采集
浮游动物采集按照《海洋调查规范》(GB12763.6-91)进行,用浅水Ⅰ型浮游生物网自底层到表层垂直拖网,采集的样品用5%的甲醛溶液固定、避光储存,带回实验室分析鉴定。浮游动物采用实验室内江南JS25型体视显微镜镜检计数。在浮游动物采集后2个月内完成样品的鉴定及计数。
1.3 DMS/DMSP、叶绿素a、细菌的测定方法
DMS的测定 现场取表层海水于40mL棕色样品瓶中,样品瓶用内衬聚四氟乙烯垫片的塑料盖密封,确保无顶空。放入塑料保温箱中避光保存,所有DMS样品带回实验室后立即进行分析测定。采用吹扫捕集-冷阱富集前处理技术,将一定体积的海水样品用玻璃注射器注入气提室,在高纯氮气下将海水中的DMS吹出,经干燥后,被液氮作为冷凝剂吸附浓缩后,再经过沸水浴加热解析。解析出来的气体被载气携带进入气相色谱仪(GC-14B,日本岛津),最后用火焰光度检测器(FPD)进行检测。DMSP的测定 采用DMSP在强碱环境(pH≥13)中完全裂解为DMS的原理[17]进行间接分析测定,具体操作见张洪海和杨桂朋[16]。主要步骤为:现场取一定量的表层海水,用 Whatman GF/F滤膜重力过滤[18],滤液转移至已事先加入2mL 10mol·L-1KOH溶液的棕色玻璃瓶中,避免顶空,此为DMSPd样品。DMSPp样品按照同样的方法将滤膜加入玻璃瓶中,加蒸馏水除顶空,密闭保存至少24h后测定其中的DMS含量。DMSPd含量为样品瓶中实测的DMS减去海水中原有的DMS浓度。所有DMSP样品带回实验室后在4℃避光保存,样品1个月内测定完毕。
叶绿素a(Chl-a)的测定 采用荧光分光光度法,取定量海水样品经0.70μm Whatman GF/F玻璃纤维滤膜过滤后包裹锡纸于冰箱内冷冻保存。样品测定须在采样后2个月内完成。分析时将滤膜以90%(V/V)丙酮水溶液在暗处萃取24h,上清液以F-4500荧光仪(日本日立)采用荧光分光光度法进行测定[19]。
细菌的测定 海水中细菌总数用DMLA型全自动荧光显微镜(Leica)采取4,6-联脒-2-苯基吲哚(DAPI)染色直接计数法[20]镜检计数。
1.4 浮游动物的分析方法
浮游动物各种类的丰度以单位水体体积的浮游动物个数(ind/m3)表示。
浮游动物的优势种根据孙儒永[21]的方法由各个种的优势度值(Y)来确定,优势度值(Y)按照计算公式Y=(ni/N)×fi进行计算。
上式中:n为第i种的丰度;fi是该种在各站位中出现的频率;N为浮游动物总丰度。取优势度Y≥0.02的浮游动物种类为优势种。
1.5 数据分析的方法
采用Surfer 8.0软件绘制浮游动物丰度平面分布图。浮游动物丰度与环境因子(水深、温度、盐度、Chl-a)、细菌生物量、DMS、DMSPd、DMSPp间的关系采用Origin 8.0软件进行分析,用Pearson相关性系数(R)表示。
2 结果与讨论
2.1 胶州湾的环境因子
采样站位的环境因子及细菌生物量如表1所示。
在调查期间,胶州湾表层温度和盐度月际变化趋势相反(见图2)。温度在8月份达到最大值25.2℃,而后逐渐降低,在11月份达到最低值12.2℃。盐度在8月份有最低值为29.8,逐渐升高至11月份的31.4。
2.2 胶州湾浮游动物丰度的平面分布
7、10和11 月胶州湾的浮游动物丰度水平分布基本一致,均为湾口E3站最高,由湾口及邻近站位
到湾内西部海域到湾内东部沿岸海域递减(见图3),10月胶州湾东北部A2站位浮游动物丰度最低(1.492 ind/m3)。7月湾口E3站位浮游动物丰度最大(475 ind/m3),东部沿岸海域B5站位浮游动物丰度最低(4.85ind/m3)。8月浮游动物丰度自湾内西部沿岸海域到东部递减,湾口最低,8月湾内西部沿岸海域出现调查期间浮游动物丰度的最大值(656.1ind/m3),9月湾内北部沿岸海域丰度最大,湾口次之,东部和西部沿岸海域最低。由图4可以看出,5个月中浮游动物的月平均丰度范围为55.5~214.1ind/m3,平均值为144.4 ind/m3,在各个站位呈现不均匀分布的现象,以湾口(E3站)最高,湾内东部沿岸海域(B5站)最低。胶州湾内东部海域(B5、C5、D4站)浮游动物平均丰度普遍偏
低,均低于100ind/m3。
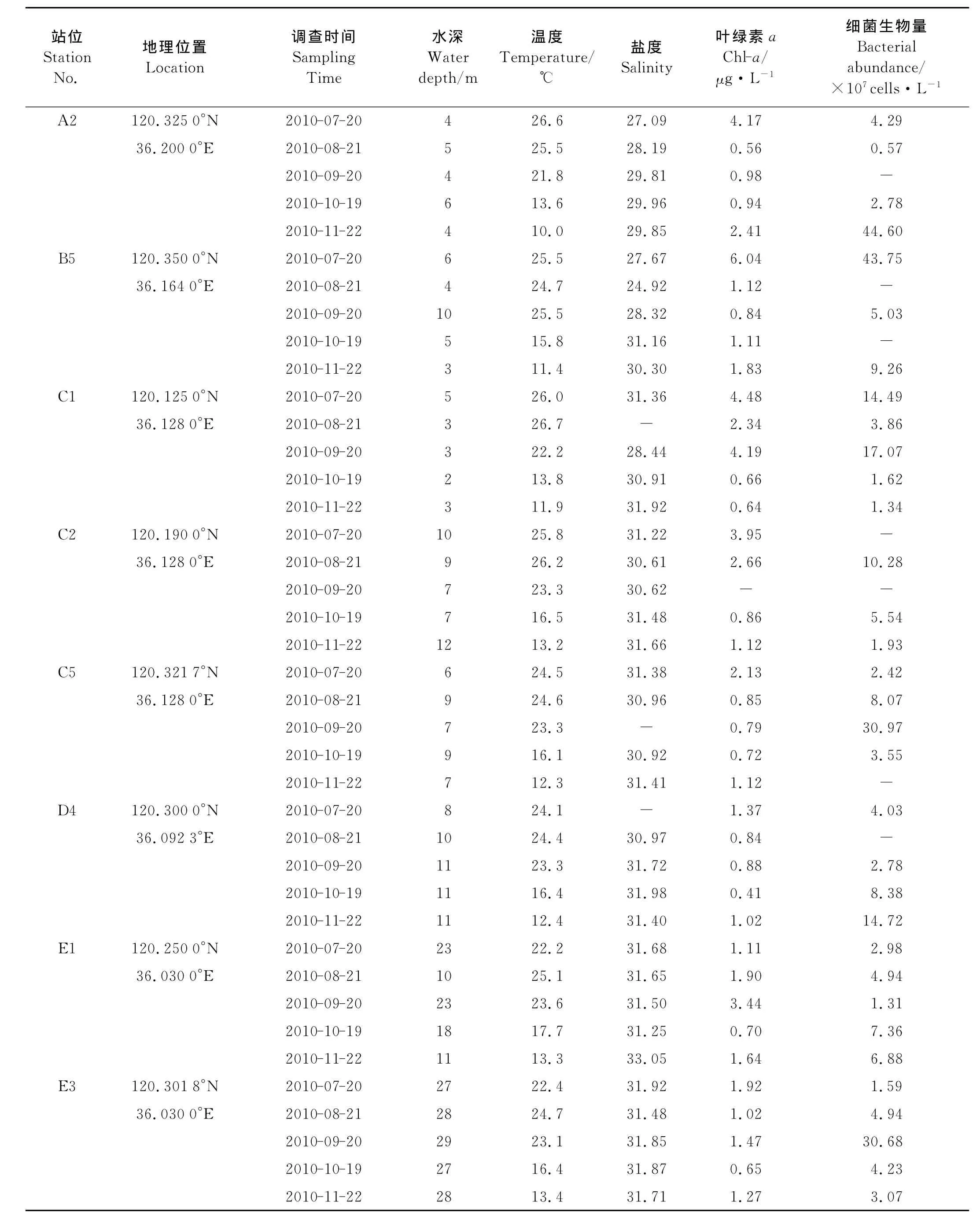
表1 采样站描述及其细菌生物量Table 1 Description of sampling stations,and their bacterial abundances
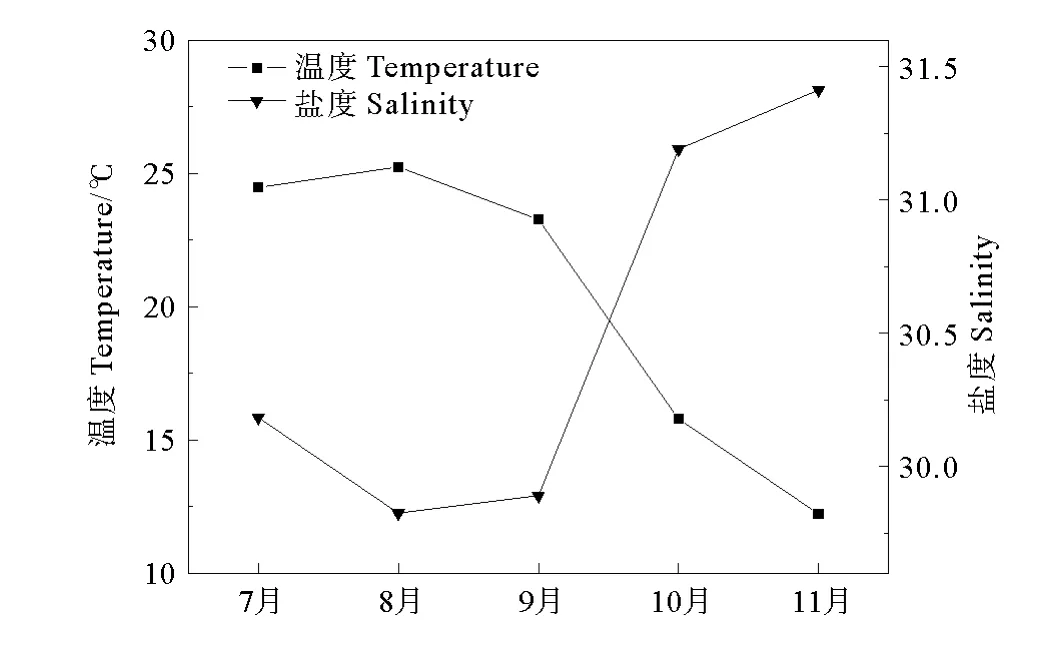
图2 2010年7~11月胶州湾表层海水的平均温度和平均盐度Fig.2 Average temperature and salinity of surface seawater in the Jiaozhou Bay from July to November,2010
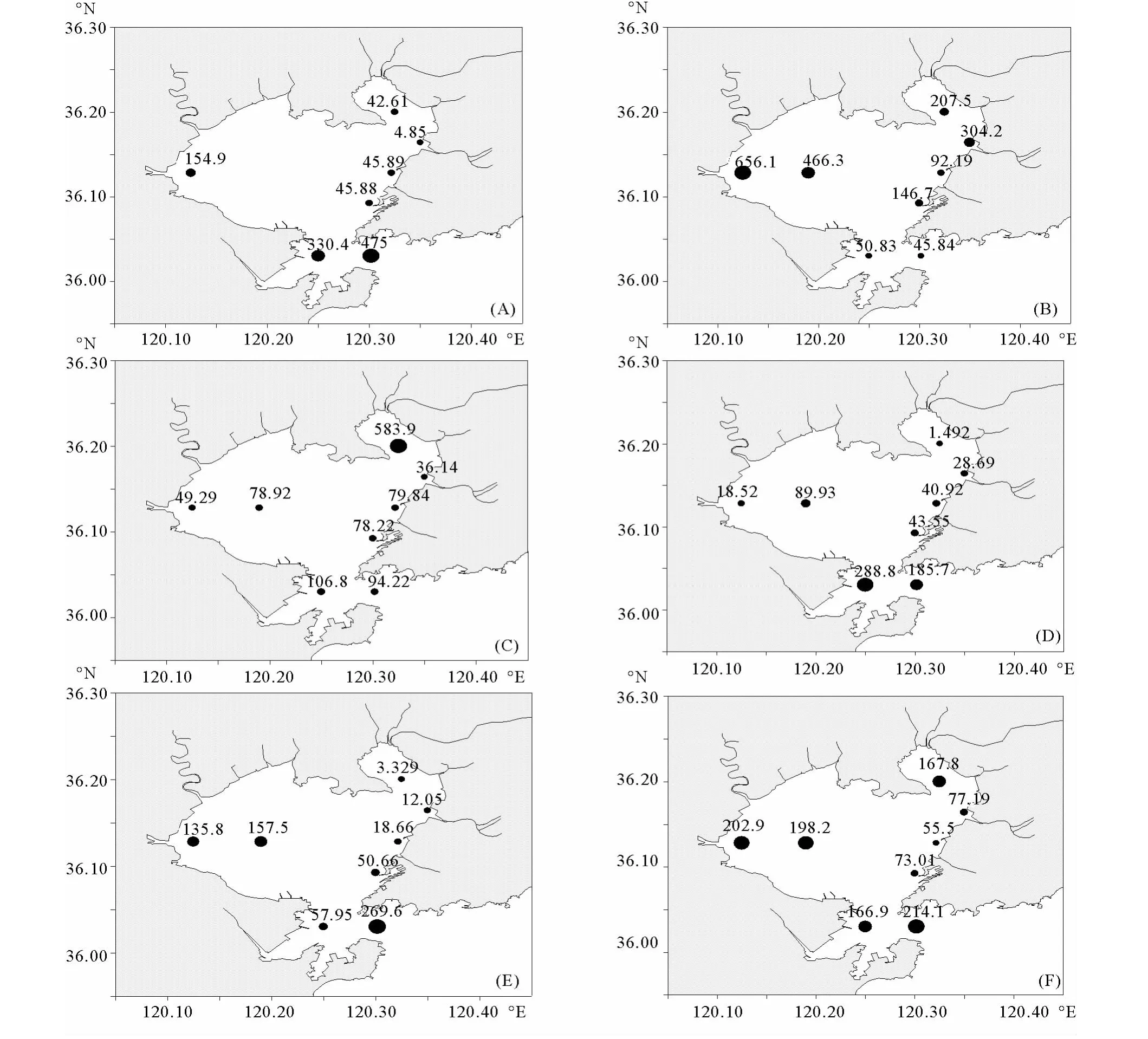
图3 2010年7月(A)、8月(B)、9月(C)、10月(D)、11月(E)胶州湾浮游动物丰度水平分布(ind/m3)和2010年7~11月各站位浮游动物平均丰度(F)的平面分布(ind/m3)Fig.3 Horizontal distribution of zooplankton abundance in the Jiaozhou Bay in July(A),August(B),September(C),October(D),November(E)of 2010(ind/m3)and horizontal distribution of zooplankton average abundance(F)of all sampling stations from July to November 2010(ind/m3)
2.3 胶州湾浮游动物丰度的月际变化
胶州湾浮游动物丰度具有明显的季节变化(见图4)。在调查期间,浮游动物7~11月平均丰度的变化范围为87.2~246.2ind/m3,最大丰度出现在夏季8月(246.2ind/m3),最低值出现在秋季的10月(87.2 ind/m3)。
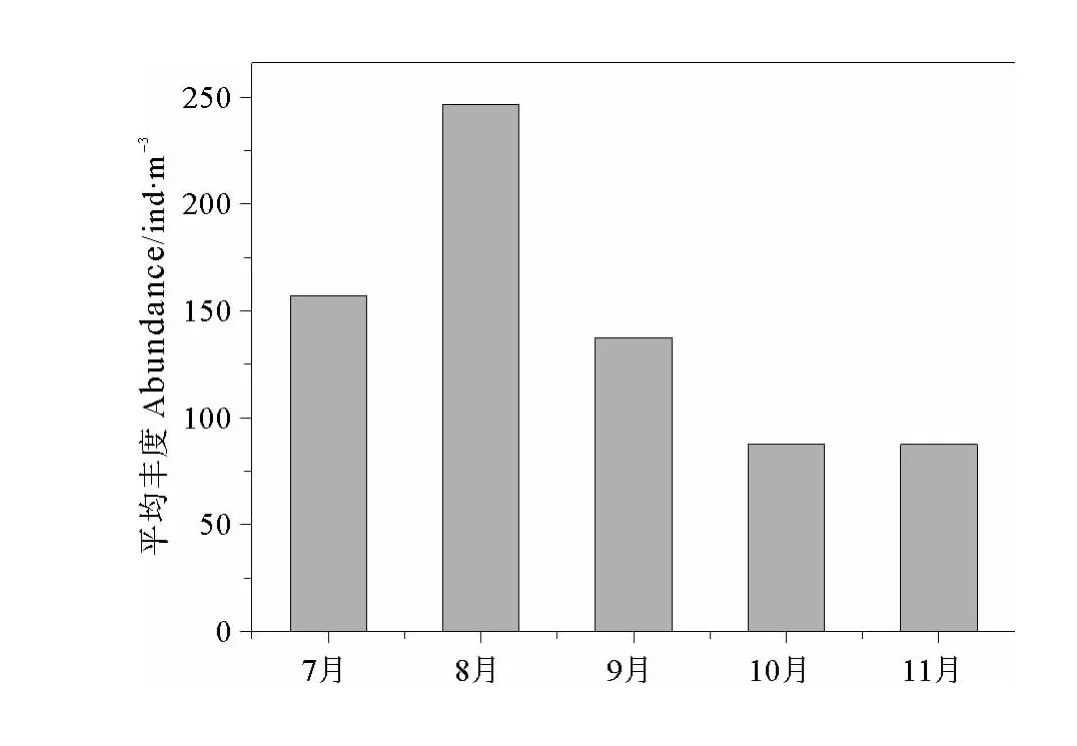
图4 胶州湾浮游动物丰度的月际变化Fig.4 Monthly variation of zooplankton abundance in the Jiaozhou Bay
本次调查中,胶州湾浮游动物分布与黄凤鹏等[22]2003年1~12月对胶州湾浮游动物时空分布的研究结果一致。这可能是由于不同月份水体的环境因子状况不同导致的。随着各环境因子的改变,浮游动物优势种随之演替,主要种群密度发生季节变化,这些优势种的季节性变化左右着水体中浮游动物丰度的改变。其次,绝大多数无脊椎和游泳生物都具有明显的季节性变化,周期性浮游动物幼体和成体的出现对浮游动物丰度的影响较大。
2.4 胶州湾浮游动物优势种
胶州湾浮游动物优势种种类及其优势度见表2。在调查期间,胶州湾浮游动物优势种共11种,分别为短尾类溞状幼虫、鸟喙尖头溞、长尾类幼体、强壮箭虫、双刺唇角水蚤、背针胸刺水蚤、太平洋纺锤水蚤、五角水母、球型侧腕水母、夜光虫、中华哲水蚤。强壮箭虫在7~11月均为优势种,8月强壮箭虫优势度达到最大值(0.642)。每月均有2~5种优势种,并有明显的季节变化。除强壮箭虫外,短尾类溞状幼虫和长尾类幼体为夏季的优势种,太平洋纺锤水蚤和夜光虫是秋季的优势种。10月夜光虫优势度达到0.667。
2.5 浮游动物分布与环境因子的关系
将2010年7~11月5个航次的浮游动物丰度分别与其相关的环境因子作相关性分析,结果见表3。浮游动物丰度与水深有一定的相关性,在7、10、11月呈显著正相关(P<0.05),8月及9月浮游动物丰度与水深相关性不显著(P>0.05)。浮游动物丰度与温度在7月呈显著负相关(P<0.05),在8、10月显著正相关(P<0.05),9和11月无显著相关性(P>0.05)。各个月的浮游动物丰度与盐度均没有显著相关性(P>0.05)。浮游动物丰度与Chl-a含量呈负相关(8月除外)(P>0.05)。各个月的浮游动物丰度与细菌含量均没有显著相关性(P>0.05)。
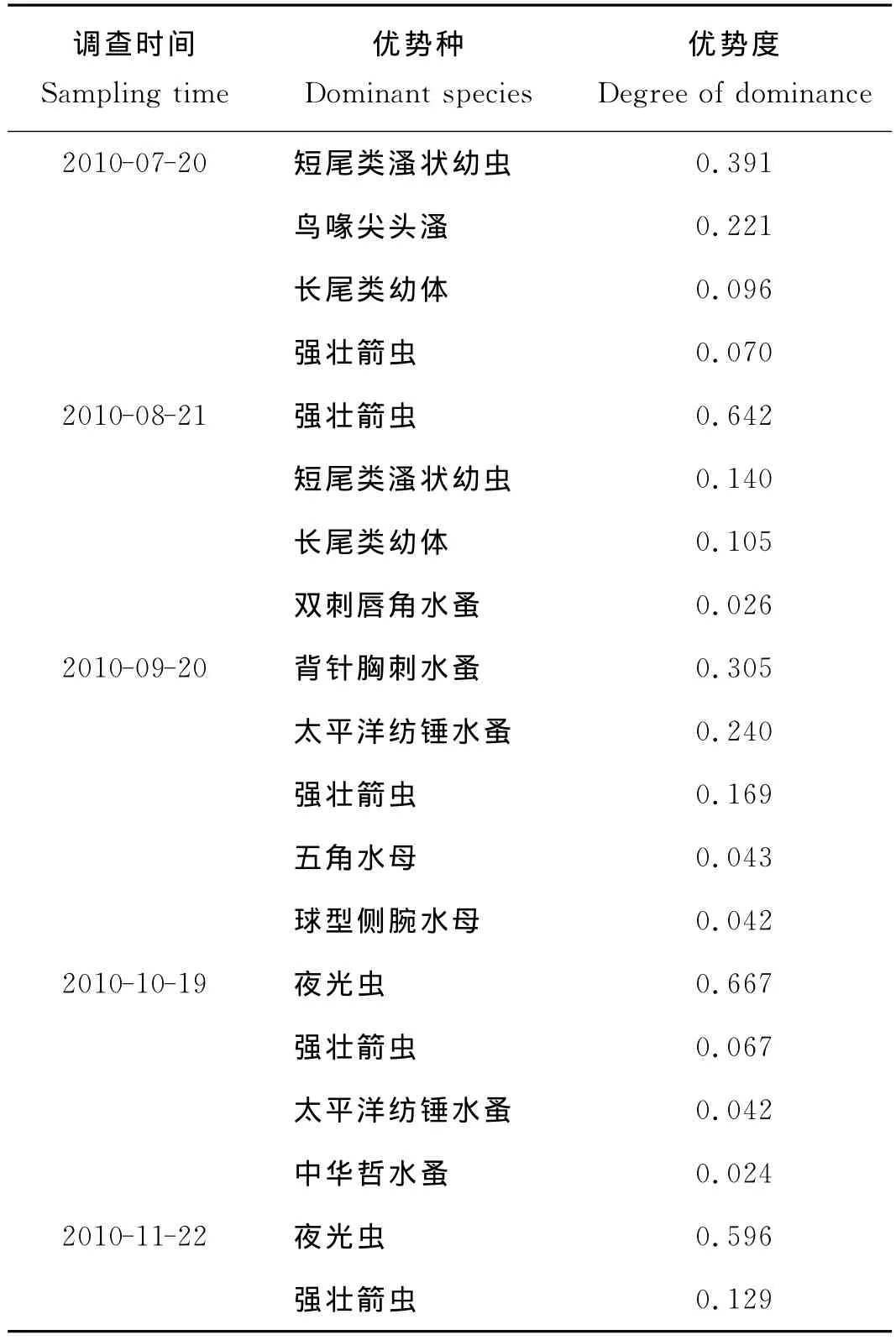
表2 2010年7~11月胶州湾浮游动物优势种及优势度Table 2 Dominant species and their degree of dominance of zooplankton in the Jiaozhao Bay from July to November of 2010
浮游动物的种群结构与环境因子密切相关[23],陈洪举和刘光兴[24]对2006年夏季长江口及其邻近海域浮游动物群落结构的研究发现,与长江口浮游动物群落结构相关性最好的非生物因子是底层盐度。徐兆礼[25]对长江口临近海域的浮游动物种类组成研究也同样表明,盐度是影响浮游动物群落特征的最重要的环境因子。但在本调查期间,发现盐度与浮游动物丰度均没有显著相关性,因此盐度不是影响胶州湾夏、秋季浮游动物丰度的主要因素。这可能是由于所研究的海域不同的原因。
浮游动物作为浮游植物的主要摄食者,其种类组成与群落结构对与其相关的浮游植物有重要的作用。章菁等[26]研究表明,浮游动物总量与叶绿素a含量存在明显的负相关,认为浮游动物通过摄食活动制约浮游植物的生长及种群组成。在调查的航次中,发现除8月份以外,7、9、10、11月的浮游动物丰度与 Chl-a含量均呈负相关,但相关性并不显著(P>0.05)。这可能是由于各月份浮游动物优势种不同,对水体中浮游植物的摄食压力随之改变,当不被优势种优先摄食时,其他种类的浮游植物丰度会有所增加[27],另一方面可能是由于微型浮游动物及幼体也是大型浮游动物及桡足类的饵料,从而在一定程度上削弱了浮游动物对浮游植物的直接摄食压力,从而导致了水体中Chl-a含量不直接受到浮游动物丰度的影响。

表3 胶州湾2010年7~11月浮游动物丰度与环境因子相关性分析Table 3 The Pearson correlations between zooplankton abundance and environmental factors in the Jiaozhou Bay from July to November 2010
浮游动物身体表面、甲壳纲动物类的壳质骨骼等为细菌提供了丰富的有机物,有利于细菌的富集。浮游动物通过新陈代谢作用排出的粪便颗粒在下沉过程中可以被腐食者分解,为细菌提供营养物质[28-29]。附着在浮游动物或固体颗粒物上的细菌数量、种类组成比自由生长的细菌更复杂[30]。而当细菌附着在大的浮游生物(>200μm)时,与附着在小型浮游生物时其种群数量不同[31]。调查发现细菌与浮游动物丰度没有显著相关性,表明胶州湾海域自由细菌与浮游动物丰度之间相对独立的关系。在开放的大洋中,由于水体中含有极少的颗粒物,自由细菌在总细菌群落中占主导地位[32],但是在湖水、河口、沿海地带等生态系统中,陆源有机颗粒物的输入,浮游植物、浮游动物及其粪便颗粒等密度的增大,使非自由生存细菌的比重大大增加[33],从而削弱了自由细菌的权重。
2.6 浮游动物丰度与DMS、DMSPd、DMSPp的相关性分析
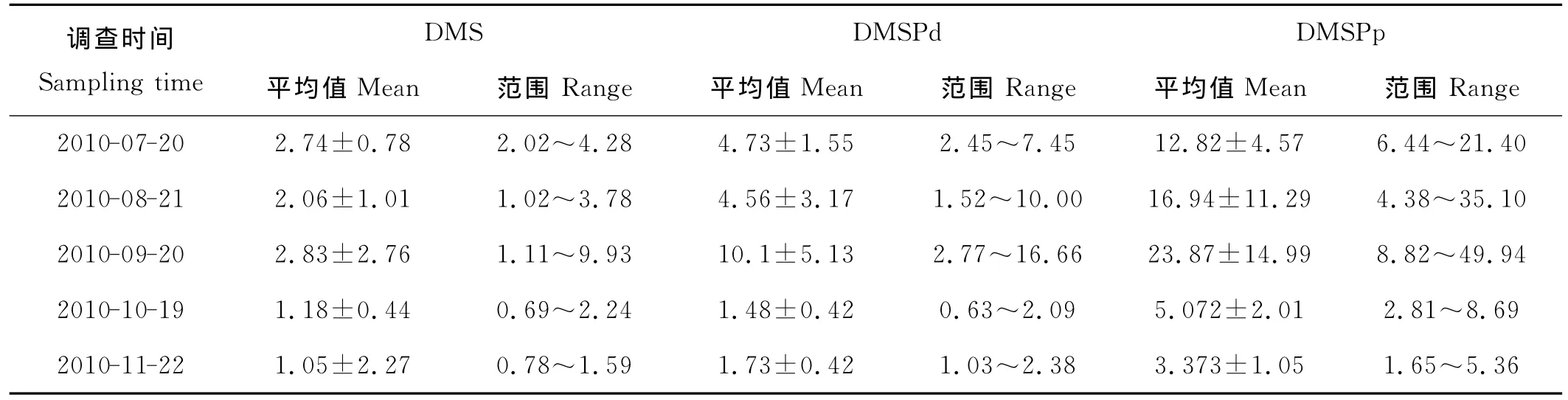
表4 胶州湾2010年7~11月DMS、DMSPd、DMSPp浓度Table 4 The concentrations of DMS,DMSPd,DMSPp in the Jiaozhou Bay from July to November 2010 /nmol·L-1
调查期间,各月份DMS、DMSPd、DMSPp的平均浓度、标准偏差及浓度范围如表4所示。调查区域内,DMS及DMSP均呈现空间分布不均匀,DMSP浓度高于DMS。夏季DMS、DMSPd及DMSPp的浓度分别为2.40、4.64和14.88nmol·L-1,秋季 DMS、DMSPd及DMSPp的浓度分别为1.71、4.44和10.77nmol·L-1,夏季浓度高于秋季。DMS及DMSP均低于2005年景伟文等[34]报道的胶州湾海水中二者的浓度,这可能是由采样站点的不同引起的,胶州湾海域浮游植物初级生产力平面分布不均匀[14-15],浮游植物群落块状分布引起各站位之间DMS、DMSP含量的差别。
浮游动物丰度与DMS、DMSPd、DMSPp的相关性分析结果表明,只有在2010年10月浮游动物丰度与DMS呈显著正相关(P<0.05),而11月浮游动物丰度与DMSPp呈显著正相关(P<0.05)(见表5)。其他月份的浮游动物丰度与DMS、DMSPd、DMSPp均没有明显的相关性。
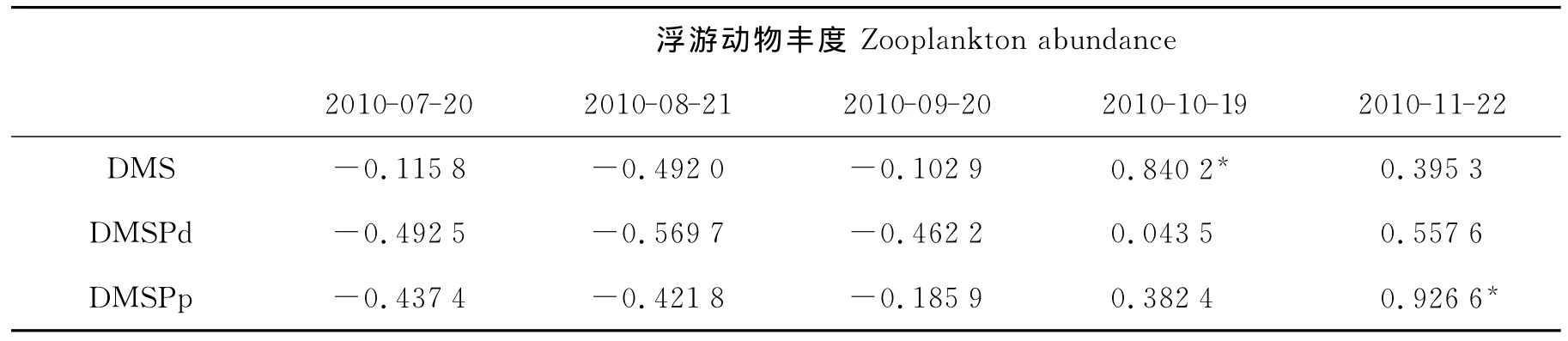
表5 胶州湾2010年7~11月浮游动物丰度与DMS、DMSPd、DMSPp的相关性分析Table 5 The Pearson correlations between DMS,DMSPd,DMSPp and zooplankton abundance in the Jiaozhou Bay from July to November 2010
早在1986年,Dacey和 Wakeham[7]实验室研究发现,浮游动物的出现大大增加了水体中DMS的含量。在摄食过程中摄食者通过“sloppy feeding”(摄食活动使完整的细胞机械分裂,促进细胞内有机物质释放出来)破坏含有DMSP的浮游植物细胞,促使浮游植物中的DMSPp释放到水体中。Wolfe等[11]研究认为,摄食活动可以使被捕食者的酶活性增强,从而提高DMSP到DMS的转化速率。调查期间,浮游动物丰度与10月的DMS浓度、11月的DMSPp浓度呈现显著正相关(P<0.05),说明浮游动物生物量对胶州湾海域DMSP的释放及转化有一定的促进作用。这与国外一些现场调查研究的结果相符。Belviso等[35]发现浮游动物丰度与DMS浓度之间存在明显的相关性,Leck等[10]对波罗的海的现场调查发现,DMS浓度直接受生物活动的影响,DMS浓度与桡足类和总浮游动物生物量显著正相关,说明在该海区浮游动物对浮游植物的摄食作用是促进DMSP释放到水体中并产生DMS的重要因素。在本实验中,7、8、9月的浮游动物丰度与DMS、DMSPd、DMSPp的相关性均不显著(P>0.05),造成这一现象的原因可能是由于在胶州湾浮游植物优势种为硅藻[36],硅藻属于 DMSP 的低产种[37],因此造成了摄食作用与DMSP释放的差异性。不同粒径的颗粒物对DMSP贡献不同,DMSP主要富集在小于10μm的有机颗粒物中[12],而这部分浮游植物难于被浮游动物直接摄食利用,使得在胶州湾海域浮游动物摄食对DMS的影响不明显。Cantin等[38]在加拿大的圣劳伦斯湾的研究表明,DMSP及DMS的浓度分布与浮游动物丰度没有相关性,暗示了摄食作用对DMSP和DMS产生的影响随时间和空间而不尽相同。
浮游动物是连接海洋初级生产力和高等动物的桥梁,浮游动物对水体DMSP的释放及转化的影响是错综复杂的。Wolfe等[39]对Oxyrrhismarina摄食颗石藻的研究发现,摄食活动中产生的DMSP并没有完全转化为DMS,而是被捕食者储存在细胞组织中,或者大部分被消化利用。Kwint等[40]的研究表明,在桡足类的肠道内DMSP含量较高,说明DMSP可以储存在浮游动物肠道内,被肠道内细菌分解利用。摄入到动物体内的DMSP被重新包装,以粪便颗粒的形式代谢出动物体外,将表层DMSP输送到底层海水中去,这些悬浮颗粒中的DMSP在沉降过程中大部分被生物降解,减少了DMS的产生,从而在一定程度上削弱了浮游动物丰度与DMSP/DMS的相关性。DMSPp由浮游植物细胞内释放再转化为DMS的过程受多种因素[41]的控制。DMSP一经释放可以通过多种途径如DMSP裂解酶催化裂解[42]、病毒感染、细菌降解、去甲基化降解产生DMS。DMS在水体中生物周转时间短,可通过微生物降解、光化学氧化、海-气扩散等途径迅速降解。
浮游动物摄食被认为是海水中DMS产生的一种重要机制,而摄食作用影响DMS浓度的机制又是错综复杂的。迄今为止,浮游动物与DMS的相关性研究大多集中在实验室培养[7]或者中型围隔实验[35],对于现场浮游动物丰度与DMS相关性的研究大多集中于大型开放海域,对于近海区域研究较少。基于浮游动物的垂直迁移在水体中产生的影响,加大了将实验室结果外推至现场环境的难度。因此,进一步在现场条件下了解浮游动物的分布特性及其对DMS的影响,对了解DMS在水体中的分布及转化具有重要的作用。
3 结论
(1)在2010年7~11月期间,胶州湾浮游动物丰度各月份平面分布不均匀,7月、10月、11月平面分布特征基本一致,呈现湾口最大、湾内西部海域次之、湾内东部海域最低的特征。夏季浮游动物丰度高于秋季。夏季和秋季浮游动物优势种季节变化明显。
(2)胶州湾浮游动物群落结构复杂,与浮游植物和微生物之间相互作用错综复杂,2010年7~11月的浮游动物丰度与盐度、Chl-a含量、细菌生物量没有明显的相关性。
(3)胶州湾优势种季节变化明显,其中强壮箭虫在每个调查航次均有出现,每个月份优势种为4~5种,夏季以短尾类溞状幼虫和长尾类幼体为胶州湾的优势种,而秋季,太平洋纺锤水蚤和夜光虫成为优势种。
(4)2010年10月和11月浮游动物丰度分别与DMS含量、DMSPp含量呈显著正相关(P<0.05)。浮游动物摄食对DMS释放有一定的促进作用,但是由于摄食作用对DMSP释放及转化的过程受多种生物因素的控制,使得在其它月份(7、8、9月)胶州湾浮游动物丰度与DMS、DMSPd、DMSPp等相关性不显著,表明浮游动物摄食活动对DMS生物地球化学循环影响复杂,其具体机制还需进一步研究。
致谢:本文浮游动物的鉴定及计数由中国海洋大学海洋环境与生态教育部重点实验室陈洪举老师协助完成,所用温度、盐度、Chl-a及细菌等数据均由本实验室相关人员协助分析检测,DMS相关数据由杨剑同学提供,在此一并表示感谢。
[1]Andreae M O.Ocean-atmosphere interactions in the global biogeochemical sulfur cycle[J].Marine Chemistry,1990,30:1-29.
[2]Charlson R J,Lovelock J E,Andreae M O,et al.Oceanic phytoplankton,atmospheric sulfur,cloud albedo and climate[J].Nature,1987,326:655-661.
[3]Kiene R P,Kieber D J,Slezak D,et al.Distribution and cycling of dimethylsulfide,dimethylsulfoniopropionate,and dimethylsulfoxide during spring and early summer in the Southern Ocean south of New Zealand [J].Aquatic Sciences-Research Across Boundaries,2007,69(3):305-319.
[4]Yang G P,Zhang H H,Su L P,et al.Biogenic emission of dimethylsulfide(DMS)from the North Yellow Sea,China and its contribution to sulfate in aerosol during summer[J].Atmospheric Environment,2009,43(13):2196-2203.
[5]Sim R.Production of atmospheric sulfur by oceanic plankton:biogeochemical,ecological and evolutionary links[J].Trends in Ecology &Evolution,2001,16(6):287-294.
[6]Matrai P A,Keller M D.Total organic sulfur and dimethylsulfoniopropionate in marine phytoplankton:intracellular variations[J].Marine Biology,1994,119:61-68.
[7]Dacey J W H,Wakeham S G.Oceanic dimethysulfide:production during zooplankton grazing on phytoplankton[J].Science,1986,233:1314-1316.
[8]Tang K W,Dam H G,Visscher P T,et al.Dimethysulfoniopropionate(DMSP)in marine copepods and its relation with diets and salinity[J].Marine Ecology Progress Series,1999,179:71-79.
[9]Wolfe G V.The cycling of climatically active dimethylsulfide(DMS)in the marine euphotic zone:biological and chemical constraints on the flux to atmosphere[D].Washington:University of Washington,1992.
[10]Leck C,Larsson U,Bagander L E,et al.DMS in the Baltic Seaannual variability in relation to biological activity[J].Journal of Geophysical Research,1990,95:3353-3363.
[11]Wolfe G V,Steinke M,Kirst G O.Grazing-actived chemical defense in a unicellular marine alga[J].Nature,1997,387:894-897.
[12]Christaki U,Belviso S,Dolan J R,et al.Assessment of the role of copepods and ciliates in the release to solution of particulate DMSP[J].Marine Ecology Progress Series,1996,141:119-127.
[13]Kwint R L J,Kramer K J M.Dimethylsulphide production by plankton communities [J]. Marine Ecology Progress Series,1995,121:227-237.
[14]刘光兴,张志南.胶州湾北部浮游动物的生物量和生产力 [J].青岛海洋大学学报:自然科学版,2000,30(2):58-64.
[15]孙军,John Dawson,刘东艳.夏季胶州湾微型浮游动物摄食初步研究 [J].应用生态学报,2004,15(7):1245-1252.
[16]张洪海,杨桂朋.胶州湾及青岛近海微表层与次表层中二甲基硫(DMS)与二甲巯基丙酸(DMSP)的浓度分布 [J].海洋与湖沼,2010,41(5):683-691.
[17]Dacey J W H,Blough N V.Hydroxide decomposition of dimethylsulfoniopropionate to form dimethylsulfide[J].Geophysical Research Letters,1987,14:1246-1249.
[18]Yang G P,Tsunogai S,Watanabe S.Biogenic sulfur distribution and cycling in the surface microlayer and subsurface water of Funka Bay and its adjacent area [J].Continental Shelf Research,2005,25:557-570.
[19]Parsons T R,Maita Y,Lalli C M.A manual for chemical and biological methods for seawater analysis[M].Oxford:Pergamon Press,1984:23-58.
[20]Porter K G,Feig Y S.DAPI for identifying and counting aquatic microflora[J].Limnology and Oceanogry,1980,25:943-948.
[21]孙儒永.动物生态学原理 [M].北京:北京师范大学出版社,1992:356-357.
[22]黄凤鹏,孙爱荣,王宗灵,等.胶州湾浮游动物的时空分布 [J].海洋科学进展,2010,28(3):332-341.
[23]陈亚瞿,徐兆礼,王云龙,等.长江口河口锋区浮游动物生态研究Ⅱ:种类组成、群落结构、水系指示种 [J].中国水产科学,1995,2(1):59-63.
[24]陈洪举,刘光兴.2006年夏季长江口及其临近水域浮游动物的群落结构 [J].北京师范大学学报:自然科学版,2009,45(4):393-398.
[25]徐兆礼.长江口邻近水域浮游动物群落特征及变动趋势 [J].生态学杂志,2005,4(7):780.
[26]章菁,杨关铭,王春生,等.舟山群岛附近海域浮游动物生态研究 [J].海洋学研究,2008,26(4):20-28.
[27]Sommer U,Sommer F,Santer B,et al.Daphnia versus copepod impact on summer phytoplankton:functional compensation at both trophic levels[J].Oecologia,2003,135:639-647.
[28]Sasaki H,Hattori H,Nishizawa S.Downward flux of particulate organic matter and vertical distribution of calanoid copepods in the Oyashio Water in summer[J].Deep-Sea Research I,1988,35:505-515.
[29]Yamaguchi A,Watanable Y J,Ishida H,et al.Community and trophic structures of pelagic copepods down to greater depths in the western subarctic Pacific(WEST-COSMIC)[J].Deep-Sea Research,2002,49:1007-1025.
[30]Tang K W,Dziallas C,Hutalle-Schmelzer K,et al.Effects of food on bacterial community composition associated with the copepodAcartiatonsaDana[J].Biology Letter,2009,5:549-553.
[31]Maugeri T L,Carbone M,Fera M T,et al.Distribution of potentially pathogenic bacteria as free living and plankton associated in a marine coastal zone [J].Journal of Applied Microbiology,2004,97:354-361.
[32]Unanue M,Ayo B,Azua L,Barcina I,et al.Temporal variability of attached and free-living bacteria in coastal waters[J].Microbial Ecology,1992,23:27-39.
[33]Bidle K D,Fletcher M.Comparison of free-living and particle-associated bacterial communities in the Chesapeake Bay by stable low-molecular-weight RNA analysis[J].Applied Environmental Microbiol,1995,61:944-952.
[34]景伟文,杨桂朋,康志强.胶州湾海水中DMS和DMSP的分布及其影响因素 [J].中国海洋大学学报:自然科学版,2010,40(11):95-100.
[35]Belviso S,Kim S K,Rassoulzadegan F,et al.Production of dimethylsulfonium propionate(DMSP)and dimethylsulfide(DMS)by a microbial food web[J].Limnology and Oceangraphy,1990,35:1810-1821.
[36]王小东.胶州湾浮游动物对浮游植物选择性摄食的初步研究[D].青岛:中国海洋大学,2006.
[37]Keller M D,Bellows W K.Physiological aspects of the production of dimethylsulfoniopropionate (DMSP)by marine phytoplankton[M].New York:Plenum Press,1996:131-142.
[38]Cantin G,Levasseur M,Gosselin M,et al.Role of zooplankton on the mesoscale distribution of dimethylsulfide concentrations in the Gulf of St.Lawrence,Canda[J].Marine Ecology Progress Series,1996,141:103-117.
[39]Wolfe G V,Sherr E B,Sherr B F.Release and consumption of DMSP fromEmilianiahuxleyiduring grazing byOxyrrhismarina[J].Marine Ecology Progress Series,1994,111:111-119.
[40]Kwint R L J,Irigoien X,Kramer K J M.Copepods and DMSP[M].New York:Plenum Press,1996:239-252.
[40]紫外辐射对南极棕囊藻细胞DMSP合成和DMS释放率的影响[J].海洋学报,1998,20(5):101-108.
[42]Kiene R P.Production of methanethiol from dimethysulfoniopropionate in marine surface waters[J].Marine Chemistry,1996,54:69-83.
