甲基Funlioside B的合成*
2014-04-17李宝杰谢江枫王月佼宋天佳
李宝杰,王 鹏,谢江枫,王月佼,宋天佳,李 明
(中国海洋大学 医药学院 海洋药物教育部重点实验室,山东 青岛266003)
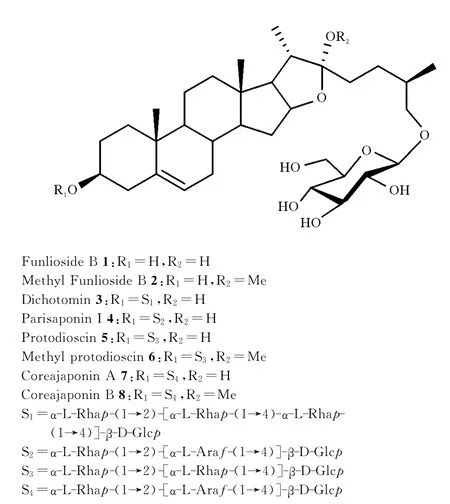
图1 典型的呋甾皂苷化合物Fig.1 Typical furostanol glycosides
甾体皂苷是一类植物中广泛存在的次生代谢产物[1],呋甾皂苷作为其中的重要组成部分[2],具有多种生物活性[3-4]。典型呋甾皂苷化合物包括1-8(见图1),Funlioside B(1)是由dichotomin(3)经酶Pectinex BE XXL(PBX)降解得到的产物,对HL-60细胞显示出一定的细胞毒性[5];同时该结构亦是多种具有良好生物活性呋甾皂苷的有机组成部分。如从我国用于治疗慢性支气管炎、乳腺炎、腮腺炎等疾病的传统中药—华重楼中首次分离得到的Parisaponin I 4[6]、和能够抑制白血病细胞 MOLT-4、结肠癌细胞 HCT-116、和SW-620、CNS癌细胞SNB-75以及肾癌细胞786-0等生长的原薯蓣皂苷和甲基原薯蓣皂苷(5和6)[7]以及能增加C6小鼠胶质瘤细胞的神经生长因子(NFG)的含量,作为治疗神经退行性疾病和糖尿病候选物的coreajaponin A 和B(7和8)[8]都含有Funlioside B (1)的结构单元。呋甾皂苷独特的结构和良好的生物活性,引起了合成化学家的广泛兴趣。Funlioside B(1)结构中的E环是1个半缩醛形式,22位的羟基不稳定,在微量酸性条件下,容易脱水形成双键(C20=C22)得到伪甾体皂苷。近年来,甲基呋甾皂苷[9-10]相继被分离得到,具有较好的稳定性和良好的生物活性。因此,本文报道甲基Funlioside B(2)的合成,为复杂呋甾皂苷合成提供有益的借鉴。
1 实验部分
1.1 仪器与试剂
所用试剂:TMSOTf、DMAP、CCl3CN、DBU 均为普通国产分析纯试剂,直接用于反应;二氯甲烷用以氢化钙回流重蒸;所用石油醚为60~90℃沸程。未经特殊说明,其它均为普通国产分析纯试剂。
柱层析使用300~400目硅胶(青岛海洋化工厂提供);薄层用预制硅胶板型号为gel 60F254(烟台);1H NMR、13C NMR 由JEOL JNM-ECP 600MHz核磁共振波谱仪测得,四甲基硅烷(TMS)为内标,单位:×10-6,室温;85-2型恒温磁力搅拌器。
1.2 实验操作
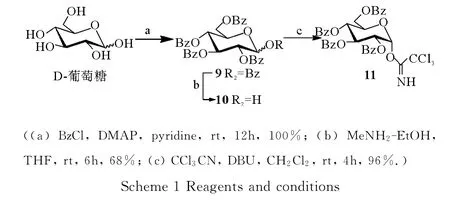
1.2.1 2,3,4,6-四-O-苯甲酰基-α-D-吡喃葡萄糖三氯亚胺酯11的合成 无水D型葡萄糖(10.5g,58.3mmol)溶于90.0mL无水吡啶中,然后冷却至0°C,氩气保护下点滴加入苯甲酰氯(40.8mL,350.0mmol,6.0 equiv.),自然升至室温后,搅拌过夜反应,TLC(Petroleum ether:AcOEt=2:1)显示反应完全。用甲醇淬灭反应,将所得溶液倒于冰水中,搅拌过夜,过滤,收集固体并用大量水洗涤得到化合物9(40.5g,57.7 mmol,100%),未经表征直接投入下一步反应。
化合物9(9.5g,13.5mmol)溶解在60.0mL无水THF中,然后冷却至0℃,氩气保护下缓慢加入甲胺醇溶液(3.7mL,27.1mmol,2.0equiv.),自然升至室温后,搅拌6h后,TLC(Petroleum ether∶AcOEt=2∶1)显示反应完全。加入冰乙酸调pH值为5~6,减压蒸除溶剂,所得浆状物使用1mol·L-1稀盐酸溶液洗涤,乙酸乙酯萃取,有机相依次使用饱和的食盐水洗涤,无水Na2SO4干燥,过滤收集有机相,减压蒸除溶剂,所得残余物经硅胶柱层析(Petroleum ether∶AcOEt=3∶1~2∶1)得到白色固体10(5.5g,9.2mmol,68%)。
将半缩醛10(0.2g,0.3mmol)溶于10.0mL无水CH2Cl2中,氩气保护下滴加 CCl3CN(0.3mL,3.3 mmol,10.0equiv.),冰浴条件下加入DBU (10.0μL,0.1mmol,0.2equiv.)。室温下搅拌4h 后,TLC(Petroleum ether∶AcOEt=3∶1)显示反应完全。减压蒸除溶剂,所得浆状物经硅胶柱快速层析(Petroleum ether∶AcOEt=6∶1~5∶1)得到白色泡沫状固体11(0.2g,0.3mmol,96%)。
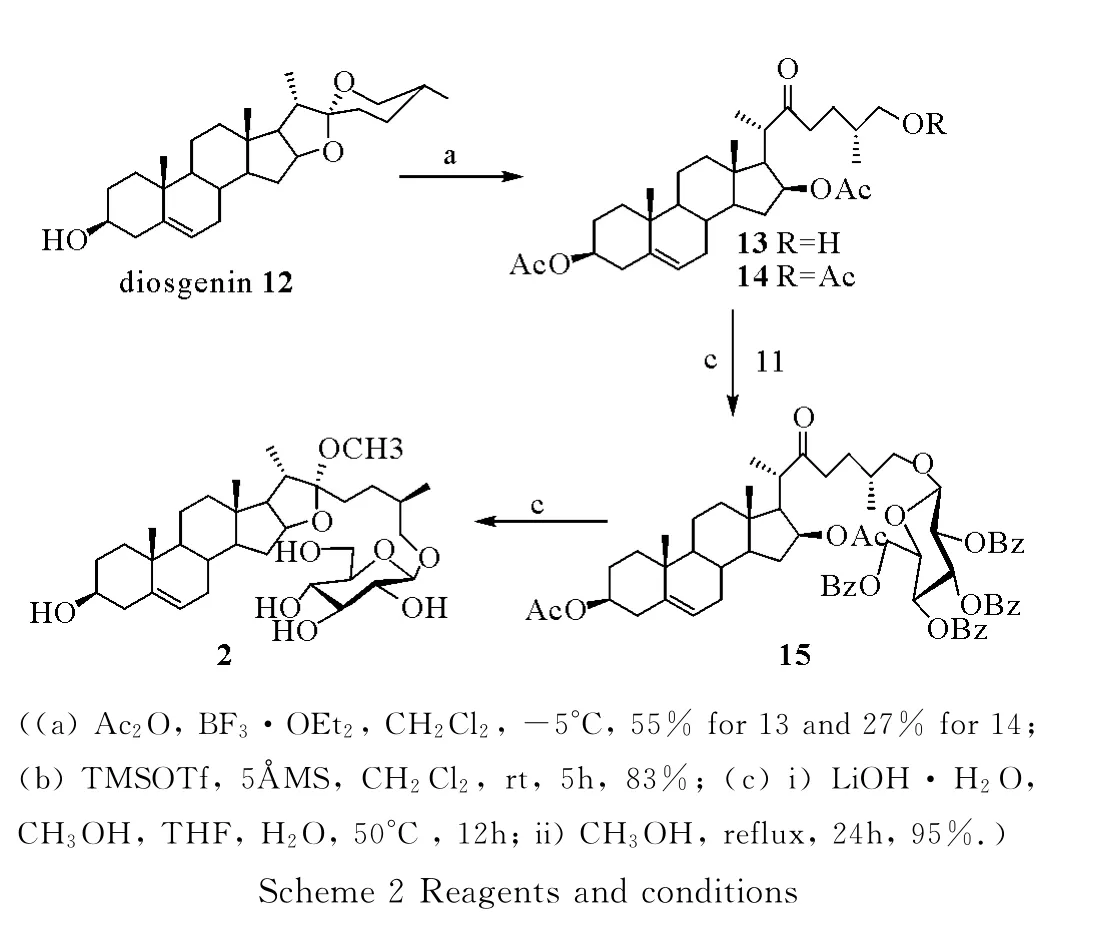
1.2.2 (25R)-3β,16β-二-O-乙酰基-22-羰基-胆甾烷-5-烯-26-醇13和(25R)-3β,16β,26-三-O-乙 酰 基-22-羰基-胆甾烷-5-烯14的合成 将薯蓣皂苷元化合物12(0.2g,0.5mmol)溶于2.0mL无水CH2Cl2中,冷却至 -5°C,加入乙酸酐(0.5mL,4.8mmol,10.0 equiv.),搅拌10min,缓慢滴加 BF3·OEt2(0.4mL,3.4mmol,7.0equiv.),继续搅拌5min,TLC(Petroleum ether∶AcOEt=3∶1)显示反应完全。将反应液置于冰水中充分搅拌。所得溶液用CH2Cl2稀释,依次使用饱和NaHCO3溶液,饱和食盐水洗涤,收集有机相用无水Na2SO4干燥,过滤、减压蒸除溶剂,所得浆状物经硅胶柱层析(Petroleum ether∶AcOEt∶CH2Cl2=3∶1∶1)得到白色固体13 (140mg,0.27mmol,55%)和白色固体14(75mg,0.13mmol,27%)。化合物13:1H NMR(600MHz,CDCl3)δ5.34(d,J=4.9Hz,1H),4.96(m,1H),4.57(m,1H),3.40(d,J=5.5Hz,2H),2.94 (m,1H),2.62 (m,1H),2.42~2.34 (m,2H),2.29~2.28(m,2H),2.01(s,3H),1.96~1.80(m,9H),1.68~1.22(m,13H),1.11(d,J=7.1Hz,3H),1.00(s,3H),0.89 (d,J=6.6Hz,3H),0.85(s,3H);13C NMR (150MHz,CDCl3)δ213.7,170.5,169.8,139.6,122.2,75.6,73.8,67.4,55.0,53.8,49.7,43.4,41.8,39.5,38.5,37.97,36.8,36.5,35.4,34.8,31.5 31.2,27.6,26.2,21.4,21.1,20.6,19.2,16.8,16.6,13.2;HRESI-MS Calcd for C31H49O6517.352 9,(M +H)+;found:517.352 4。
1H NMR (600MHz,CDCl3)δ5.36 (d,J=4.9Hz,1H),4.98(m,1H),4.59(m,1H),3.90(m,2H),2.94(m,1H),2.67~2.29(m,5H),2.05(s,3H),2.03 (s,3H),1.95 (s,3H),1.70~1.24 (m,18H),1.14 (d,J=7.1Hz,3H),1.02 (s,3H),0.91(d,J=6.6Hz,3H),0.86(s,3H)。
1.2.3 (25R)-3β,16β-双乙酰基-22-羰基-胆甾烷-5-烯-26-O-2,3,4,6-四-O-苯甲酰基-β-D-吡喃葡萄糖苷15的合成 将化合物13(0.1g,0.19mmol),化合物11(0.21g,0.29mmol,1.5equiv.)和57AMS (0.6g)混溶于2.0mL无水CH2Cl2中,室温下搅拌30min后,在冰浴中滴加三甲基硅基三氟甲磺酸酯TMSOTf(3.6μL,0.02mmol,0.1equiv.),自然升至室温搅拌5h后,TLC(Petroleum ether∶AcOEt=1∶1)显示反应完全。加入三乙胺淬灭反应。过滤掉分子筛,减压蒸除溶剂,所得残余物经硅胶柱层析(Petroleum ether∶AcOEt=4∶1)得到白色固体15(0.17g,0.16mmol,83%)。H NMR(600MHz,CDCl3)δ8.02(d,J=9.1Hz,2H),7.94(d,J=9.1Hz,2H),7.90 (d,J=9.1Hz,2H),7.82(d,J=9.1Hz,2H),7.52~7.45 (m,3H),7.42~7.22(m,8H),7.17(m,1H),5.89(t,J=11.6Hz,1H),5.67(t,J=11.7Hz,1H),5.52(t,J=11.5Hz,1H),5.36(d,J=4.8Hz,1H),4.92(m,1H),4.81 (d,J=9.4Hz,1H),4.65~4.55(m,2H),4.50 (dd,J=14.5,6.2Hz,1H),4.15(m,1H),3.73(m,1H),3.37(m,1H),2.85(m,1H),2.54~2.19(m,6H),2.01(s,3H),1.92~1.81(m,8H),1.64~ 1.09 (m,12H),1.02 (s,3H),0.99(d,J=6.6Hz,3H),0.83(s,3H),0.76(d,J=7.9Hz,3H);13C NMR (150MHz,CDCl3)δ212.9,170.5,169.8,166.1,165.7,165.2,165.0,139.5,133.4,133.2,133.1,133.0,129.8,129.7,129.6,129.5,129.2,128.8,128.7,128.4,128.3,128.2,122.2,101.4,75.6,75.2,73.8,72.9,72.1,71.8,69.8,63.1,54.9,53.8,49.7,43.4,41.8,39.5,38.5,38.0,36.8,36.5,34.8,32.8,31.5,31.2,27.6,26.9,21.4,21.1,20.6,19.2,16.6,16.5,13.2;HRESI-MS Calcd for C65H74O15Na(M+Na)+:1 117.492 0;found:1 117.489 1。
1.2.4 甲基 Funlioside B 2的合成 将化合物 15(30.0mg,0.027mmol)溶于1.0mL 甲醇、1.0mL THF和125μL蒸馏水的混合溶液中,加入LiOH·H2O (10.2mg,0.24mmol,9.0equiv.),在50°C条件下反应。搅拌12h后,TLC(CH2Cl2∶CH3OH =8∶1)显示反应完全。加入Dowex-50(H+)树脂调pH为5~6,过滤、减压蒸除溶剂,所得残余物经硅胶柱层析(CH2Cl2∶CH3OH=10∶1)得到白色固体。在无水甲醇中回流24h,得到白色固体甲基Funlioside B 2(15.2mg,0.026mmol,95%)。1.0,CH3OH);1H NMR (600MHz,pyridine-d5)δ5.40(d,J=4.9Hz,1H),4.85 (d,J=7.7Hz,1H),4.58(dd,J=11.6,2.2Hz,1H),4.47~4.39(m,2H),4.24(m,2H),4.03(t,J=8.3Hz,1H),3.96(m,1H),3.85(m,1H),3.60(m,1H),3.26(s,3H),2.62 (m,2H),2.22~1.71 (m,10H),1.61~1.32 (m,9H),1.20 (d,J=6.6Hz,3H),1.05(s,3H),1.00(d,J=6.6Hz,3H),0.84(s,3H).;13C NMR (150MHz,pyridine-d5)δ141.7,120.8,112.4,104.7,81.0,78.3,78.2,74.9,71.4,71.0,63.9,62.6,56.4,50.1,47.0,43.2,40.5,40.2,39.5,37.5,36.7,33.9,32.3,32.0,31.9,31.4,30.5,27.9,20.8,19.3,16.9,16.0;HRESI-MS Calcd for C34H56O9Na (M + Na)+:631.381 7;found:631.379 9。
2 结果与讨论
首先是D-葡萄糖三氯亚胺酯给体11的合成。将D-葡萄糖溶解在无水吡啶溶液中,与苯甲酰氯反应得到全苯甲酰化的产物9,然后在甲胺醇溶液中选择性的将异头位的苯甲酰基团脱除得半缩醛10,在DBU(1,8-二恶唑双环[5,4,0]-7-十一烯)作用下与三氯乙腈反应得到2,3,4,6-四-O-苯甲酰基-α-D-葡萄糖三氯亚胺酯给体11(Scheme 1),其数据与文献[11]报道一致,为α构型。
在得到葡萄糖三氯亚胺酯糖基给体后,对薯蓣皂苷元12为转化为胆甾烷型苷元13的反应进行了研究。文献[12-13]报道,在0°C条件下,以及三氟化硼乙醚(BF3·OEt2)的促进下,12能以以84%的产率得到化合物13。但令人失望的是,在该条件下只以28%的产率得到化合物13,同时也以47%的产率得到副产物化合物14。通过对反应温度的优化,作者发现当控制反应温度为-5°C,乙酸酐和三氟化硼乙醚为10当量与7当量时,可以55%和27%的产率得到期望的化合物13和副产物14(Scheme 2)。
以三甲基硅基三氟甲磺酸酯为促进剂,在57A分子筛存在条件下,葡萄糖三氯亚胺酯给体11和胆甾烷型苷元13在二氯甲烷溶剂中进行糖苷化反应,以83%的产率的立体选择性地得到1,2-反式的β-型糖苷15。在甲醇/水/四氢呋喃混合溶液中,用LiOH·H2O于50℃脱除15中的4个苯甲酰基和2个乙酰基,将所得产物在无水甲醇中回流24h,最终以95%的产率得到甲基 Funlioside B(2)。文献[14-17]报道,在氘代吡啶中当呋甾皂苷的22位甲氧基为α构型时,C22的化学位移为112.4ppm。得到的甲基 Funlioside B(2),其C22的化学位移为112.4ppm,与文献值一致,因此22位甲氧基为α构型。选用回流温度条件下,脱除酰基保护基是由于15中16位乙酰基较大的空间位阻,在较温和的条件下(甲醇钠/甲醇,室温条件下搅拌)不能脱除。
3 结语
本文以易得的薯蓣皂苷元为原料,以6步反应29%的总产率得到甲基Funlioside B(2)。在三氟化硼乙醚条件下,经过一步反应实现甾体皂苷螺旋甾烷型向胆甾烷型的转化,大大的缩短了合成步骤,提高了合成的效率;在最后脱除保护基团的同时,又实现了E环的关环,得到呋喃甾烷甾体皂苷。这些工作顺利进行为合成结构更为复杂的三糖、四糖呋甾皂苷奠定了坚实的实践基础,也为呋甾皂苷进行更为广泛深入的生物活性与作用机制的研究提供了有利条件。
[1]Hostettmann K,Marston A.saponins[M].New York:Cambridge Univercity Press,1995.
[2]Victoria L,Sonia P,De Voss J J.NMR assignment of the absolute configuration of C-25in furostanol steroidal saponins[J].Steroids,2012,77:602-608.
[3]Waller G R,Yamasaki K.Saponins used in Traditional and Modern Medicine[M].New York:Plenum Press,1996.
[4]Rao A V,Gurfinkel D M.Drug metabol[J].Drug Interact,2000,17:211.
[5]Zhao Y,Feng B,Ma B P.Biotransformation of Dichotomin by pectinex BE XXL[J].Chin J Nat Med,2009,7(5):381-389.
[6]Matsuda H,Pongpiriyadaacha Y,Morikawa T,et al.Protective effects of steroid saponins from paris polyphylla var.yunnanensis on ethanol-or indomethacin-induced gastric mucosal lesions in rats:structural requirement for activity and mode of action[J].Bioorg Med Chem Lett,2003,13:1101-1106.
[7]Wang G H,Chem M,Huang N,et al.Methyl protodioscin induces G2/M cell cycle arrest and apoptosis in HepG2liver cancer cell[J].Cancer Lett,2006,241:102-109.
[8]Kim K H,Kim M A,Moon E,et al.Ro.Furostanol saponins from the rhizomes of Dioscorea japonica and their effects on NGF induction[J].Bioorg Med Chem Lett,2011,21:2075-2078.
[9]Diab Y,Ioannou E,Roussis V.Desmettianosides A and B,bisdesmosidic furostanol saponins with molluscicidal activity from Yucca desmettiana[J].Steroids,2012,77:686-690.
[10]Yokosuka A,Mimaki Y,Sashida Y.Steroidal and Pregnane Glycosides from the Rhizomes of Tacca chantrieri[J].J Nat Prod,2002,65:1293-1298.
[11]Gauthier C,Legault J,Lebrun M,et al.Glycosidation of lupanetype triterpenoids as potent in vitro cytotoxic agents[J].Bioorg Med Chem,2006,14:6713-6725.
[12]Fernéndez-Herrera M A,Sandoval-Ramirez J,Meza-Reyes S,et al.Side-chain opening of steroidal sapogenins to form 22-oxocholestanic skeletons.An approach to analogues of the aglycone of the potent anticancer agent OSW-1[J].J Mex Chem Soc,2009,53:126-130.
[13]Fern︶ndez-Herrera M A,López-Mu1oz H,Hern︶ndez-V︶zquez J M V,et al.Synthesis of 26-hydroxy-22-oxocholestanic frameworks from diosgenin and hecogenin and their in vitro antiproliferative and apoptotic activity on human cervical cancer CaSki cells[J].Bioorg Med Chem,2010,18:2474-2484.
[14]Zou K,Wang J Z,Du M,et al.A pair of diastereoisomeric steroidal saponins f rom cytotoxic ext ract s of Tupistra chinensis rhizomes[J].Chem Pharm Bull,2006,54:1440-1442.
[15]Festa C,Zollo F,Iorizzi M,et al.Novel Steroidal Components from the Underground Parts of Ruscus aculeatus L[J].Molecules,2012,17:14002-14014.
[16]Diab Y,Ioannou E,Emamb A,et al.Desmetti anosides A and B,bisdesmosidic furostanol saponins with molluscicidal activity from Yucca desmettiana[J].Steroids,2012,77:686-690.
[17]Yokosuka A,Jitsuno M,Yui S,et al.Steroidal Glycosides from AgaWe utahensis and Their Cytotoxic Activity[J].J Nat Prod,2009,72:1399-1404.
