秦4甘薯的微茎尖脱毒快繁研究
2014-04-16崔志钢CUIZhigang王琨WANGKun
崔志钢 CUI Zhi-gang;王琨 WANG Kun;
顾昌华 GU Chang-hua;徐代华 XU Dai-hua;陈涛 CHEN Tao
(铜仁职业技术学院农学院,铜仁 554300)
(Agronomy Institute of Tongren Polytechnic College,Tongren 554300,China)
0 引言
防治甘薯病毒病,提高甘薯产量和品质的一条最有效途径是利用茎尖分生组织培养繁育甘薯脱毒苗[1]。目前关于甘薯脱毒苗培养技术研究很多[3-8],但现有的脱毒培养技术体系是否适合秦薯4号甘薯的脱毒繁育,一些技术参数是否需要进一步优化,以及脱毒苗保存、快繁过程中需要注意的一些关键环节都亟待阐明;本研究拟通过微茎尖剥离加变温处理的措施,再通过优化培养基中植物生长调节剂的配比,建立秦薯4号脱毒试管苗快繁的技术参数。
1 材料与方法
1.1 材料:秦薯4号种薯。
1.2 方法
1.2.1 茎尖分生组织剥离 选健壮无病,具有秦4典型特征的薯块于温室内催芽,至幼苗长到30cm左右时,取顶端2cm左右的顶芽35个,剪去肉眼可见的叶片,用体积分数70%的乙醇做20s表面消毒,然后以升汞浸泡6min,无菌水冲洗3~5次。在超净工作台上、利用体视显微镜切取带有1-2个叶原基、长0.3~0.9mm的茎尖分生组织。
1.2.2 变温处理诱导脱毒单株 剥离好的茎尖迅速转入添加0.2mg/L6-BA的MS培养基上,遮光28℃预培养20h,然后转入光照培养箱或人工气候室,光照16h、温度37℃和黑暗8h、温度22℃交替变温处理30-50d,待生长中心长第一真叶露出时,视培养基情况转移继代或直接转入正常培养环境继续培养。
1.2.3 脱毒种苗的快速繁殖 利用茎尖分生组织剥离与交替变温处理得到的秦薯4号脱毒苗。脱毒苗在超净台上去叶,切割成1~2cm,带1~2个腋芽的小段,按形态学方向分别接种于N6、B5、MB、MS基本培养基上,各100瓶,每瓶3段。15d后测量株高、单株叶片数、单株根数和根长和成苗率。
采用MS作为基本培养基,按表2中6-BA和NAA浓度添加到培养基中,每个处理100瓶,每瓶3株。所有培养基均加入30g/L蔗糖,6.0g/L琼脂,pH值5.6~5.8。接种后,于25℃,2000~3000lx,光照16h/d条件下培养。15d后测量株高、单株叶片数、单株根数和根长,并记录发根时间。
2 实验结果及分析
2.1 脱毒单株的诱导 幼小的生长锥(微茎尖)接种入培养基后,能够较快的适应培养环境。在接种后约7d即开始膨大,14d后愈伤组织便可达到麦粒大小。半个月后,一些生长松散的黄白色愈伤组织上开始隐约出现一个绿色的点状区域,随后这一区域逐渐扩大,至一个月左右,一些生长较快的愈伤组织中部的绿色生长中心开始分化出芽,至40天左右这些芽进一步生长,真叶展开形成芽苗,此时,由于培养基中营养成分的损耗,同时没有根形成,芽苗生长很缓慢,如果将芽苗转至新鲜培养基上,再经过20d左右就可以分化得到完整的再生植株。
2.2 不同基本培养基对秦4甘薯植株再生的影响(表1)不同基本培养基对脱毒苗的平均根数、平均根长有明显影响,本实验在所采用的4种培养基中,MS基本培养基上脱毒薯苗的平均生根数最高,达到6.4条;单株平均叶片数最多,达到8.3条,平均株高最高,达到7.1,明显高于其它3种基本培养基。但是,平均根长以MB基本培养基中培养的脱毒薯苗最长,达到5.6cm。
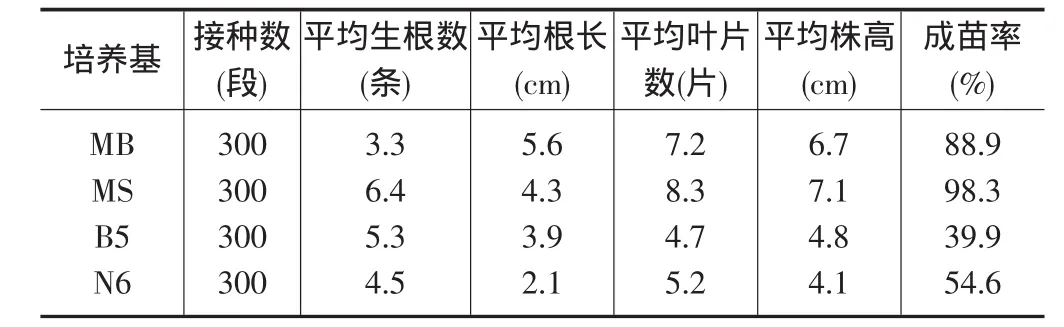
表1 不同基本培养基对秦4甘薯植株再生的影响
2.3 不同6-BA和NAA浓度配比对脱毒苗生长的影响 NAA对试管苗生长的影响结果(表2)显示:培养基中6-BA浓度不变,甘薯苗平均生根数、平均根长、平均叶片数和平均株高随NAA质量浓度的增加而变化。平均根数、平均叶数、平均株高均随NAA质量浓度的增加呈先高后低再升高的单峰曲线。当NAA质量浓度为0.5mg/L时,6-BA质量浓度为0.1mg/L,接种茎段产生根原基天数最短,为6.1天;15d后平均株高最高,可达6.5cm,平均叶片数达4.5,再生植株带有14.9条平均长度为8.0cm的白色幼根。另外,从表2中数据还可证明高质量浓度NAA处理对幼根的形成和茎、叶的生长方面是不利的。
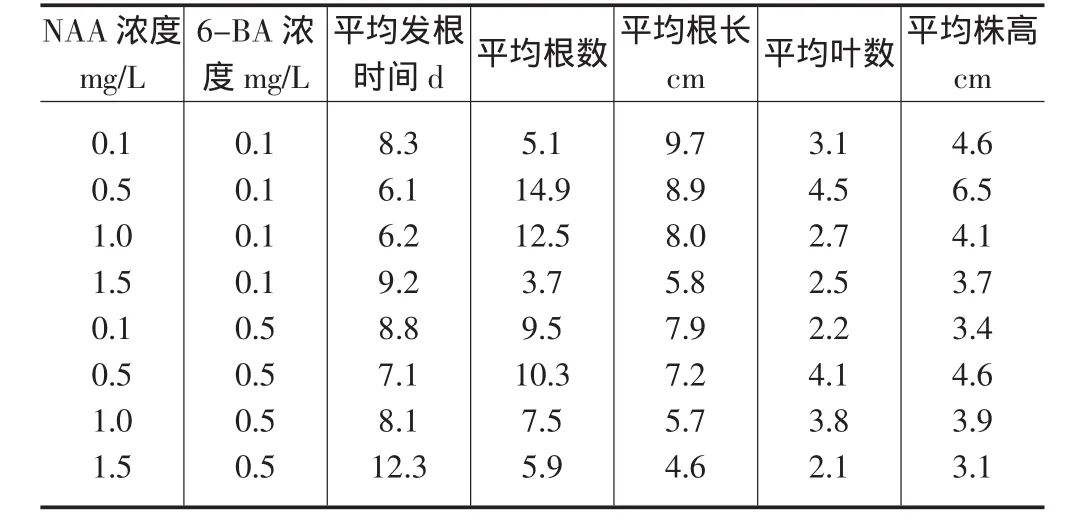
表2 不同6-BA和NAA浓度配比对脱毒苗生长的影响
3 讨论
激素控制着细胞的分化,已经被众多的研究所证实。实验发现,在脱毒苗茎段培养之初,培养基中仅添加的0.5mg/LNAA时,茎段发根时间最快,生根数、平均叶数、平均株高均优于添加其它NAA浓度处理。当培养基中6-BA质量浓度不变,甘薯苗平均生根数、平均根长、平均叶片数和平均株高随NAA质量浓度的增加而变化。平均根数、平均叶数、平均株高均随NAA质量浓度的增加呈先高后低再升高的单峰曲线。另外从表2数据还可得出接种脱毒苗茎段发根长度随NAA质量浓度升高有逐渐变短的趋势。
4 结束语
本研究结果表明,MS和MB基本培养基对甘薯脱毒苗的快繁作用比B5和N6基本培养基好,而在MS和MB基本培养基较B5和N6基本培养基有较高的离子浓度,说明甘薯脱毒苗适合于在较高离子浓度的培养基上生长,这一结论与许多研究结果一致[10-14]。试验中也证实了付增光、陈越等人的研究[1],MB基本培养基中脱毒薯苗的根部往往形成较大的愈伤组织块,在幼苗移栽阶段必须将这种愈伤组织块用清水清洗掉,以提高移栽成活率。
试验结果证实本研究所用的添加有6-BA0.5mg/L和0.1mg/LNAA的MS培养基,是适合秦薯4号脱毒种苗茎段快速繁殖的。接种茎段产生根原基天数最短,为6.1天;15d后平均株高最高,可达6.5cm,平均叶片数达4.5,再生植株带有14.9条平均长度为8.0cm的白色幼根。这与周志林等[14]增加培养基中生长素的浓度并配合适量的细胞分裂素能有效的促进植株的生长的研究结果一致。脱毒种苗的增值除了与基本培养基种类、不同激素配比、培养条件有关外,还与植物的基因型有关,本实验采用的是秦薯4号作为实验材料,存在与其它研究数据不一致的情况[15-16]。
[1]付增光,陈越,郭东伟,刘卫涛.甘薯脱毒苗的离体快繁研究[J].西北农林科技大学学报(自然科学版),2004(1).
[2]易九红,张超凡,刘爱玉,黄艳岚,周虹.甘薯生长与环境、栽培因素及内源激素的关系[J].作物研究,2012(6).
[3]刘庆昌,吴国良.植物细胞组织培养[M].北京∶中国农业大学出版社,2002∶37.
[4]王清连.植物组织培养[M].北京∶中国农业出版社,2002∶21-23.
[5]周志林,唐君,张允刚,赵冬兰,史新敏.甘薯脱毒试管苗高效快繁体系研究[J].西北农业学报,2008(1).
[6]孙光泽,杨春玲,孙克威.甘薯脱毒与快繁技术[J].农业与技术,2007(4).
[7]郑跃进,王其法,徐春娥,孔祥生,李友军.脱毒甘薯的扩繁与快繁[J].种子,2005(9).
[8]赵秀芳.甘薯种苗的脱毒与快繁技术[J].种子,2005(4).
[9]李强,马代夫,李洪民,马飞,谢逸萍,李秀英.NAA和6-BA在甘薯组织培养中的应用研究[J].江苏农业科学,2003(4).
[10]解红娥,武宗信,冯文龙等.甘薯脱毒技术及应用[J].国外农学-杂粮作物,1997,17(6)∶24-25.
[11]王常云,王作全,李晓亮等.甘薯脱毒苗工厂化生产关键技术再研究[J].国外农学-杂粮作物,1998,18(1)∶18-20.
[12]孔祥生,张妙霞,郭秀璞.甘薯茎尖分生组织培养及快速繁殖技术的研究[J].河南农业大学学报,1998,32(2)∶133-137.
[13]武宗信,解红娥,冯文龙等.甘薯茎尖组织培养技术研究[J].山西农业科学,1997,25(4)∶59-62.
[14]周志林,唐君,张允刚,赵冬兰,史新敏.甘薯脱毒试管苗高效快繁体系研究[J].西北农业学报,2008,17(1)∶257-262.
[15]蔡蕊,徐民泽,段浩楠,刘洪炎,徐洪伟.紫色甘薯试管苗稳定高效快繁技术研究[J].广东农业科学,2012(22)∶16-18.
[16]杨贤松,杨占苗,高峰等.紫色甘薯的茎尖培养与脱毒[J].热带作物学报,2007,28(3)∶68-73.
