槲皮素对高糖诱导的RPE细胞凋亡的保护作用及机制
2014-04-13张静琳易魁先武哲明吴斌斌高汝龙
张静琳* 易魁先 陈 韵 武哲明 吴斌斌 高汝龙
(爱尔眼科医院集团广州爱尔眼科医院,广东 广州510080)
槲皮素对高糖诱导的RPE细胞凋亡的保护作用及机制
张静琳* 易魁先 陈 韵 武哲明 吴斌斌 高汝龙
(爱尔眼科医院集团广州爱尔眼科医院,广东 广州510080)
目的研究槲皮素对高糖诱导的RPE细胞凋亡的保护作用及其作用机制。方法将A-RPE19细胞系的细胞分别培养于普通培养基和高糖培养基中,其中高糖培养基内分别加入0、50、100、150 mmol/L的槲皮素,培养24 h以后用TUNEL检测各组细胞的凋亡,并根据该结果选取槲皮素的最佳作用浓度,进行caspase3的免疫荧光染色,线粒体酶复合物的活性测定。结果高糖培养的RPE细胞的凋亡指数(TUNEL阳性细胞/总细胞数)明显高于对照组,槲皮素可以明显抑制高糖诱导的RPE细胞的凋亡,其中以100 mmol/L的浓度作用效果最强,与高糖培养组相比,其差异有明显的统计学意义(P<0.05)。高糖组的caspase3的免疫荧光染色明显强于对照组和高糖+100 mmol/L槲皮素组。线粒体复合酶Ⅱ的活性各组之间并无统计学差异。高糖组的线粒体复合酶Ⅰ和Ⅳ的活性均明显低于对照组和高糖+100 mmol/L槲皮素组(P<0.05)。结论槲皮素可以抑制由高糖诱导的RPE细胞的凋亡,其作用是通过抑制caspase3的激活和线粒体保护实现的。
槲皮素;RPE细胞线粒体氧化应激
糖尿病(Diabetes Mellitus,DM)已成为21世纪世界范围内的一种严重威胁人类健康的慢性非传染性疾病,是当前世界各国共同面对的公共健康问题。氧化应激与糖尿病及其并发症的发生、发展密切相关。线粒体不仅是细胞能量转化的中心,也是细胞内自由基的主要来源[1]。班廷奖得主Brownlee教授提出糖尿病并发症发病的统一机制学说[2]:发生糖尿病并发症的经典途径——多元醇途径、糖基化终末产物(AGE)途径、蛋白激酶C(PKC)途径和氨基己糖途径,均是在高糖环境下,由线粒体呼吸链中氧自由基生成过多导致的结果。槲皮素是黄酮类中分布最广、抗氧化能力最强的一种天然药物,其化学名为3,3′,4′,5,7-五羟基黄酮(Pentahydroxyflavone),化学分子式为C15H10O7·xH2O,相对分子质量为302.24。目前,槲皮素对糖尿病作用的体内研究大多集中在心、肝和肾等器官方面,它能降低糖尿病动物的血糖,保护肝脏胰岛β细胞死亡[3-5],减少肾功能损害[6],提高心肌收缩功能等[7,8]。对糖尿病眼病,特别是DR的研究甚少。有研究称槲皮素可以显著地抑制由VO(acac)-2引起的线粒体毒性和细胞毒性[9]。因此,我们推断槲皮素可能对高糖诱导的人视网膜色素上皮细胞的凋亡有保护作用,而且其保护作用是通过线粒体的保护而实现的。为此,我们设计了此课题,为其临床应用提供可靠的实验基础和理论依据,为中草药的开发利用提供重要的研究线索,还可能为糖尿病视网膜病变的早期防治提供新的药物靶点和思路。
1 材料与方法
1.1 材料
将人RPE细胞APRE-19细胞株(购于美国模式培养物集存库)复苏后,用含10%胎牛血清的DMEM/F12培养液,置于37.5 ℃,5% CO2的孵育箱中培养。细胞生长融合后用0.25%的胰蛋白酶消化传代,选取第5~15代细胞用于实验。
1.2 实验分组
实验分组:分为:①对照组,培养基葡萄糖浓度为5.6 mmol/L,培养基中不加入任何药物;②高糖组,培养基葡萄糖浓度30 mmol/L;③高糖+不同浓度梯度槲皮素组,槲皮素的浓度分别为50、100、 150 mmol/L。各组细胞培养48 h以后进行各项检测。
1.3 试剂配制
槲皮素(美国Sigma公司)用二甲基亚枫(美国Sigma公司)溶解成10 mg/mL的溶液,抽滤灭菌。再用培养基配成相应的浓度。
1.4 TUNEL计数测量细胞凋亡
细胞用4%多聚甲醛固定,按照TUNEL试剂盒(美国Roche公司)指示,进行TUNEL检测,在每张片子上随机选取10个视野,计算每个视野内TUNEL阳性的细胞数和总细胞数,凋亡指数=TUNEL阳性细胞数/总细胞数。根据TUNEL结果选择槲皮素的最佳作用浓度。
1.5 免疫荧光染色
细胞用4%多聚甲醛固定30 min后,用甲醛冰醋酸(1∶1)混合液固定10 min后,用1∶200 Caspase3抗体(美国Cell Signaling公司,Cleaved Caspase-3抗体,#9664)孵育,4 ℃过夜,然后用anti-Rabbit的二抗(美国Molecular Probes公司的Alexa Fluor® 488 Donkey Anti-Rabbit IgG(H+L)Antibody)1∶400孵育1 h,进行caspase3的免疫组织荧光染色。
1.6 线粒体酶复合物活性测定。
将细胞按线粒体提取试剂盒(美国Pierce公司)说明书提取线粒体溶液,将线粒体溶液以BCA法进行蛋白定量[10],根据定量结果稀释为10 mg/mL,分装保存于-70 ℃。
线粒体于-20 ℃/20 ℃反复冻融3次以破坏线粒体膜,测定温度为30 ℃,反应体积为1 mL。分别测定酶复合体Ⅰ酶复合体Ⅱ和酶复合体Ⅳ在特定波长处的光吸收值,酶样本活性(RI)=(△A/min×TV× 106)/(ε×l×SV)。其中,△A/min为每分钟吸光度的变化,TV为反应系统总体积,SV为样本体积,ε为被测物的摩尔消光系数,l为光径,酶活力以μmol/min/mg蛋白表示。
2 结 果
2.1 TUNEL结果
对照组中,TUNEL指数为0.1%;高糖组中,TUNEL指数为38.2%;与对照组相比差异有明显的统计学意义(P=0.000<0.05)。
高糖+50 mmol/L槲皮素组,TUNEL指数为16.7%;高糖+100 mmol/L槲皮素组,TUNEL指数为2.1%;高糖+150 mmol/L槲皮素组,TUNEL指数为15.7%。高糖+槲皮素组各个不同浓度均有保护高糖诱导的RPE细胞凋亡的作用,其中以100 mmol/L组的保护作用最强。与高糖组相比,具有明显的保护作用(P=0.000<0.05)。
2.2 免疫荧光染色
高糖组caspase3的免疫荧光染色明显强于高糖+100 mmol/L槲皮素组和对照组。见图1。

图1 免疫荧光染色图
2.3 线粒体复合酶活性测定
线粒体复合酶Ⅱ各组之间并无统计学差异,而线粒体复合酶Ⅰ和线粒体复合酶Ⅳ中,高糖组的酶活性均明显低于对照组(P<0.05),高糖组明显低于高糖+100 mmol/L槲皮素组,而对照组与高糖+100 mmol/L槲皮素组相比没有明显的统计学差异。
高糖培养下的RPE细胞的线粒体复合酶Ⅰ和Ⅳ活性明显降低,反映了线粒体功能的受损,而加入100 mmol/L的槲皮素可以使线粒体复合酶Ⅰ和Ⅳ活性显著提高,说明槲皮素对高糖培养的RPE细胞的凋亡是通过改善线粒体的功能而实现的,见表1。
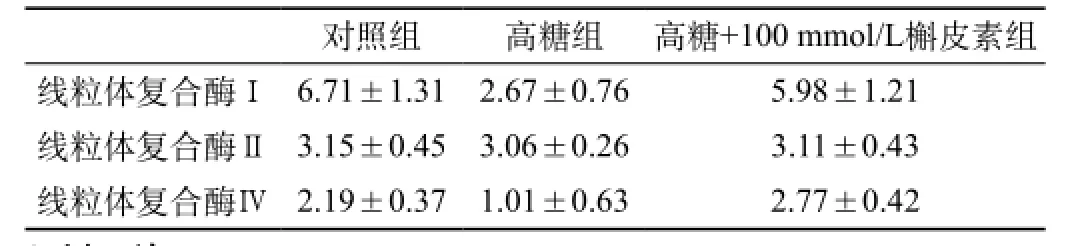
表1 不同糖浓度下线粒体复合酶Ⅰ、Ⅱ和Ⅳ的活性比较
3 讨 论
糖尿病视网膜内存在由氧化应激导致的线粒体的损害。已有研究模拟并证实了一条糖尿病早期视网膜病变发生发展的途径:高糖血症及其糖代谢异常引发视网膜组织氧化应激,氧化应激激活下游信号通路P38 MAPK,P38 MAPK通路将氧化应激死亡信号从细胞外传递到细胞内,诱导Caspases级联反应,导致神经节细胞凋亡[11];同时诱导视网膜VEGF表达异常,VEGF和基质细胞衍生因子(stromal cell-derived factor-1 SDF-1)的“正反馈”,促进人视网膜微血管内皮细胞的增殖和迁移,导致血-视网膜屏障(Blood-retinal Barrier,BRB)破坏[12]。而对DR患者玻璃体进行测定,也发现了氧化应激标志物水平显著升高[13]。高糖诱导牛视网膜内皮细胞后以及对糖尿病鼠视网膜组织进行检测,发现ROS显著增高,且增高的R0S主要来源于线粒体,因为电子传递链复合体Ⅱ抑制剂可完全抑制高糖对视网膜内皮细胞的这种诱导作用,而NADPH氧化酶及一氧化氮合酶(NOS)抑制剂的作用微弱[14]。诸多的文献的资料[15-20]表明,在糖尿病视网膜血管结构中氧自由基的增加可导致线粒体出现损害现象如:NK-κB被激活,Bax转移至线粒体内。这些现象导致了细胞色素C从线粒体释放至细胞质,进而可激活caspase-9,随后激活caspase-3,最终导致视网膜细胞的死亡。
在本研究中,槲皮素组RPE细胞的凋亡指数显著低于高糖培养的RPE细胞,高糖培养的RPE细胞的Caspase3染色明显强于对照组和槲皮素组,可见槲皮素是通过抑制caspase3的激活从而对高糖诱导的RPE凋亡起保护作用。此外,因糖尿病而增加的过氧化硝酸盐亦加剧线粒体的功能不良。功能不良的线粒体可产生更多的氧自由基,进而导致氧化损伤的恶性循环。在我们的研究中,高糖培养下的RPE细胞的线粒体复合酶Ⅰ和Ⅳ活性明显降低,反映了线粒体功能的受损,而100 mmol/L的槲皮素可以使线粒体复合酶Ⅰ和Ⅳ活性显著提高,说明槲皮素对高糖培养的RPE细胞的凋亡是通过改善线粒体的功能而实现的。因此,如果我们在DR发展的早期就进行线粒体的保护,有望阻止DR的进展,本实验结果为DR的早期预防和治疗提供了新的思路和靶点。
[1] Wallace DC.Mitochondrial genetics:a paradigm for aging and degenerative diseases?[J] Science,1992,256(5057):628-632.
[2] Brownlee M.The pathobiology of diabetic complications:a unifying mechanism[J].Diabetes,2005,54(6):1615-1625.
[3] Maher P,Hanneken A.Flavonoids protect retinal ganglion cells from oxidative stress-induced death[J].Invest Ophthalmol Vis Sci,2005,46(12):4796-4803.
[4] Dias AS.Quercetin decreases oxidative stress,NF-kappaB activation,and iNOS overexpression in liver of streptozotocininduced diabetic rats[J].J Nutr,2005,135(10): 2299-2304.
[5] Coskun O.Quercetin,a flavonoid antioxidant,prevents and protects streptozotocin-induced oxidative stress and beta-cell damage in rat pancreas[J].Pharmacol Res,2005,51(2):117-123.
[6] Ramachandra R,Shetty AK,Salimath PV.Quercetin alleviates activities of intestinal and renal disaccharidases in streptozotocin-induced diabetic rats[J].Mol Nutr Food Res,2005,49(4):355-360.
[7] Cacicedo JM.Palmitate-induced apoptosis in cultured bovine retinal pericytes:roles of NAD(P)H oxidase,oxidant stress,and ceramide[J].Diabetes,2005,54(6):1838-1845.
[8] Krishna KM.Partial reversal by rutin and quercetin of impaired cardiac function in streptozotocin-induced diabetic rats[J].Can J Physiol Pharmacol,2005,83(4):343-355.
[9] Wang YZ.Quercetin and green tea polyphenols inhibit the mitochondrial damages and cytotoxicity induced by VO(acac)2[J].J Chin Pharm Sci,2009,18(3):7.
[10] Wu Y.Transfection of hepatic stimulator substance gene desensitizes hepatoma cells to H2O2-induced cell apoptosis via preservation of mitochondria[J].Arch Biochem Biophys,2007, 464(1):48-56.
[11] Li YH.Caspase-dependent retinal ganglion cell apoptosis in the rat model of acute diabetes[J].Chin Med J(Engl),2008,121(24):2 566-2571.
[12] Chen L.Vitreous levels of stromal cell-derived factor-1 and vascular endothelial growth factor in diabetic retinopathy[J]. Yan Ke Xue Bao,2008,24(1):6-8.
[13] Cicik E.Interleukin-8,nitric oxide and glutathione status in proliferative vitreoretinopathy and proliferative diabetic retinopathy[J].Ophthalmic Res,2003,35(5):251-255.
[14] Du Y,Miller CM,Kern TS.Hyperglycemia increases mitochondrial superoxide in retina and retinal cells[J].Free Radic Biol Med,2003,35(11):1491-1499.
[15] Kowluru RA,Abbas SN.Diabetes-induced mitochondrial dysfunction in the retina[J].Invest Ophthalmol Vis Sci,2003,44(12):5327-5334.
[16] Li L,Renier G.Activation of nicotinamide adenine dinucleotide phosphate (reduced form)oxidase by advanced glycation end products links oxidative stress to altered retinal vascular endothelial growth factor expression[J].Metabolism,2006,55(11): 1516-1523.
[17] Chen BH,Jiang DY,Tang LS.Advanced glycation end-products induce apoptosis involving the signaling pathways of oxidative stress in bovine retinal pericytes[J].Life Sci,2006,79(11):1040-1048.
[18] Kowluru RA.Effect of advanced glycation end products on accelerated apoptosis of retinal capillary cells under in vitro conditions[J].Life Sci,2005,76(9):1051-1060.
[19] Yamagishi S.Pigment epithelium-derived factor(PEDF)prevents diabetes-or advanced glycation end products(AGE)-elicited retinal leukostasis[J].Microvasc Res,2006,72(1-2): 86-90.
[20] Yamagishi S.Pigment epithelium-derived factor inhibits advanced glycation end product-induced retinal vascular hyperpermeability by blocking reactive oxygen speciesmediated vascular endothelial growth factor expression[J].J Biol Chem,2006,281(29):20213-20220.
R733.7
B
1671-8194(2014)11-0064-03
广州市医药卫生科技项目(201102A213221)
*通讯作者:E-mail: zhjinglin@126.com
