枯草芽孢杆菌BJ3-2赖氨酸脱羧酶基因yaaO的克隆与序列分析
2014-04-12蔡传斌罗信旭周景瑞吴拥军
唐 雪,蔡传斌,罗信旭,周景瑞,吴拥军*
(贵州大学 生命科学学院,贵州 贵阳 550025)
假定的赖氨酸脱羧酶(lysine decarboxylase,LDC,EC 4.1.1.18)存在于大多数微生物中,如大肠杆菌(Escherichia coli)、蜂房哈夫尼菌(Hafnia alvei)、尸杆菌(Bacterium cadaveris)、枯草芽孢杆菌(Bacillus subtilis)等。在微生物的合成途径中,LDC可逆的将赖氨酸(lysine)通过脱羧反应生成尸胺[1-2]。该酶是诱导性胞内酶,需要磷酸吡哆醛(pyridoxal 5'-phosphate,PLP)为辅酶促进脱羧反应[3]。
尸胺(1,5-戊二胺)是一种多胺,是生物体内广泛存在的具有生理活性的含氮碱[4]。它是微生物细胞内调节铁离子浓度的“铁亲和系统”的主要组成成分,在关闭孔蛋白通道方面起着重要的作用,而且还是反刍兽新月单胞菌(Selenomonas ruminantium)、嗜碱性韦荣球菌(Veillonella alcalescens)、小韦荣球菌(V.parvula)和解脂厌氧弧菌(Anaerovibrio lipolytica)等一些严格厌氧的格兰氏阴性菌的肽聚糖的组成成分之一。虽然尸胺是广泛存在于生物体中的正常物质,对人体没有直接毒害作用,但它也作为一种肉毒胺存在于腐败物中,也会加强酪胺和组胺对人体解毒作用的影响[5]。
贵州水豆豉发酵是通过微生物自然富集发酵传统工艺,发酵期间主要参与的微生物为食品级安全菌株枯草芽孢杆菌(B.subtilis)。但如果发酵环境控制不当,蛋白腐败也是食品中尸胺的主要来源。豆豉发酵对象大豆富含高蛋白,为控制豆豉发酵过程中过量尸胺的产生,以实验室前期获得的豆豉发酵生产菌株B.subtilisBJ3-2为目标菌株[6],根据GenBank中B.subtilis168标准菌株的yaaO基因序列设计同源引物,PCR扩增B.subtilisBJ3-2基因组DNA,T克隆得到赖氨酸脱羧酶基因yaaO,测序后与NCBI登录的其他枯草芽孢杆菌yaaO序列进行同源性比对分析,分析LDC酶活性结构域和酶活性位点。从而通过控制LDC的表达,降低豆豉发酵过程中生物胺的含量,对于保障食品安全具有一定的指导意义。
1 材料与方法
1.1 材料与试剂
枯草芽孢杆菌(B.subtilis)BJ3-2:本实验室前期分离保存;E.coliDH5α:北京全式金生物技术有限公司;基因组DNA提取试剂盒、pGEM-T载体、溶菌酶(lysozyme)、rTaq酶、T4DNA连接酶、DNA Marker、dNTPs:大连TaKaRa公司;E.Z.N.A.TM Gel Extraction Kit、E.Z.N.A.TM Plasmid Mini KitⅠ:美国Omega公司。
1.2 仪器与设备
C1000TM Thermal Cycler PCR仪、Universal Hood Ⅱ凝胶成像分析仪、PowerPac HC电泳仪:美国Bio-Rad公司;Mini-6K微型离心机:杭州奥盛仪器有限公司。
1.3 方法
1.3.1 引物设计与合成
根据GenBank登录的B.subtilis168菌株(登录号为AL009126.3)的假定的赖氨酸脱羧酶基因yaaO序列,应用Primer Premier 5.0软件设计特异性引物,引物序列:上游引物P1:5'-ATGAACACACCTTTATATAAAG-3';下游引物P2:5'-TCATGATTTCTCCTCTTCT-3';预计扩增片段长度为1 443 bp,由大连TaKaRa公司合成。
1.3.2B.subtilisBJ3-2基因组提取
活化B.subtilisBJ3-2菌株,分离单个菌落,用接种环挑取接种至5 mL的LB液体培养基,于37 ℃摇床140 r/min振荡过夜培养。使用细菌基因组提取试剂盒提取B.subtilisBJ3-2基因组DNA。1%琼脂糖电泳检测基因组的完整性。
1.3.3 目的片段的扩增
以B.subtilisBJ3-2基因组为模板进行PCR扩增。PCR反应体系为10×PCR Buffer 2 μL、dNTPs 1.6 μL、DNA模板1 μL、上下游引物各0.5 μL、Taq酶0.1 μL 补ddH2O至20 μL。反应程序:94 ℃、5 min,94 ℃、40 s,45.5 ℃、40 s,72 ℃、90 s,30个循环,72 ℃、10 min,12 ℃保存。扩增产物在1%琼脂糖凝胶电泳检测。
1.3.4yaaO的克隆与测序
回收纯化PCR产物,连接pGEM-T载体并转化感受态细胞E.coliDH5α。经菌落和质粒PCR验证后,将阳性重组质粒送至大连TaKaRa公司测序。
1.3.5yaaO序列分析
对yaaO基因的核苷酸及氨基酸Blast进行同源性分析。用BioXM2.6、DNAStar7.1、MEGA5、ClustalX1.81软件对氨基酸保守结构域进行分析并绘制LDC遗传进化树。用Swiss-Model及Deep View Version4.1绘制yaaO蛋白三维结构及标注活性位点。
2 结果与分析
2.1 DNA提取及相关基因的PCR扩增
提取基因组经琼脂糖电泳检测,结果(图1)显示,提取的DNA浓度较高,结构完整,无显著降解,可作为模板进行下一步目标基因的扩增。PCR扩增结果使用2%的琼脂糖电泳进行检测。如图2所示,扩增出一条符合1 443 bp大小预期片段。

图1 枯草芽孢杆菌BJ3-2基因组Fig.1 Genome of Bacillus subtilis BJ3-2
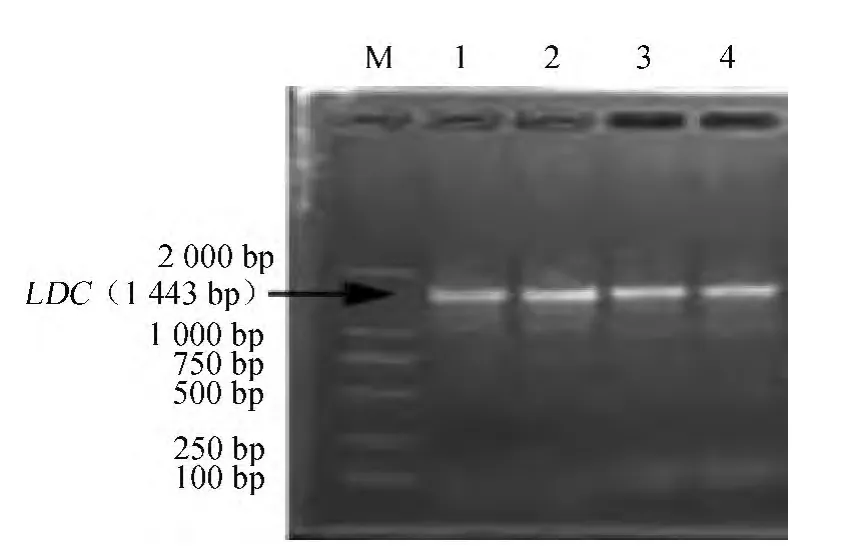
图2 PCR扩增yaaO基因Fig.2 PCR amplification of yaaO
2.2 重组质粒的转化与菌落PCR鉴定
对重组体进行菌落PCR检测,从图3可以看出,约在1 443 bp处有特异性条带出现,与预期基因组PCR扩增yaaO基因的目的条带大小相符,证明获得了阳性的重组菌落。
2.3 阳性菌落的质粒PCR鉴定
将获得的阳性重组菌落接种到液体培养基中进行增菌培养,并提取质粒,进行质粒PCR扩增,结果如图4所示,约在1 443 bp处出现特异性条带,所获得的基因片段大小均与前期PCR扩增产物相吻合,说明目的基因已正确连接到pGEM-T载体内,重组质粒构建成功。将提取的质粒送生物公司测序,并命名为pGEM-yaaO。
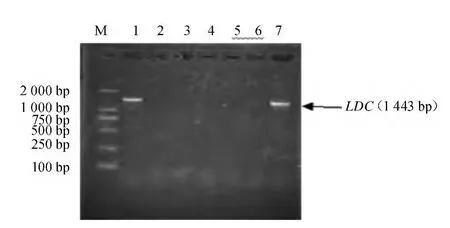
图3 菌落PCR鉴定重组子Fig.3 PCR rapid identification of yaaO gene from recombinant clones
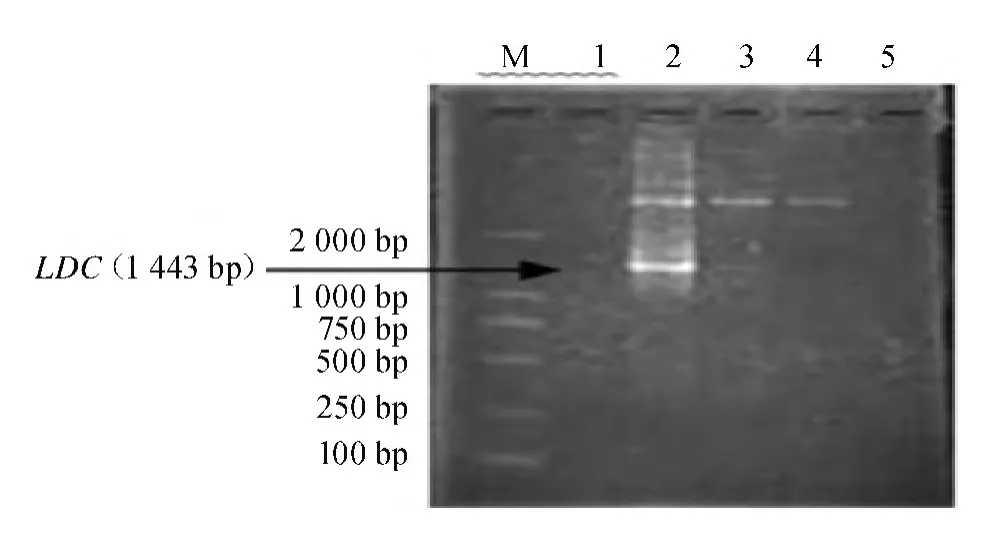
图4 质粒PCR鉴定Fig.4 PCR identification of plasmid
2.4 Bacillus subtilis BJ3-2赖氨酸脱羧酶的同源性分析及系统进化树
使用DNAStar软件对测序结果经行分析后表明,B.subtilisBJ3-2赖氨酸脱羧酶基因yaaO的ORF大小为1443bp,共编码480个氨基酸,起始密码子为ATG,终止密码子为TGA。BioXM2.6软件推测目的基因表达的蛋白质分子质量约为53.22 ku,G+C含量为43.59%,蛋白质等电点(pI)为6.23,其中酸性氨基酸19.8%,碱性氨基酸占13.5%。将基因序列提交至美国国家生物技术信息中心(national center of bio-technology information,NCBI)获得基因登录号KJ561349。
将所克隆的目的基因及推测表达的蛋白质序列在NCBI数据库中进行同源性比对分析。结果表明,B.subtilisBJ3-2的yaaO基因与已报道枯草芽孢杆菌的yaaO基因序列和蛋白序列高度同源,都高达91%以上。与B.subtilis168菌株目的基因的基因序列高度同源达94%,yaaO氨基酸序列高度同源达96%。通过与其他枯草芽孢杆菌的(yaaO)的核苷酸序列比对,序列同源性最高的是Bacillussp.JS(yaaO),达到99%;与枯草杆菌其他种(yaaO)序列同源性也在91%以上。表明本实验所克隆的目的基因为赖氨酸脱羧酶基因。
B.subtilisBJ3-2赖氨酸脱羧酶氨基酸序列与芽孢杆菌JS(Bacillussp.JS)同源性最高,为99%。与其他枯草芽孢杆菌(Bacillus subtilis)假定的赖氨酸脱羧酶氨基酸序列同源性都高达91%以上。其中,与B.subtilisE1精氨酸/赖氨酸氨基酸同源性高达96%;与巴氏芽孢杆菌八叠球菌(Sporosarcina pasteurii)的精氨酸/赖氨酸/鸟氨酸脱羧酶氨基酸序列同源性也高达96%;与B.subtilisMB73/2菌株转氨酶第四家族蛋白(aminotransferase class-V family protein)同源性高达96%;与Bacillussp.BSC154同源性高达95%。
B.subtilisBJ3-2 LDC基因同B.subtilisBJ3-2的精氨酸脱羧酶(arginine decarboxylation,ADC)一样,同属于PLP依赖型脱羧酶家族的氨基酸保守结构域。作为大多数细菌磷酸吡哆醛(PLP)依赖型脱羧酶的代表——乳酸菌(Lactobacillussp.30a)鸟氨酸脱羧酶家族(ornithine decarboxylase family),具有Ⅲ型PLP型脱羧酶的活性位点、PLP结合位点以及二级结构特征。如图5所示,选择Lactobacillussp.30a的鸟氨酸脱羧酶(ornithine decarboxylase,ODC)氨基酸序列和B.subtilisBJ3-2的ADC氨基酸序列,对照B.subtilisBJ3-2的LDC氨基酸序列进行比对。如图6所示,选择高度同源的枯草芽孢杆菌其他菌株LDC序列以及李斯特单核细胞增生菌EGD-e菌株(Listeria monocytogenesEGD-e)的LDC作为厚壁菌门代表,结构域不同的大肠杆菌(E.coliATCC 8739)LDC序列作为参比,增加LDC氨基酸序列所特有保守序列及酶活性位点推测的可靠性。

图5 B.subtilis BJ3-2ADC/LDC和Lactobacillus sp.30a ODC的氨基酸多序列比对Fig.5 Amino acid sequence alignments of B.subtilis BJ3-2 ADC/LDC and Lactobacillus sp.30a ODC
赖氨酸脱羧酶作为精氨酸/赖氨酸/鸟氨酸脱羧酶家族成员之一,该家族又属于吡哆醛磷酸盐(PLP)依赖型天冬氨酸转氨酶(aspartate aminotransferase,AST)超级大家族。从图5和图6对氨基酸脱羧酶结构域分析显示:B.subtilisBJ3-2 LDC与B.subtilisBJ3-2 ADC一样,属于丙氨酸消旋酶家族,在序列的N端含有赖氨酸(单字母缩写为K)的保守序列[AS]-V-[IV]-K-A[DN]-A-Y-G-H-G,几乎在所有丙氨酸消旋酶的氨基酸序列存在[7]。且具有PLP依赖型脱羧酶家族的氨基酸保守结构域,即PLP活性位点,包括[FDSAW]、[RNNHKSVYNSA]、[S-X-H-K],属于典型的Ⅲ型PLP依赖型鸟氨酸/赖氨酸/精氨酸脱羧酶家族成员。[FDSAW]是所有氨酸转氨酶/氨基酸脱羧酶共有的保守结构域,与蛋白二级结构β-折叠有关。[S-X-H-K]序列中Lys(K)是PLP依赖型脱羧酶的活性位点,PLP通过与Lys氨基酸残基形成醛亚胺键(席夫碱),使酶具有催化活性[8-9]。[RNNHKSVYNSA]序列中的His氨基酸残基改变分子极性作用,是所有脱羧酶及一些其他PLP依赖型酶共有结构域,推测其与催化作用有重要关系[10]。

图6 B.subtilis BJ3-2和其他细菌LDC/ODC的氨基酸多序列比对Fig.6 Amino acid sequence alignments of LDC/ODC of B.subtilis BJ3-2 and other bacteria
从图6可以看出,B.subtilisBJ3-2 ADC、B.subtilisBJ 3-2 LDC与Lactobacillussp.30a ODC中还存在[PGHQGG]、[LGDL]、[GD]、[TYDG]、[SPFYPMYAALD]、[DPNK]、[YPPG]高度保守结构域,与赖氨酸脱羧酶家族推测的保守结构域[PGGXGTXXE]得到印证[11]。与图7相比,[GD]、[TYDG]结构域没有显示出高度保守的结构特征,推测[GD]、[TYDG]结构域可能是鸟氨酸/赖氨酸/精氨酸脱羧酶家族(Orn/Lys/Arg decarboxylase family)所特有的保守结构域,而[GSS]是两图对比所共有的结构域,刘艳敏[12]对枯草芽孢杆菌BJ3-2 与其他枯草芽孢杆菌ADC序列同Lactobacillussp.30a ODC 比对发现[PGEK]是B.subtilisBJ3-2 ADC特有的结构域,而[GVPATI]是B.subtilisBJ3-2 LDC与Lactobacillussp.30a ODC特有的结构域,推测该结构域为辅助因子,对鸟氨酸/赖氨酸/精氨酸脱羧酶的不同代谢的调控具有重要意义。
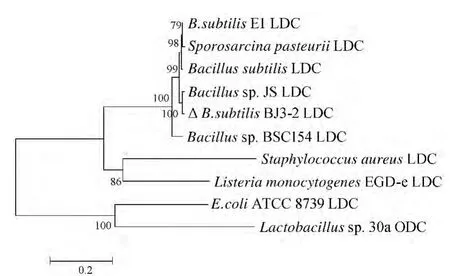
图7 不同细菌的精氨酸/鸟氨酸脱羧酶氨基酸序列遗传进化树Fig.7 Phylogenetic tree constructed with amino acid sequences of different bacteria LDC/ODC
从图7遗传图谱可以看出,枯草芽孢杆菌LDC均属于遗传距离较近的同一进化分支。B.subtilisBJ3-2的与Bacillussp.JS的LDC的遗传距离最近;与厚壁菌门金黄色酿脓葡萄球菌(Staphylococcus aureus)和单核细胞增多性李斯特氏菌(Listeria monocytogenes)EGD-e的LDC遗传距离次之;与E.coliATCC 8739 LDC以及Lactobacillussp.30a ODC遗传距离最远。以上结果表明,B.subtilisBJ3-2与乳酸菌及其他厚壁菌门细菌的遗传距离接近,具有PLP依赖型脱羧酶家族的氨基酸保守结构域,属于典型的Ⅲ型PLP依赖型鸟氨酸/赖氨酸/精氨酸脱羧酶家族(Orn/Lys/Arg decarboxylase family)成员。
2.5 Bacillus subtilis BJ3-2 LDC蛋白质三维结构预测
使用SWISS-MODEL在线分析[13],输入Bacillus subtilisBJ3-2 LDC氨基酸序列进行在线蛋白质三维结构预测。结果显示,该蛋白质与数据库里的耐甲氧西林金黄色葡萄球菌(methicillin-resistantStaphylococcus aureus)的鸟氨酸/赖氨酸/精氨酸脱羧酶家族蛋白质SAR0482同源性(identity)最高,为39.22%。Deep View Version1.3对该序列进行编辑,预测的蛋白质三维结构,如图8所示,Ser-X-His-Lys是经典的脱羧酶的指纹图谱序列[14]。
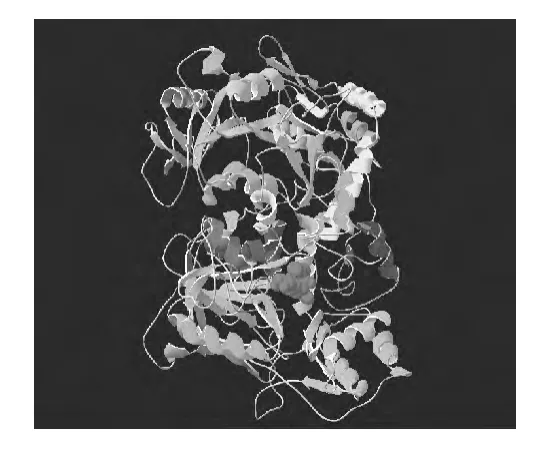
图8 B.subtilis BJ3-2 LDC蛋白质三维结构Fig.8 B.subtilis BJ3-2 LDC three dimensional protein structure
3 结论
经多序列氨基酸比对,B.subtilisBJ3-2的LDC包含PLP依赖型脱羧酶家族的氨基酸保守结构域。转氨酶的辅因子为磷酸吡哆素,通过磷酸吡哆醛(PLP)与磷酸吡哆胺(phosphopyridoxamine,PMP)的转化,形成希夫碱中间产物,使一个氨基酸转变为α-酮酸,另一个α-酮酸转变为新的氨基酸[15]。通过对赖氨酸脱羧酶氨基酸的序列分析,推测其鸟氨酸/赖氨酸/精氨酸脱羧酶家族保守结构域和蛋白二级结构及酶催化活性位点。从其代谢途径出发,通过分析LDC酶活性结构,为控制豆豉发酵过程中生物胺-尸胺含量,提供一定的理论基础。
[1]TAKAHASHI E,FURUI M,SEKO H.d-Lysine production from l-lysine by successive chemical racemization and microbial asymmetric degradation[J].Appl Microbiol Biotechnol,1997,47(4):347-351.
[2]DELAS R B,MARCOBAL A,CARRASCOSA A V,et al.PCR detection of foodborne bacteria producing the biogenic amines histamine,tyramine,putrescine and cadaverine[J].J Food Protect,2006,69(10):2509-2514.
[3]孟 甜.乳酸菌产生物胺的鉴定及食品中生物胺的检测[D].无锡:江南大学硕士论文,2010.
[4]蒋丽丽,吴晓燕,刘 毅,等.赖氨酸脱羧酶发酵工艺及酶学性质[J].精细化工,2006,23(11):1060-1063.
[5]朱 婧.微生物转化L-赖氨酸为尸胺的研究[D].天津:天津科技大学硕士论文,2009.
[6]贾东旭,吴拥军,李耀中,等.细菌型豆豉发酵芽孢杆菌的筛选与鉴定[J].食品科学,2009,30(5):217-221.
[7]张彩凤,徐书景,李艳红,等.丙氨酸消旋酶的研究进展[J].安徽农业科学,2011,39(15):8836-8839.
[8]GANI D.A structural and mechanistic comparison of pyridoxal 5'-phosphate dependent decarboxylase and transaminase enzymes[J].Philos Trans R Soc Lond B Biol Sci,1991,332(1263):131-139.
[9]LEE Y S,CHO Y D.Identification of essential active-site residues in ornithine decarboxylase of nicotiana glutinosa decarboxylating both L-ornithine and L-lysine[J].Biochem Soc,2001,360(3):657-665.
[10]MOMANY C,GHOSH R,HACKERT M L.Structural motifs for pyridoxal-5'-phosphate binding in decarboxylases:an analysis based on the crystal structure of theLactobacillus30a ornithine decarboxylase[J].Protein Sci,1995,4(5):849-854.
[11]逯明辉,李晓明,陈劲枫,等.黄瓜发芽期耐冷性与赖氨酸脱羧酶基因表达[J].中国农业科学,2005,38(12):2492-2495.
[12]刘艳敏,卢 彪,沈玺龙,等.枯草芽孢杆菌BJ3-2 精氨酸脱羧酶基因SpeA的克隆与序列分析[J].中国酿造,2014,33(5):39-43.
[13]GUEX N,PEITSCH M C,SCHWEDE T.Automated comparative protein structure modeling with SWISS-MODEL and Swiss-PdbViewer:A historical perspective[J].Electrophoresis,2009,30(1):162-173.
[14]GABRIELE S,SIEGRID T,THOMAS H,et al.Lysine decarboxylase in plants and its integration in quinolizidine alkaloid biosynthesis[J].Phytochemistry,1983,22(1):65-69.
[15]白俊琴.枯草芽孢杆菌lipA基因表达的研究[D].天津:天津大学硕士论文,2009.
