磁流体热疗联合IL-2对小鼠Lewis肺癌治疗作用的实验研究
2014-04-12胡润磊柯贤福李浒马胜林王国卿魏东山
胡润磊 柯贤福 李浒 马胜林 王国卿 魏东山
磁流体热疗联合IL-2对小鼠Lewis肺癌治疗作用的实验研究
胡润磊 柯贤福 李浒 马胜林 王国卿 魏东山
目的 通过观察磁流体热疗(MFH)联合IL-2对小鼠Lewis肺癌的生长、凋亡及小鼠免疫系统的影响,探讨MFH联合免疫治疗肺癌的可行性。方法建立小鼠浅表Lewis肺癌皮下移植瘤模型,瘤体直径增至0.8cm左右时,将其分为IL-2组、MFH组、MFH+IL-2组及对照组。MFH组瘤体内部注射0.2ml水平约75mg/ml的磁流体,24h后在交变磁场下加温1次,通过控制磁场的强度,加温温度稳定在43.0℃左右30min。IL-2组瘤体内部注射0.2ml(5×104U)的IL-2。MFH+IL-2组热疗后24h,按上述方法向肿瘤内部注射0.2ml(5×104U)的IL-2。对照组瘤体内部注射0.2ml的0.9%氯化钠溶液。采用流式细胞术检测MFH法、MFH+IL-2后小鼠外周血T淋巴细胞亚群的变化。采用免疫组化法检测治疗后肿瘤组织HSP70、CD4+、CD8+等免疫因子的表达,比较MFH组、MFH+IL-2组对肿瘤的治疗效果。结果MFH组和MFH+IL-2组注射磁流体后肿瘤内部温度迅速升高至43℃,肿瘤细胞呈凋亡和坏死样改变,小鼠外周血T淋巴细胞水平明显升高(P<0.05),HSP70、CD4+、CD8+水平也均明显升高,小鼠瘤体生长均受到抑制,MFH+IL-2组小鼠瘤体生长抑制更明显。结论43℃、30min条件下的MFH能抑制Lewis肺癌的生长,诱导荷瘤小鼠机体产生抗肿瘤免疫。IL-2单独对荷瘤小鼠肿瘤生长无明显抑制作用,但可以提高外周血CD4+、CD8+水平,从而增强MFH对Lewis肺癌抑瘤效果。
磁流体 热疗 肺癌 免疫
磁流体热疗(magnetic fluid hyperthermia,MFH)是近年肿瘤治疗的研究热点,系将磁流体通过直接注射或动静脉注射的方式到达肿瘤区域,外加交变磁场,使电场的能量集中到磁流体聚集的特定部位并升温至一定程度,从而杀死肿瘤细胞。由于周围正常组织没有或很少有磁流体的分布,不升温或升温不明显,因此MFH治疗具有高度的靶向性和特异性[1]。研究表明,热疗可诱导机体产生抗肿瘤免疫[2],热疗尤其是MFH联合免疫治疗恶性肿瘤是一个较新的研究领域。本研究采用MFH联合IL-2对肺癌进行实验研究,观察MFH联合免疫治疗对小鼠Lewis肺癌生长、凋亡以及小鼠免疫系统的影响,探讨MFH联合这一方法肺癌的可行性,现将结果报道如下。
1 材料和方法
1.1 材料
1.1.1 主要试剂 胰蛋白酶、细胞培养基粉(RPMI 1640)及抗小鼠HSP70、CD4+、CD8+免疫组化单克隆抗体由杭州昊天生物有限公司提供。抗小鼠CD4+、CD8+流式细胞单克隆抗体由美国BD公司提供。重组人IL-2(国药准字S20040008)由北京四环制药有限公司提供。
1.1.2 细胞株 Lewis肺癌细胞株由杭州昊天生物有限公司提供,采用含10%胎牛血清RPMI 1640培养液进行培养。
1.1.3 磁流体 纳米级Fe3O4颗粒采用化学共沉淀法制成胶体混悬液,呈黑色,样品粒径范围为10~40nm,磁饱和强度360GS。Fe3O4颗粒样品使用前均以超声波处理5min,使其分布更均匀。
1.1.4 主要仪器设备 SP-04AC型4kW高频感应加热机由深圳市双平电源技术有限公司提供,频率为100~250kHz,感应线圈由4匝直径为4mm的铜管平行绕成内径为3cm,长为4cm的线圈,铜管内通循环水。YF-200型光纤温度传感器由西安永泰传感有限公司提供,FACSCalibur型流式细胞仪由美国BD公司提供。
1.1.5 实验动物 6~8周龄C57BL/6小鼠[实验动物生产许可证SCXK(浙)2008-0035,使用许可证SYXK(浙)2008-0113]60只,均为雌性,质量20~24g,由浙江省医学科学院实验动物中心提供并饲养,中心实验动物屏障系统,空气洁净度万级,换气次数15次/h,温度21~24℃,湿度75%~80%。
1.2 实验方法
1.2.1 Lewis肺癌细胞的复苏传代 将液氮冻存的Lewis肺癌细胞悬液取出,置于37.0℃水浴中充分融化冰块,低速离心,弃去上清液,采用1640培养液稀释后接种于小鼠右胁部皮下,接种3只。
1.2.2 肿瘤模型的建立 待复苏传代的肿瘤增至直径约2.0cm时,处死小鼠,剥离健康瘤组织,选取生长良好的肿块,按肿瘤(g):0.9%氯化钠注射液(ml)=1:3比例匀浆,调细胞数约为1.0×107/ml,于每只小鼠右侧胁部皮下接种此悬液0.2ml。接种后第4天开始观察肿瘤生长情况,隔天用游标卡尺测量上述瘤体的大小,并以下列公式计算肿瘤体积:V=1/2ab2(a为肿瘤的长径,b为垂直于长径的短径)。
1.2.3 实验分组 接种后第4天左右即有瘤体长出,待瘤体长至直径约(0.8±0.1)cm,采用随机数字表法分为4组,每组15只。MFH组瘤体内部一次进针、多点注射0.2ml水平约75mg/ml的磁流体,24h后在交变磁场下加温1次,通过控制磁场的强度,加温温度稳定在43.0℃左右30min。免疫治疗组(IL-2组)瘤体内部一次进针、多点注射0.2ml(5×104U)的IL-2。免疫联合MFH组(MFH+IL-2组)热疗后24h,按上述方法向肿瘤内部注射0.2ml(5×104U)的IL-2。对照组瘤体内部一次进针、多点注射0.2ml的0.9%氯化钠注射液。
1.2.4 观察指标 (1)小鼠的一般情况。(2)治疗后肿瘤体积的变化。(3)根据瘤体的体积计算各组的肿瘤体积抑制率。肿瘤体积抑制率=(1-实验组瘤体体积/对照组瘤体体积)×100%。(4)治疗后肿瘤质量变化。(5)治疗后2周处死所有小鼠,剥除瘤体,称重,根据瘤体的质量计算各组的肿瘤质量抑制率,肿瘤质量抑制率=(1-实验组瘤体质量/对照组瘤体质量)×100%。
1.2.5 光镜观察热疗后肿瘤病理组织学变化 加温后48h,各组随机挑选3只小鼠,脱颈处死,取出瘤体,甲醛溶液固定,石蜡包埋切片,HE染色,光学显微镜下观察肿瘤细胞的变化。
1.2.6 流式细胞术检测荷瘤小鼠外周血CD4+、CD8+的变化 热疗后1周,每组随机挑选4只小鼠,眼球取血0.5ml,20U/L肝素抗凝,离心,弃上清,沉淀物加磷酸盐缓冲液(PBS)重悬,用淋巴细胞分离液分离制备淋巴细胞,调整细胞水平至1×106/ml,免疫荧光进行染色(按照试剂盒方法进行),染色后采用流式细胞仪及CellQuest软件分析各组T淋巴细胞亚群阳性细胞的百分率。
1.2.7 免疫组化检测肿瘤组织中HSP70、CD4+、CD8+表达 继续将上述甲醛固定肿瘤组织中HSP70、CD4+、CD8+进行免疫组化检测。采用PBS代替一抗作为阴性对照,具体步骤按试剂盒方法进行操作。
1.3 统计学处理 采用SPSS 13.0统计软件,计量资料采用表示,两组间比较采用t检验。
2 结果
2.1 小鼠接种肿瘤后的一般情况 移植瘤成瘤率100%,成瘤时间为细胞种植后第4~7天,集中在第8~10天。细胞种植后第14天,肿瘤直径平均可达0.8cm。成瘤后早期小鼠的质量和活动情况没有明显改变,但随着肿瘤形成并逐渐增大,小鼠逐渐消瘦,活动减少。
2.2 磁流体在肿瘤内部升温情况 注射磁流体后,瘤体内部的温度迅速升高至43.0℃,通过控制磁场强度将温度稳定在43.0℃左右,并维持30min,而小鼠肛门的温度稳定在32.0℃左右。
2.3 病理组织学变化
2.3.1 大体观察 治疗后,IL-2组、对照组肿瘤进行性增长;MFH组大部分瘤体表面结痂,2~3d出现局部坏死,坏死脱落后表面凹凸不平,肿瘤生长明显减慢;MFH+IL-2组瘤体生长较MFH组更为缓慢。
2.3.2 光镜观察 IL-2组和对照组的瘤体生长旺盛,细胞核浓染,偶而可见核分裂像,肿瘤中心部位可见少量坏死的组织。MFH组、MFH+IL-2组的瘤体在加温后出现大量呈凋亡形态的肿瘤细胞,表现为核固缩,染色质边聚、浓缩;部分区域出现凝固性坏死的征象,表现为嗜酸性增强,正常细胞结构消失,核碎裂、溶解;在凋亡和坏死的一些区域偶可见出血灶,可见磁流体分布于凋亡和坏死的区域中。散在的磁流体在一定范围内分布于肿瘤细胞之间(图1)。

图1 光镜下各组瘤体病理学变化(A:MFH组;B:IL-2组;C:MFH+IL-2组;HE染色,×100;D:对照组)
2.4 热疗后外周血T淋巴细胞变化 治疗后各组小鼠T淋巴细胞亚群的变化见表1。
表1 治疗后各组小鼠T淋巴细胞亚群的变化()

表1 治疗后各组小鼠T淋巴细胞亚群的变化()
注:与对照组比较,*P<0.05
组别MFH组IL-2组MFH+IL-2组对照组CD4+(%)29.98±0.32*29.37±0.75*36.93±1.09*26.90±0.83 CD8+(%)14.89±0.59 15.09±0.12*16.34±0.47*14.71±0.17 CD4+/CD8+2.02±0.07*1.94±0.04*2.26±0.10*1.83±0.04
2.5 热疗后肿瘤组织中HSP70以及CD4+、CD8+表达情况 免疫组化提示HSP70在MFH组和MFH+IL-2组中明显表达,在IL-2组和对照组表达不明显(图2)。CD4+和CD8+在对照组和IL-2组中极少表达,而在MFH组和MFH+IL-2组表达明显增高(图3、4)。
2.6 治疗效果 治疗后,IL-2组和对照组肿瘤生长受到抑制不明显,而在MFH组和MFH+IL-2组,小鼠的瘤体生长速度变慢(图5)。治疗后2周,MFH组、IL-2组、MFH+IL-2组及对照组小鼠瘤体体积及小鼠瘤体质量比较见表2。

图2 免疫组化检测HSP70在各组的表达(A:IL-2组和对照组表达不明显,B:MFH组和MFH+IL-2组明显表达,HE染色,×200)
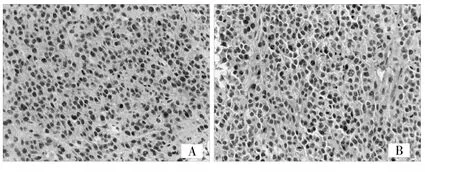
图3 免疫组化检测肿瘤组织中CD4+的表达(A:IL-2组和对照组表达不明显,B:在MFH组和MFH+IL-2组中明显表达,HE染色,×200)
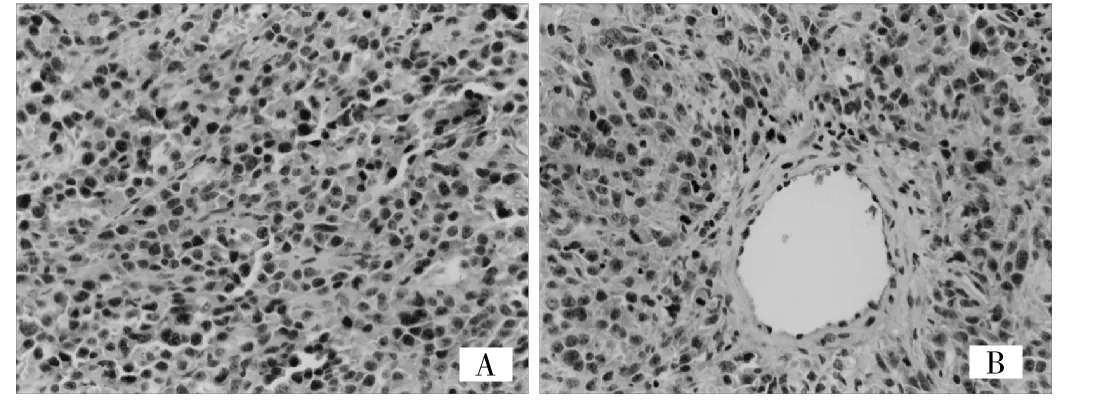
图4 免疫组化检测肿瘤组织中CD8+的表达(A:IL-2和对照组中,CD4+表达不明显,B:在热疗组和MFH+IL-2组中明显表达,HE染色,×200)
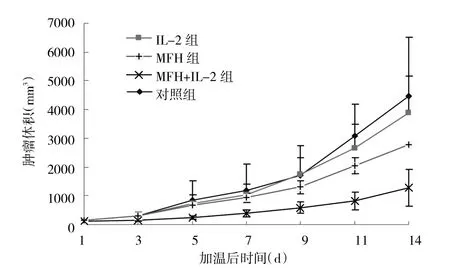
图5 热疗后各组小鼠瘤体生长趋势图
3 讨论
肺癌是严重危害人们生命健康的常见疾病,手术治疗、化疗以及放疗可使部分患者受益。但大部分病例发现均属晚期,手术效果差;放化疗由于毒副作用大,多数患者不能耐受。传统的热疗作用的方法,如射频、微波、超声等都有加温的特异性差,不能针对某一特定靶区加温,明显降低热疗效果。因此探索一种治疗效果好且不良反应小的热疗方法成为了研究课题。我们将MFH对小鼠Lewis肺癌移植瘤进行治疗实验,结果证实磁流体在肿瘤内部可以升温至有效的治疗温度,通过调节磁场电流将温度控制在43℃左右,而小鼠肛门温度却稳定在32℃左右,说明周围正常组织没有明显的升温,初步实现了MFH的靶向性。

表2 热疗后2周各组小鼠瘤体体积和质量比较
近些年来的基础研究表明,肿瘤热疗后会产生HSP,其中HSP70与免疫的关系越来越引起关注。研究证实,HSP70可提高机体内的多种趋化因子水平,提高肿瘤细胞表面主要组织相容性复合体类抗原的表达,促进树突状细胞的成熟[2-3],从而诱导机体产生抗肿瘤免疫[4]。
研究表明,肿瘤的免疫方面主要是细胞免疫发挥更重要的作用[5],T细胞介导的肿瘤细胞免疫有两种形式,即通过CD4+和CD8+来实现的。CD4+T淋巴细胞主要是产生IL-2、IFN-γ、TNF-a等细胞因子诱导CD8+T淋巴细胞,还可以通过诱导、活化抗原递呈细胞(APC),增加APC的抗原递呈能力及其共刺激信号的表达,更高效地激活CD8+T淋巴细胞。我们的结果研究发现,43℃的MFH可以使小鼠的皮下移植瘤HSP70的表达明显增加,CD4+、CD8+的表达也明显增加;通过对荷瘤小鼠外周血的T淋巴细胞亚群CD4+、CD8+的检测,表明MFH明显提高外周血CD4+、CD8+的水平,CD4+/CD8+比值明显升高,说明MFH能提高肿瘤局部HSP70表达,诱导荷瘤小鼠机体产生抗肿瘤免疫。
IL-2是活化的T细胞产生的淋巴细胞因子,同时也是人体重要的免疫调节因子,可以通过与其他免疫因子相互协同,诱导T淋巴细胞的增殖,增加细胞毒T淋巴细胞的活性,诱导辅助性T淋巴细胞及NK细胞的活性。在恶性黑色素瘤和肾癌的研究中发现,IL-2可以激活淋巴因子,增加淋巴细胞的活性,从而产生抗肿瘤作用[6-7]。我们的研究结果显示,IL-2组荷瘤小鼠外周血CD4+、CD8+明显升高,但在肿瘤组织中CD4+、CD8+无明显表达,该组的肿瘤生长未受到明显的抑制。说明IL-2单独应用的对肺癌的抗肿瘤效果较差,可能与IL-2在免疫调节中与T淋巴细胞自主调节有关[8],具体的机制有待于进一步研究。
通过对各组荷瘤小鼠的抗肿瘤效果的分析,IL-2组小鼠瘤体生长抑制不明显,MFH组和MFH+IL-2组瘤体生长受到抑制,其中MFH+IL-2组的抑瘤效果最明显,说明IL-2能增强MFH对Lewis肺癌抑瘤效果。
本研究表明,43℃、30min条件下的MFH能明显抑制Lewis肺癌的生长,提高荷瘤小鼠外周血和肿瘤组织CD4+、CD8+的水平,诱导荷瘤小鼠机体产生抗肿瘤免疫反应。LI-2单独对荷瘤小鼠肿瘤生长无明显抑制,可以提高外周血CD4+、CD8+水平。IL-2能增强MFH对Lewis肺癌抑瘤效果。
[1] Li X H,Rong P F,Jin H K,et al.Magnetic fluid hyperthermia induced by radiofrequency capacitive field for the treatment of transplanted subcutaneous tumors in rats[J].Exp Ther Med, 2012,3(2):279-284.
[2]Chen T,Guo J,Han C,et al.Heat shock protein 70,released from heat-stressed tumor cells,initiates antitumor immunity by inducing tumor cell chemokine production and activating dendritic cells via TLR4 pathway[J].J Immunol,2009,182(3):1449-1459.
[3]Torigoe T,Tamura Y,Sato N.Heat shock proteins and immunity:application of hyperthermia for immunomodulation[J].Int J Hyperthermia,2009,25(8):610-616.
[4]Kobayashi T.Cancer hyperthermia using magnetic nanoparticles [J].Biotechnol J,2011,6(11):1342-1347.
[5]Koido S,Homma S,Hara E,et al.Regulation of tumor immunity by tumor/dendritic cell fusions[J].Clin Dev Immunol,2010;2010:516768.
[6]Quan W D Jr,Quan F M.High-dose intensity pulse interleukin-2 with famotidine in metastatic kidney cancer[J].Cancer Biother Radiopharm,2009,24(2):181-183.
[7] Quan W D Jr,Walker P R,Picton M,et al.High-dose intensity pulse interleukin-2 with famotidine has activity in metastatic melanoma[J].Cancer Biother Radiopharm,2008,23(5):641-646.
[8]Waldmann T A,Cooper M A,Caligiuri M A.Inerleukin-2 an Inerleukin-15:implications for cancer therapy and vaccine design[J].Nat Rev Immunol,2006,6(8):595-601.
Combination of magnetic fluid hyperthermia with inerleukin-2 for treatment of Lewis lung carcinoma in mice
ObjectiveTo investigated the combination of magnetic fluid hyperthermia (MFH)with immunotherapy for treatment of Lewis lung carcinoma in mice.MethodsThe mouse Lewis lung cancer model was induced by subcutaneous infection of tumor cells,the tumor-bearing mice were divided into 4 groups:control group,IL-2 group,MFH group and MFH+IL-2 group when the tumor diameter reached 0.8cm.Magnetic fluids were prepared in vitro and directly injected into tumors.Twenty-four hours later,the mice were subjected to an alternating magnetic field.The temperature in the tumor was increased to 43.0℃,which was maintained for 30 min with a stable strength of magnetic field.At 24h after MFH,IL-2 was injected directly into the tumor in MFH+IL-2 group.Peripheral CD4+and CD8+T-lymphocytes were analyzed by flow cytometry,CD4+,CD8+and HSP70 in tumors were detected by immunohistochemistry staining.ResultsCombined magnetic fluid hyperthermia and immunotherapy significantly inhibited the growth of the tumors(P<0.05).Histological analysis demonstrated that the tumor cells underwent apoptosis and necrosis,HSP 70,CD4+and CD8+cells were significant increased after treatment(P<0.05).ConclusionCombined magnetic fluid hyperthermia and immunotherapy can improve the therapeutic efficacy for Lewis lung cancer in mice.
Magnetic fluid Hyperthermia Lung cancer Immunotherapy


2013-06-24)
(本文编辑:杨丽)
浙江省医药卫生科学研究基金(2009A163);杭州市科技发展计划项目(20080333B02);杭州市医药卫生重点计划(2012Z002)
310006 杭州市第一人民医院胸外科(胡润磊、李浒、王国卿、魏东山),放疗科(马胜林);浙江省医学科学院实验动物中心(柯贤福)
胡润磊,E-mail:hurunlei@163.com
