复方柔肝中姜黄素类成分大鼠药代动力学特征
2014-04-11宿树兰管汉亮钱叶飞钱大玮段金廒
任 浩, 宿树兰, 管汉亮, 钱叶飞, 钱大玮, 段金廒
(南京中医药大学 江苏省方剂高技术研究重点实验室, 江苏 南京 210023)
[制 剂]
复方柔肝中姜黄素类成分大鼠药代动力学特征
任 浩, 宿树兰, 管汉亮, 钱叶飞, 钱大玮*, 段金廒
(南京中医药大学 江苏省方剂高技术研究重点实验室, 江苏 南京 210023)
目的 研究复方柔肝 (黄芪、姜黄、 丹参和熊胆粉) 中姜黄素和双去甲氧基姜黄素在大鼠体内药代动力学特征。 方法 将 SD大鼠随机分为3组, 分别灌胃姜黄素和双去甲氧基姜黄素混合物、 姜黄提取物、 复方柔肝提取物,并采集血浆样本。 利用 UPLC-TQ/MS 测定大鼠血浆中姜黄素和双去甲氧基姜黄素, 以多反应监测方式进行正离子检测, 应用 DAS 3.2 计算并比较各组药动学参数。 结果 姜黄素在姜黄素和双去甲氧基姜黄素混合物、 姜黄提取物和复方柔肝提取物中 T1/2、 Tmax并无显著性差异, 而复方柔肝提取物中 Cmax、 AUC0~T明显高于姜黄提取物、 姜黄素和双去甲氧基姜黄素混合物, 姜黄素在姜黄提取物和复方柔肝提取物中 MRT0~T略小于姜黄素和双去甲氧基姜黄素混合物,双去甲氧基姜黄素 Tmax其他药动学参数均无显著性差异。 结论 复方柔肝配伍显著提高姜黄素 Cmax, 增加了其生物利用度,并加快双去甲氧基姜黄素体内吸收速度,但对其生物利用度影响不大。
姜黄素;双去甲氧基姜黄素;药代动力学;复方柔肝
姜黄是姜科植物姜黄 Curcuma longa L.的干燥根茎,其主要活性成分为姜黄素类化合物,包括姜黄素、 去甲氧基姜黄素和双去甲氧基姜黄素[1]。现代研究表明姜黄素类化合物具有抗氧化、抗炎、降血脂和保肝等广 泛的药理活 性[2-4]。 复方 柔肝为临床有效经验方,由黄芪、姜黄、丹参和熊胆粉四味中药配伍组合而成,具有解毒散结、益气活血、行气止痛之功效,临床适用于湿热毒邪久盛、瘀结肝络、伤正耗气、虚损生积之症,主要用于治疗肝纤维化, 多年临床应用, 疗效显著[5]。 姜黄是复方柔肝中的主要组成药味,所含姜黄素类成分为抗肝纤维化的主要活性成分。
国内外关于姜黄素类成分的药动学的研究已有报道[6-7], 但大 多侧 重 于 单独 化 合 物药 动 学 研 究。而临床用药多采用中药饮片或复方用药,因此,现有研究结果难以客观反映复方用药时姜黄素类成分在体内药动学特征。与单体的给药方法相比,混合给药方法的结果更接近于中药的临床实际,应考虑中药本身所含其他成分及 复 方 配伍后的影 响[8]。同时中药复方药动学研究是中药新药临床前研究的重要组成部分,为中药剂型的设计、生产工艺路线的选择和质量的评价与监控提供了有效的手段与方法,从而保证药物本身应有的安全、有效和稳定[9]。 因此 本 实 验基 于 UPLC-TQ/MS 联 用 技 术,选取姜黄素和双去甲氧基姜黄素[10]为指标性成分,建立了姜黄素类成分灵敏有效的分析方法,并对复方柔肝配伍前后姜黄素类成分在大鼠体内的药代动力学特征进行研究,以期为复方柔肝配伍的机理研究和临床应用提供科学依据。
1 实验材料
1.1 仪器及试药 ACQUITYTMUPLC超高效液相色谱系统, LABCONCO CentriVap 离心浓缩仪 ( 美国 LABCONCO 公 司); XevoTMTQ 质 谱 系 统 和Masslynx 4.1 质谱工作站软件 (Waters公司); Sartorius BT1250 电子天平 ( 北京赛多利斯科学仪器有限公司); EPED超纯水机 (南京易普易达科技发展有限公司);TDL240B离心机 (上海安亭科学仪器厂)。 姜黄素 (110823-201004, 中国药品生物制品检定所, 供含量测定用); 双去甲氧基姜黄素(A0088) 购自成都曼思特生物科技有限公司 (经HPLC面积归一化法纯度检查达到 98%)。 乙腈、甲醇 ( 色谱纯, Tedia), 甲酸 (色谱纯,Merck),乙酸乙酯 (分析纯, 南京化学试剂有限公司), 超纯水 (自制)。 姜黄、 黄芪和丹参药材均购自南京药业股份有限公司,按 《中国药典》 2010 年版项下要求检验均符合标准。
1.2 实验动物 清洁级 SD大鼠, 雄性, 体质量(250 ±20)g,由上海斯莱克实验动物有限责任公司提供, 许可证号 SCXK (浙) 20080033。
2 实验方法
2.1 对照品溶液的制备 分别精密称取姜黄素和双去甲氧基姜黄素 1.25 mg和 1.29 mg,加甲醇配制成质量浓度为 125 μg/mL姜黄素、 129 μg/mL双去甲氧基姜黄素的单标溶液,取适量配制成一定质量浓度的混合对照品溶液,将上述混合对照品溶液按 8个梯度依次稀释,同法配置含克拉霉素203 μg/mL内标贮备液, 并用甲醇稀释,配成质量浓度为 2.03 μg/mL克拉霉素内标工作液。
2.2 复方柔肝及姜黄提取物的制备 复方柔肝提取物 (FF) 采用确定生产工艺制备, 姜黄提取物(TT) 按照复方柔肝提取物工艺同等条件制备,经UPLC-TQ/MS 检测得到复方柔肝提取物、 姜黄提取物中姜黄素和双去甲氧基姜黄素分别为 0.944、0.758、 6.495、 5.036 mg/g。姜黄素和双去甲氧基姜黄素混合溶液按照复方柔肝提取物大鼠灌胃剂量换算,称取相近对照品量混合配制而成。
2.3 UPLC分析条件 ACQUITYTMUPLC BEH C18色谱 柱 (1.7 μm, 2.1 mm ×100 mm,Waters公司); 流动相 0.1%甲酸水溶液 (A) -乙腈 ( B)梯度洗脱 (0 ~4 min, 20% ~60%B; 4 ~7 min,60% ~70%B; 7 ~8 min, 70% ~95%B; 8 ~9 min,95% ~95%;9 ~10 min, 95% ~20%B); 体积流量 0.4 mL/min, 进样体积 5 μL;柱 温为 35 ℃。MS条件: 离子化模式为正离子; 毛细管电压为3.0 kV; 离子源温度为 150 ℃; 脱溶剂气温度为550 ℃;脱溶剂气流量为 1 000 L/h; 锥孔气流量为50 L/h;碰撞气流量为 0.15 mL/min;扫描方式为多反应离子监测模式 (MRM), 用于定量的离子对、 锥孔电压及碰撞能量见表1。

表1 姜黄素类化合物主要质谱检测参数Tab.1 M RM transitions, cone voltage, collision energies, retention times( Rt) and ion mode of curcum ins
2.4 给药与样品采集 取雄性 SD大鼠 18 只,随机分成3组, 每组6只, 大鼠禁食、 自由饮水12 h后,分别灌胃单剂量的姜黄素和双去甲氧基姜黄素混合物 (HH) 2.042 mg/kg、 姜黄素提取物 (TT) 0.175 g/kg和复方柔肝提取物 (FF) 1.2 g/kg,使各组姜黄素分别为 1.132 8 mg/kg、 双去甲氧基姜黄素分别为 0.909 0 mg/kg, 于给药后 5、 15、 30、45、 60、 90、 120、 240、 480、 720 min 时间点,采用毛细管从大鼠眼眶静脉丛分别取血 0.5 mL, 置于 EDTA抗凝预处理的 1.5 mL离心管中, 样品4 ℃下 以 10 000 r/min 离 心 10 min, 分 离 血 浆,-80 ℃保存。
2.5 血浆样品处理 精密吸取 150 μL血浆样品,依次加入 20 μL内标克拉霉素工作液、 600 μL乙酸乙酯, 涡旋 2min, 13 000 r/min 离心 10min, 反复萃取2次, 吸取合并上层有机相于 37 ℃旋转浓缩仪浓缩至干。 残渣用 150 μL甲醇复溶, 超声30 s, 涡旋 2 min, 13 000 r/min 离心 10 min 后, 取上清液用于分析。
3 结果
3.1 专属性试验 取大鼠空白血浆 150 μL, 按“2.5”项下方法处理,并与空白血浆加混合对照品和复方柔肝灌胃大鼠 45 min 后的血浆样品对照,考察方法的专属性。结果显示,空白血浆中的内源性物质及其它成分不干扰姜黄素类及内标克拉霉素的测定,方法的专属性良好。姜黄素类成分典型MRM色谱图见图1。

图1 大鼠血浆中姜黄素和双去甲氧基姜黄素典型 M RM色谱图Fig.1 Representative MRM chromatogram s of the two com pounds in rat p lasma
3.2 标准曲线与定量限测定 取空白血浆 130 μL, 分别加入逐步稀释的不同质量浓度的混合对照品溶液 20 μL, 配置成相当于姜黄素 0.415 6、0.830 0、 4.165、8.330、 41.65、 83.30、 416.5、833.0 ng/mL, 双去甲氧基姜黄素 0.430、 0.860、4.30、 8.60、 43.0、 86.0、 430、 860 ng/mL的 血浆样品。 按 “2.5” 项下方法处理后进行 UPLCTQ/MS 检测, 建立标准曲线, 以待测化合物与内标的峰面积之比 (Y)对各物质质量浓度 (X) 进行线性回归,并以质量浓度的倒数 (1/X) 为加权系数, 得回归方程, 同时按信噪比 ( S/N) =10计算被测化合物的定量限。结果见表2。

表2 两种成分的标准曲线及定量限Tab.2 Calibration curves and LOQ of two curcum ins
3.3 精密度试验 取空白血浆 130 μL, 加入不同质量浓度的混合对照品溶液 20 μL, 配制成高、中、 低质量浓度的质控 (QC) 样品,按 “2.5”项下方法处理后进行 UPLC-MS/MS 检测,连续测定3 d (n=6), 根据标准曲线计算 QC浓度, 求得方法的日内、 日间精密度和准确度, 结果见表3。经测定, 2 种成分的日内、 日间精密度RSD分别均小于 15.4%, 准确度范围在 83.60% ~97.08%。
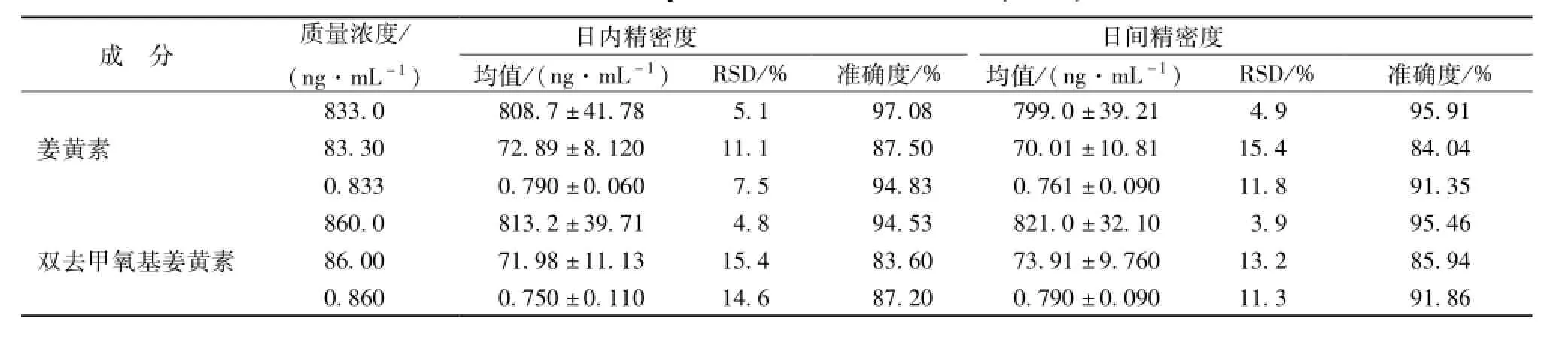
表 3 姜黄素类成分的精密度和准确度 (n=6)Tab.3 Accuracy results of two curcum ins(n=6)
3.4 回收率试验与基质效应 取空白血浆 130 μL, 加入不同质量浓度的混合对照品溶液 20 μL,配制 成 姜 黄 素 0.833、 83.3、 833 ng/m L, 双 去 甲氧基姜黄素 0.860、 86.0、 860 ng/mL高、 中、 低质量浓度 QC样品, 按 “2.5”项下方法处理; 同时取空白血浆 150 μL, 乙酸乙酯萃取, 吹干后加入与上述 QC样品等质量浓度的对照品溶液复溶,检测并记录峰面积,以每一质量浓度两种处理方法峰面积比值计算提取回收率,同法得出内标克拉霉素的提取回收率, 结果见表4。内标克拉霉素的平均提取回收率为 (87.05 ±2.61) %。
取空白血浆 150 μL, 乙酸乙酯萃取吹干后用含高、中、低质量浓度混合对照品的甲醇溶液复溶,检测并记录峰面积;用上述高、中、低质量浓度混合对照品的甲醇溶液直接进样,记录相应的峰面积。以每一质量浓度两种处理方法峰面积之比考察基质效应,结果见表4。 内标克拉霉素的平均基质效应为 (95.80 ±7.13)%。
表4 两种成分的提取回收率及基质效应 (, n=3)Tab.4 Extraction recovery and ion supression relative recovery results of two curcum ins(, n=3)

表4 两种成分的提取回收率及基质效应 (, n=3)Tab.4 Extraction recovery and ion supression relative recovery results of two curcum ins(, n=3)
提取回收率 /%基质效应 /成分%高浓度 中浓度 低浓度 高浓度 中浓度 低浓度姜黄素83.81 ±8.88 82.26 ±5.82 89.63 ±3.19 91.22 ±3.19 95.14 ±6.17 97.23 ±4.12双去甲氧基姜黄素79.10 ±3.71 82.18 ±4.51 85.82 ±4.39 91.00 ±5.28 103.39 ±3.41 93.42 ±4.19
3.5 稳定性 考察姜黄素和双去甲氧基姜黄素的高、中、低质量浓度样品在不同条件下的稳定性。经测定, 样品在室温条件下放置 12 h、 冷藏 (4℃) 条件下放置 24 h、 -80 ℃反复冻融 3 次, 两种姜黄素类成分的峰面积偏差均在 15%以内, 提示血浆样品在本实验条件下稳定性良好。
3.6 血药浓度—时间曲线 样品检测后记录相应数据,代入标准曲线计算血药浓度,绘制平均血药浓度-时间曲线, 见图 2。

图2 大鼠给药后姜黄素和双去甲氧基姜黄素的平均药时曲线 (n=6)Fig.2 M ean p lasma concentration-time curves of two curcum ins in rats
3.7 药代动力学参数分析 用 DAS 3.2 软 件对血 药浓度数据进行智能化分析, 采用非房室模型方法计算统计矩参数[11], 主要的药动学参数见表 5。

表 5 姜黄素和双去甲氧基姜黄素非房室模型药动学参数 (n=6)Tab.5 NCA pharm coknetic parameters of two curcum ins in FF、 TT and HH (n=6)
结 果 显 示, 姜 黄 素 在 复 方 配 伍 后 Cmax、AUC0~T明显大于姜黄素和双去甲氧基姜黄素混合物 (P<0.05), 但两者在姜黄提取物、 姜黄素和双去甲氧基姜黄素混合物中并无显著性差异。姜黄素在姜黄提取物和复方柔肝提取物中 MRT0~T小于姜黄素和双去甲氧基姜黄素混合物 (P<0.05),T1/2和 Tmax在三者中无 显 著 性差异。 双 去甲氧基姜黄素 Tmax在姜黄提取物和复方柔肝提取物配伍后存在显著性 差异 ( P<0.05 ), 复配伍 后 Tmax减小,而 Cmax、 AUC0~T、 MRT0~T和 T1/2在 姜 黄 素 和 双 去甲氧基姜黄素混合物、姜黄提取物和复方柔肝提取物中差异不大。
4 讨论
4.1 柔肝方中姜黄经配伍显著提高了姜黄素的生物利用度 据 文 献 报 道[12-13], 姜黄 素 类 物质 口 服后极少以原形成分吸收入血,可能是首过效应影响或者由于姜黄素的结构特点难以经过肠道吸收,绝大部分药物以原形成分排出肠道,血药浓度较低,大鼠口服吸收较差。通过比较发现柔肝方中姜黄经配伍后显著增加血药浓度,推测复方配伍后黄芪大分子物质或者丹参中水溶性成分促进了肠道对姜黄素的吸收或者抑制了姜黄素的代谢,从而提高了姜黄素在大鼠体内的生物利用度,而对于双去甲氧基姜黄素,配伍后使其吸收速度加快,但血药浓度和生物利用度影响不大。通过比较两者的结构推测,对于极性小、难溶于水的姜黄素,复方柔肝配伍能够增加吸收率而增加其生物利用度;对于极性相对较小的双去甲氧基姜黄素,通过增加吸收速度,加快达峰时间但对生物利用度影响不大。
4.2 提高姜黄素类成分生物利用度的途径不同据文献报道[14-16],制备姜黄素长循环脂质体、 应用新型辅料或者改变剂型来增加姜黄素的生物利用度。这些方法主要是通过以下一种或多种方式组合以达到增大 AUC0~T而提高生物利用度的, 包括:提高 Cmax、增大 T1/2、 增大 Tmax、 抑 制 姜黄素在体内的代谢、 延 缓 药 物 释 放 时 间[17-19]。 但 对于 复 方配伍后姜黄素生物利用度的研究较少,本实验基于复方柔肝中姜黄素药动学研究显示,本方中姜黄经配伍后姜黄素以 Cmax增大而提高生物利用度, 具体影响机制有待进一步研究。
[ 1 ] 韩 超, 朱振瓯, 沈 燕, 等.微波辅助萃取-高效液相色谱-串联质谱法测定温郁金中 3 个姜黄素类化合物[J].药物分析杂志, 2013, 33(2): 185-188.
[ 2 ] Shishodia S, ChaturvediM M, Aggarwal B B.Role of curcumin in cancer therapy[J].Curr Probl Cancer, 2007, 31(4): 243-305.
[ 3 ] Durgaprasad S, Ganesh P C, Vasanthkumar, et al.A pilot study of the antioxidanteffectof curcumin in tropical pancreatitis[J] .Indian JMed Res, 2005, 122(4) : 315-318.
[4] 陈 华,薛常镐,陈铁辉,等.姜黄及姜黄素对微囊藻粗毒素致急性肝损伤的化学预防作用[J].中国药理学通报,2005, 21(12): 1517-1519.
[ 5 ] 束 艳, 宿树兰, 钱大玮, 等.柔肝胶囊化学成分的UPLCESI-QTOF/MS 分析[ J] .中成药, 2011, 33(1) : 73-78.
[6] 姚国贤,韩 刚,王成强,等.姜黄及片姜黄中姜黄素在大鼠体内药动学过程的比较[ J].中草药, 2011, 34(1):88-91.
[7] 陆兔林,毛春芹,卞慧敏,等.莪术中姜黄素在大鼠体内的药动学研究[J].中草药, 2005, 36(8): 1157-1158.
[8] 马传香,张文生,田 蓉,等.川芎郁金不同配伍比例对阿魏酸在家兔体内的药代动力学影响研究[J].北京中医药大学学报, 2006, 29(7): 474-478.
[ 9 ] 郭锦锦, 周本杰.中药复方药动学研究进展[J].中国药房, 2012, 23(47): 4503-4505
[10 ] Rasmussen C, Kvist K.A simple and efficient separation of the curcumins and the antiprotozoal constituents of Curcuma longa[J] .Planta Med, 2000, 66(4): 396-398.
[11] 王广基.药物代谢动力学[M].北京: 化学工业出版社,2006: 143.
[12] 张立康, 汪小珍, 胡国新, 等.姜黄素在大鼠体内药代动力学和生物利用度研究[J].中国药理学通报, 2011, 27(10): 1458-1462.
[13] 黄秀旺, 许建华, 温彩霞, 等.姜黄素固体分散体在小鼠体内的药代动力学[ J].中国药理学通报, 2008, 24 (11):1525-1527.
[14] 许汉林, 孙 芸, 邵继征, 等.姜黄素脂质体在大鼠体内药动学 研 究 [ J]. 中 国 医 院 药 学 杂 志, 2007, 9(3):1363-1365.
[15] Marczylo T H, Verschoyle R D, Cooke D N, et al.Comparison of system ic availability of curcum in with that of curcum in formulated with phosphatidy lcho line[ J].Cancer Chemother Pharmacol, 2007, 60(12) : 171.
[16] 张庆云, 莫曾南.姜黄素生物利用度研究进展 [ J].中国药房, 2009, 20 (33): 2631-2632.
[17] Li Rui, Qiao Xue, Guo Dean, et al.Metabolic and pharmacokinetic studies of curcumin, demethoxycurcumin and bisdemethoxycurcumin in mice tumor after intragastric administration of nanoparticle formulations by liquid chromatography coupled with tandem mass spectrometry[ J] .J Chromatogr B, 2011, 879(26): 2751-2758.
[18] 韩 刚, 范 颖, 翟冠玉, 等.姜黄素滴丸在大鼠体内药代动力学研究[J].中成药, 2009, 31(3): 377-379.
[19] 顾吉普, 邓英杰.口服姜黄素脂质体制备及其大鼠体内药动学考察[J].成都医学院学报, 2010, 5(2): 97-100.
Pharmacokinetic characteristics of curcum ins in compatibility of Rougan in rats
REN Hao, SU Shu-lan, GUAN Han-liang, QIAN Ye-fei, QIAN Da-wei*, DUAN Jin-ao
(Jiangsu Key Laboratory for High Technology Research of TCM Formulae, Nanjing University of Chinese Medicine, Nanjing 210023, China)
AIM To study pharmacokinetic of curcumin and bisdemethoxycurcumin from compatibility of Rougan ( Astragali Radix, Curcumae longae Rhizoma, Salviaemiltiorrhizae Radix et Rhizoma, bears gall powder) in rats.M ETHODS Ratswere divided into three groups at random, being respectively fed with themixture of curcumin and bisdemethoxycurcumin (HH), curcumin extract( TT) and Rougan extract( FF).Plasma samples of each group were collected.The contents of curcumin and bisdemethoxycurcumin weremeasured by UPLC-TQ/MS and they were tested bymultiple reaction monition in positive ion.The pharmacokinetic parameters of each group were calculated by DAS 3.2 and compared with each other.RESULTS There were no significant differences between groups in T1/2,Tmax; while the Cmaxand AUC0~Tin FF group were obviouslymore than these in the TT and HH groups.The MRT0~Tof curcumin in TT and FF goupswas slightly smaller than that in the HH group.Expect Tmax, there were no obvious differences among pharmacokinetic parameters of bisdemethoxycurcumin.CONCLUSIONS Rougan decoction can increase Cmax, and bioavailability of curcumin, and speeds the absorption velocity of bisdemethoxycurcumin but can not change the bioavailability.
curcumin; bisdemethoxycurcumin; pharmacokinetic; Rougan
R969.1
: A
: 1001-1528(2014)03-0498-06
10.3969/j.issn.1001-1528.2014.03.011
2013-05-16
任 浩, 硕士生, 从事生物药剂学研究。 Tel: 15850531764, E-mail: arenhao198909@163.com
*通信作者: 钱大玮, 研究员, 从事中药质量控制与生物药剂学研究。 E-mail: Qiandwnj@126.com
