葛黄神箭片长期给药的安全性评价
2014-04-11谢家骏张国明乔正东阮克锋
谢家骏, 张国明, 乔正东, 阮克锋
(1.上海中医药大学, 上海 201203; 2.上海市中药研究所, 上海 201401; 3.上海市浦东医院, 上海201399)
葛黄神箭片长期给药的安全性评价
谢家骏1, 张国明2, 乔正东3, 阮克锋1
(1.上海中医药大学, 上海 201203; 2.上海市中药研究所, 上海 201401; 3.上海市浦东医院, 上海201399)
目的 观察葛黄神箭片 (葛根总黄酮、 黄柏总生物碱和鬼箭羽水提物) 长期给药对大鼠的毒性反应。 方法SD大鼠 128 只, 随机分成 4 组。 给药组分别灌服葛黄神箭片 4.37、 1.94、 0.73 g/kg, 对照组同法给予等容量蒸馏水,连续给药27 周, 恢复期4周, 每周称体质量和食耗量, 在给药和恢复期间, 取血检测血液、 凝血、 血清生化、 电解质等指标,主要脏器称定质量,并作组织病理学检查。结果 葛黄神箭片灌胃给药,可使大鼠耗食量减少,体质量增长缓慢,总胆固醇降低,还可使雌性大鼠子宫腔扩张,子宫内膜水肿、上皮脱落、核碎裂,乳腺导管扩张等。但上述反应可能与其药性、主要药效学活性以及富含葛根素等异黄酮类成分有关。结论 葛黄神箭片经口长期给药的安全剂量为 4.37 g/(kg·d), 相当于临床推荐剂量的 90 倍。 但对于育龄期妇女, 建议就其长期给药的雌激素样作用作进一步观察。
葛黄神箭片;大鼠,长期毒性试验;安全剂量;雌激素样作用
葛黄神箭汤是中医临床经验方,具有滋阴清火的功效,可用于中轻度Ⅱ型糖尿病的预防和治疗。葛黄神箭片是采用现代提取纯化工艺制备而成的中成药制剂,由 葛根总 黄酮[1-2]、 黄 柏总生 物 碱[3-4]、鬼箭羽水提物[5-6]按一定 比例组合而成。 根 据作为糖尿病治疗药物的临床使用特性,探索其长期给药可能产生的毒性反应及其性质、程度、量效和时效关系、可逆性,推测临床毒性靶器官或靶组织,推测临床使 用 安 全剂 量 是 非常 有 必 要 的[7-8]。 为 此,本实验就其长期给药可能产生的毒性反应进行实验观察,对长期用药的安全剂量范围予以客观评判。
1 材料
1.1 受试物 葛黄神箭片, 呈棕黄色粉末, 1 g相当生药13.4 g, 由上海市中药研究所制备和提供,批号 20080610。 其制备工艺首先将药材葛根和黄柏破碎或切成块状,用稀醇提取,提取液上大孔树脂,以不同体积分数醇水溶液洗脱,洗脱液减压浓缩,真空干燥得葛根总黄酮与黄柏总生物碱的混合物,然后与鬼箭羽水提物按一定比例混合而成。其中,总黄酮的量以质量分数表示为 14.6%, 总生物碱的量以质量分数表示为 39.8%。 试验时用蒸馏水将受试物配制成 0.336 g粉/mL、 0.149 g粉/mL,0.075 g粉/mL的混悬液, 备用。
1.2 实验动物 SPF级 SD大鼠,雌雄各半, 5 ~6周龄, 体质量 60 ~70 g, 由上海斯莱克实验动物有限责任公司提 供, 动物生产许 可 证 号: SCXK(沪) 2007-0005。 入室后饲以60Co辐 照鼠颗粒饲料,饲料亦由上海斯莱克实验动物有限责任公司提供。 自由饮食、 饮水。 置 SPF级实验室饲养, 温度 20 ~25 ℃, 相对湿度 40% ~70%, 噪声≤60 dB, 换气次数 10 ~20 次/h, 工作照度 12 h 明 12 h暗。
1.3 主要仪器 BAYER ADVIA 120 五分类血球仪(德国拜耳公司产品); OPTION4plus血凝仪 ( 法国BioMerieux公司); 日立 7080 全 自 动 生 化 分 析 仪(日本日立贸易有限公司); BD FACSCalibur流式细胞仪 ( 美国 BD Bioscience公司) ; ACS-6A电子秤 (上海实业衡器有限公司); JH2102 型电子天平(上海精密科学仪器有限公司); AR2130 型电子精密天平 (奥豪斯上海公司产品)。
1.4 主要试剂 血液生化检测试剂盒 (上海日和贸易有限公司); 离子检测试剂盒 (上海迅达医疗仪器有限公司); 血液学检测试剂盒 (上海百徕生物制品有限公司); 凝血指标测定试剂盒 (上海太阳生物技术有限公司); 乌来糖 (国药集团化学试剂有限公司, 批号 T20061101)。
2 试验方法[1-2]
2.1 动物分组 128 只健康动物按体质量分层随机进行分组,分成对照组、葛黄神箭高剂量组(4.37 g/kg)、 中剂量组 (1.94 g/kg) 和低剂量组(0.73 g/kg), 每组 32 只,雌雄各半。其中高剂量为可灌胃的最高质量浓度和最大容量,低剂量高于药效最低有效剂量,高、中、低剂量分别相当于人临床推荐剂量 90、 40、 15 倍。 对照组给予等容量蒸馏水。采用灌胃给药, 单次剂量为 13 mL/kg,1 次/d,每周给药 6 d,连续给药 6 个月。
2.2 检测项目
2.2.1 一般症状 给药期和停药后恢复期, 除周日外,每天观察1次外观、体征、行为活动、腺体分泌、呼吸、皮毛、粪、尿等,每周称体质量和摄食量1次,发现死亡或濒死动物及时尸检。
2.2.2 血液学检测 红细胞计数 (RBC)、 血红蛋白 (HGB)、 白细胞计数 (WBC)、 红细胞容积(HCT)、 平均红细胞容积 (MCV)、 平均红细胞血红蛋白 (MCH)、 平 均红细胞血 红 蛋 白 浓 度(MCHC)、 血小板计数 (PLT)、 网织红细胞百分率 (RETIC)、 中性粒细胞百分率 (NEUT)、 淋巴细 胞 百 分 率 ( LYMPH)、单 核 细 胞 百 分 率(MONO)、 嗜酸细胞百分率 (EOS)、 嗜碱细胞百分率 (BASO)。 胸骨取骨髓涂片, 甲醛固定。
2.2.3 血液生化检测 天门冬氨酸转氨酶 (AST,谷草转氨酶法)、 丙氨酸氨基转氨酶 (ALT, 谷丙转氨酶试剂法)、 碱性磷酸酶 (ALP, 酶法)、 尿素氮 (BUN, 酶法)、 肌酐 (CREAT, 苦味酸法)、总蛋白 (TP, 双缩脲法)、 白蛋白 (ALB, 溴甲酚緑法)、 血糖 (GLU, 葡萄糖脱氢酶法)、 总胆红素 (TB, 钒酸氧化法)、 总胆固醇 (CHOLT, 酶法)、 甘油三脂 (TG, 酶法)、 肌酸激酶 (CK, 酶法),钠、钾、氯离子。
2.2.4 凝血指标检测 凝血酶原时间 (PT)、 活化部分凝血活酶时间 (APTT)。
2.2.5 系统尸检和病理组织学检查 取各组大鼠脑、 垂体、 脊髓 (颈、胸、 腰段)、 胸腺、 甲状腺、唾液腺、食管、胃、大肠和小肠、肝、脾、肾上腺、肾、淋巴结 (食管淋巴结、肠系膜淋巴结)、胰腺、气管、肺、心、 主动脉、 膀胱、 坐骨神经、胸骨、雄性动物睾丸、附睾、前列腺、或雌性动物乳腺、子宫、卵巢及尸检时肉眼发现的可疑脏器, 放入 10%福尔马林固定, HE染色。 高剂量组和对照组的器官和组织进行组织病理学检查,如果高剂量组出现组织病理学变化时,更低剂量组也应进行组织病理学检查以确定剂量-反应关系。其中取材后需称定质量的器官:脑、心、肝、脾、肺、肾、肾上腺、胸腺、睾丸、附睾或子宫、卵巢。 计算各脏器指数 (g/100 g体质量)。
2.3 检测频率 大鼠在给药 3 个月、6 个月和停药28 d后均进行血液学、 血液生化学、 凝血指标检查。 在给药 3、 6 个月及停药后 30 d, 每组各解剖 8、 16、8 只大鼠, 雌雄各半。
2.4 统计方法 本试验所有数据均采用 spss 13.0软件统计,各给药组与对照组进行比较,多组间比较用单因素方差分析, 方差齐性时用 LSD及 SNK方法分析,方差不齐时用非参数检验。
3 试验结果
3.1 一般症状 大鼠给药 6 个月及恢复期内, 对照组和各给药组大鼠精神状态良好,行为活动、呼吸正常,唾液腺、泪腺等腺体未见有异常分泌,皮毛光滑,粪便和尿液也未见异常。
3.2 体质量和食耗量 自给药 4 周起, 各剂量组雌雄性大鼠体质量增长开始减缓,食耗量逐步下降。其中高剂量组大鼠最甚,中剂量次之,低剂量最小, 呈明显的量效关系。结果见图 1, 图 2。
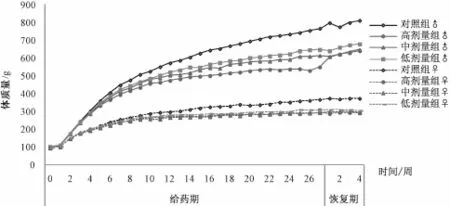
图1 葛黄神箭片给药 6个月大鼠体质量的经时变化Fig.1 Effect of Gehuang Shenjian Tab lets on the changes of body weight of rats w ithin six mon ths
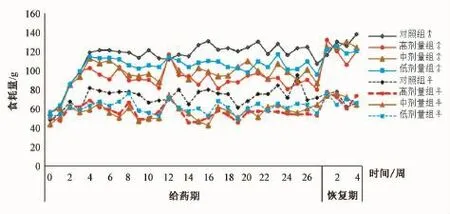
图2 葛黄神箭片给药6个月大鼠食耗量的经时变化Fig.2 Effect of Gehuang Shenjian Tab lets on the changes of food consum p tion of ratsw ithin six months
3.3 血液学 给药 3 个月、6 个月及恢复期末,各给药组血液学指标与对照组比较无明显差异。
3.4 血液生化 给药 3 个月, 中剂量组 ALP偏高(P<0.01), 高、 中、 低 各 给 药 组 CHOLT偏 低(P<0.05 或 P<0.01); 给药 6 个月, 低剂量组 CK偏高 (P<0.01), 高、中、 低各给药组 CHOLT偏低 (P<0.01); 恢复 期末, 高剂 量组 ALT偏 低(P<0.01); 其余各给药组的血液生化各项指标与对照组比较未见明显差异。结果见表1。
3.5 凝血指标 给药 3 个月、 6 个月及恢复期末,各给药组各项凝血指标与对照组比较未见明显差异。
表1 葛黄神箭片对大鼠血液生化学指标的影响 ()Tab.1 Effect of Gehuang Shenjian Tab lets on serum biochem ical indexes of rats()

表1 葛黄神箭片对大鼠血液生化学指标的影响 ()Tab.1 Effect of Gehuang Shenjian Tab lets on serum biochem ical indexes of rats()
注: 与对照组比较,*P<0.05,**P<0.01
项目 对照组 高剂量组 中剂量组 低剂量组(给药3个月)AST/(IU/L) 104 ±22 99 ±19 123 ±49 108 ±29 ALT/(IU/L) 44 ±12 41 ±7 53 ±20 45 ±14 ALP/( IU/L) 213 ±43 258 ±62 286 ±49** 213 ±31 BUN/(mmol/L) 7.8 ±0.8 7.1 ±0.8 7.4 ±1.0 6.8 ±0.7 CREAT/(μmol/L) 37 ±6 36 ±3 36 ±7 36 ±5 TP/(g/L) 58.1 ±3.4 58.4 ±3.2 60.0 ±3.4 58.3 ±2.9 ALB/(g/L) 32.6 ±2.0 32.8 ±1.7 33.0 ±1.8 32.1 ±1.6 GLU/(mmol/L) 7.86 ±1.07 7.65 ±1.48 7.16 ±1.20 7.86 ±1.38 TB/( μmol/L) 0.66 ±0.16 0.82 ±0.22 0.73 ±0.18 0.87 ±0.23 CHOLT/( mmol/l) 1.96 ±0.48 1.44 ±0.25* 1.57 ±0.30* 1.27 ±0.45**TRIG/( mmol/l) 0.74 ±0.51 0.87 ±0.45 0.75 ±0.48 1.04 ±0.39 CK/(IU/L) 1 068 ±448 1 059 ±660 1 515 ±1 094 841 ±270 Na+/(mmol/L) 134.2 ±7.3 134.3 ±7.3 133.6 ±7.1 132.9 ±7.3 K+/(mmol/L) 4.48 ±0.65 4.78 ±0.52 4.72 ±0.50 4.49 ±0.30 Cl-/(mmol/L) 107.9 ±4.2 109.2 ±3.4 109.3 ±4.2 109.9 ±3.2(给药6个月)AST/(IU/L) 125 ±62 113 ±38 106 ±31 110 ±28 ALT/(IU/L) 75 ±39 73 ±73 59 ±24 60 ±18 ALP/(IU/L) 217 ±82 252 ±76 216 ±70 218 ±49 BUN/(mmol/L) 7.2 ±1.4 7.4 ±1.4 7.9 ±1.7 7.3 ±0.9 CREAT/(μmol/L) 35 ±8 39 ±7 38 ±7 38 ±7 TP/(g/L) 62.0 ±4.7 61.7 ±5.2 61.0 ±4.1 60.1 ±4.4 ALB/(g/L) 31.2 ±2.7 31.3 ±2.1 30.6 ±2.1 30.4 ±2.7 GLU/(mmol/L) 9.66 ±3.70 8.39 ±1.27 8.67 ±2.01 8.79 ±1.42 TB/( μmol/L) 0.68 ±0.50 0.94 ±0.60 0.70 ±0.41 0.56 ±0.32 CHOLT/( mmol/L) 2.17 ±0.25 1.15 ±0.36** 1.29 ±0.39** 1.52 ±0.57**TRIG/(mmol/L) 1.36 ±1.39 0.78 ±0.48 0.95 ±0.43 0.84 ±0.36 CK/( IU/L) 837 ±811 1 244 ±569 1 140 ±635 1 603 ±1 045**Na+/(mmol/L) 141.4 ±1.8 141.3 ±1.6 141.1 ±1.7 141.2 ±1.7 K+/(mmol/L) 4.64 ±0.82 4.44 ±0.86 4.51 ±0.99 4.34 ±0.53 Cl-/(mmol/L) 107.7 ±2.6 107.9 ±1.9 107.6 ±1.8 108.1 ±1.7(恢复期末)AST/(IU/L) 142 ±117 94 ±21 101 ±29 111 ±38 ALT/(IU/L) 70 ±13 46 ±7** 73 ±32 61 ±10 ALP/(IU/L) 176 ±68 139 ±68 186 ±102 161 ±77 BUN/(mmol/L) 7.1 ±0.7 9.1 ±2.4 8.8 ±1.8 7.5 ±1.1 CREAT/(μmol/L) 39 ±4 49 ±22 43 ±8 44 ±9 TP/(g/L) 61.3 ±5.3 61.7 ±5.7 61.3 ±5.5 60.7 ±4.4 ALB/(g/L) 30.7 ±3.1 31.0 ±3.3 30.7 ±2.3 30.3 ±2.5 GLU/(mmol/L) 9.55 ±1.06 8.86 ±1.25 10.11 ±3.76 8.37 ±1.50 TB/( μmol/L) 0.77 ±0.28 0.75 ±0.23 0.58 ±0.14 0.60 ±0.17 CHOLT/(mmol/L) 2.02 ±0.33 1.97 ±0.46 1.96 ±0.35 2.03 ±0.42 TRIG/(mmol/L) 1.28 ±0.60 0.79 ±0.47 1.21 ±1.24 0.91 ±0.78 CK/(IU/L) 1 603 ±2 147 913 ±511 973 ±516 1 186 ±865 Na+/(mmol/L) 144.8 ±1.6 144.2 ±1.1 144.6 ±1.2 144.6 ±1.0 K+/(mmol/L) 4.70 ±0.63 4.36 ±0.61 4.60 ±0.55 4.47 ±0.62 Cl-(mmol/L)107.6 ±2.4 107.0 ±1.6 108.8 ±2.2 108.4 ±1.7
3.6 脏器质量
3.6.1 脏器湿质量 除给药 6 个月高剂量组雌雄大鼠肺、肾、卵巢湿质量偏低、附睾湿质量偏高(P<0.05 或 P<0.01) 外,其余各给药组雌雄大鼠脏器湿质量与对照组比较均无明显差异。
3.6.2 脏器指数 给药 3 个月, 雄性大鼠高剂量组肺、肾、附睾指数、中剂量组肺、肾指数、低剂量组肺、 附睾指数升高 (P<0.05 或 P<0.01),雌性大鼠中剂量组肝指数升高 (P<0.05); 给药6个月,雄性大鼠高剂量组心、肺、肾、附睾指数、中剂量组脑、肺、肾、肾上腺、睾丸指数、低剂量组脑、 睾丸指数偏高 (P<0.05 或 P<0.01); 雌性大鼠各剂量组脑、心、肝、肾指数偏高 (P<0.01); 恢复期末, 雄性大鼠高剂量组肺、 肾上腺、附睾指数、中剂量组肾上腺指数、低剂量组肾上腺、 附睾指数偏高 (P<0.05 或 P<0.01); 雌性大鼠各剂量组脑、 心、 肾指数均偏高 (P<0.01或 P<0.05), 高剂量组卵巢指数偏低 (P<0.05或 P<0.01)。 其余各给药组脏器指数与对照组比较均无明显差异。 见表 2, 表 3。
表2 葛黄神箭片对雄性大鼠主要脏器指数的影响 (, g/100 g)Tab.2 Effect of Gehuang Shenjian Tablets on organ coefficients of themale rats(, g/100 g)
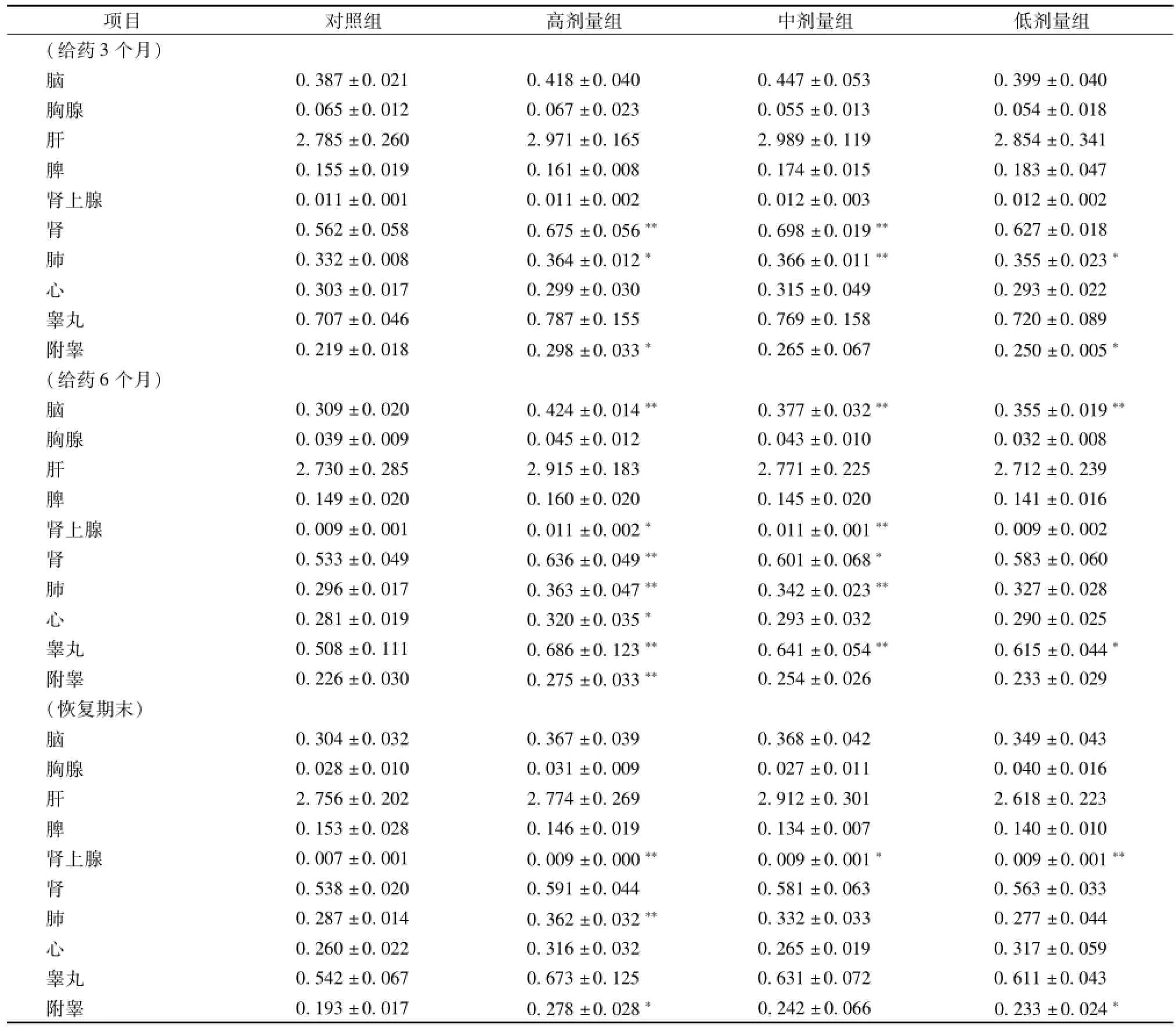
表2 葛黄神箭片对雄性大鼠主要脏器指数的影响 (, g/100 g)Tab.2 Effect of Gehuang Shenjian Tablets on organ coefficients of themale rats(, g/100 g)
注: 与对照组比较,*P<0.05,**P<0.01
项目 对照组 高剂量组 中剂量组 低剂量组(给药3个月)0.387 ±0.021 0.418 ±0.040 0.447 ±0.053 0.399 ±0.040胸腺 0.065 ±0.012 0.067 ±0.023 0.055 ±0.013 0.054 ±0.018肝2.785 ±0.260 2.971 ±0.165 2.989 ±0.119 2.854 ±0.341脾0.155 ±0.019 0.161 ±0.008 0.174 ±0.015 0.183 ±0.047肾上腺 0.011 ±0.001 0.011 ±0.002 0.012 ±0.003 0.012 ±0.002肾0.562 ±0.058 0.675 ±0.056** 0.698 ±0.019** 0.627 ±0.018肺0.332 ±0.008 0.364 ±0.012* 0.366 ±0.011** 0.355 ±0.023*心0.303 ±0.017 0.299 ±0.030 0.315 ±0.049 0.293 ±0.022睾丸 0.707 ±0.046 0.787 ±0.155 0.769 ±0.158 0.720 ±0.089附睾 0.219 ±0.018 0.298 ±0.033* 0.265 ±0.067 0.250 ±0.005*(给药6个月)脑0.309 ±0.020 0.424 ±0.014** 0.377 ±0.032** 0.355 ±0.019**胸腺 0.039 ±0.009 0.045 ±0.012 0.043 ±0.010 0.032 ±0.008肝2.730 ±0.285 2.915 ±0.183 2.771 ±0.225 2.712 ±0.239脾0.149 ±0.020 0.160 ±0.020 0.145 ±0.020 0.141 ±0.016肾上腺 0.009 ±0.001 0.011 ±0.002* 0.011 ±0.001** 0.009 ±0.002肾0.533 ±0.049 0.636 ±0.049** 0.601 ±0.068* 0.583 ±0.060肺0.296 ±0.017 0.363 ±0.047** 0.342 ±0.023** 0.327 ±0.028心0.281 ±0.019 0.320 ±0.035* 0.293 ±0.032 0.290 ±0.025睾丸 0.508 ±0.111 0.686 ±0.123** 0.641 ±0.054** 0.615 ±0.044*附睾 0.226 ±0.030 0.275 ±0.033** 0.254 ±0.026 0.233 ±0.029(恢复期末)脑0.304 ±0.032 0.367 ±0.039 0.368 ±0.042 0.349 ±0.043胸腺 0.028 ±0.010 0.031 ±0.009 0.027 ±0.011 0.040 ±0.016肝2.756 ±0.202 2.774 ±0.269 2.912 ±0.301 2.618 ±0.223脾0.153 ±0.028 0.146 ±0.019 0.134 ±0.007 0.140 ±0.010肾上腺 0.007 ±0.001 0.009 ±0.000** 0.009 ±0.001* 0.009 ±0.001**肾0.538 ±0.020 0.591 ±0.044 0.581 ±0.063 0.563 ±0.033肺0.287 ±0.014 0.362 ±0.032** 0.332 ±0.033 0.277 ±0.044心0.260 ±0.022 0.316 ±0.032 0.265 ±0.019 0.317 ±0.059睾丸 0.542 ±0.067 0.673 ±0.125 0.631 ±0.072 0.611 ±0.043附睾 0.193 ±0.017 0.278 ±0.028* 0.242 ±0.066 0.233 ±0.024脑*
3.7 病理组织学
3.7.1 大体病理学检查 给药 3 个月: 各剂量组和对照组动物脏器未见明显异常。给药6个月:高剂量组有 1 只动物 (No.40) 颈部皮下及食管、 气管周围软组织出血,波及胸腺被膜;1只动物(No.59) 胸腺明显萎缩, 右侧颈部可见 1 cm×1 cm ×0.3 cm 的 白 色 质 软 肿 块;1 只 动 物(No.58) 两侧肺尖部可见数个黄白色斑点。 对照组 有 1 只 动 物 (No.7 ) 右 侧 睾 丸 缺 如 ( monoorchidism),附睾无异常。 高剂量组有 6 只动物(No.54、 55、 56、 58、 59、 60), 中剂量组 1 只动物 (No.87), 低剂量组 2 只动物 (No.121、 124)两侧子宫角扩张,宫腔内有透明液体内容物。其余动物体表及脏器未见明显异常。恢复期:高剂量组有 1 只动物 (No.46) 胃肠轻度胀气;中剂量组 1只动物 (No.94)、 低剂量组 1 只动物 ( No.127)胸腺轻度萎缩。 对照组有 1 只动物 (No.30) 左胸部皮下肿瘤,1 cm×1 cm×2 cm, 淡黄色,质软,边界清晰,活动度好。其余动物的体表及脏器未见明显异常。
表3 葛黄神箭片对雌性大鼠主要脏器指数的影响 (, g/100 g)Tab.3 Effect of Gehuang Shenjian Tablets on organ coefficients of the female rats(, g/100 g)

表3 葛黄神箭片对雌性大鼠主要脏器指数的影响 (, g/100 g)Tab.3 Effect of Gehuang Shenjian Tablets on organ coefficients of the female rats(, g/100 g)
注: 与对照组比较,*P<0.05,**P<0.01
项目 对照组 高剂量组 中剂量组 低剂量组(给药3个月)0.699 ±0.040 0.683 ±0.066 0.744 ±0.030 0.682 ±0.068胸腺 0.088 ±0.009 0.112 ±0.016 0.086 ±0.020 0.102 ±0.023肝2.758 ±0.210 3.127 ±0.111 3.451 ±0.288** 2.954 ±0.187脾0.194 ±0.009 0.191 ±0.031 0.194 ±0.015 0.201 ±0.015肾上腺 0.022 ±0.006 0.022 ±0.006 0.024 ±0.003 0.026 ±0.006肾0.617 ±0.043 0.651 ±0.025 0.665 ±0.040 0.657 ±0.042肺0.470 ±0.033 0.473 ±0.026 0.510 ±0.034 0.479 ±0.026心0.324 ±0.018 0.344 ±0.009 0.340 ±0.024 0.318 ±0.033子宫 0.256 ±0.072 0.263 ±0.052 0.274 ±0.065 0.218 ±0.075卵巢 0.053 ±0.004 0.050 ±0.006 0.045 ±0.004 0.047 ±0.005(给药6个月)脑0.606 ±0.101 0.719 ±0.055** 0.727 ±0.073** 0.687 ±0.063*胸腺 0.054 ±0.011 0.049 ±0.016 0.054 ±0.008 0.052 ±0.016肝2.599 ±0.307 3.141 ±0.195** 3.047 ±0.182** 3.057 ±0.423**脾0.159 ±0.027 0.185 ±0.020 0.190 ±0.027 0.186 ±0.030肾上腺 0.021 ±0.004 0.021 ±0.003 0.023 ±0.003 0.020 ±0.004肾0.566 ±0.037 0.625 ±0.056* 0.640 ±0.043** 0.633 ±0.027**肺0.421 ±0.067 0.473 ±0.043 0.467 ±0.038 0.460 ±0.017心0.299 ±0.030 0.338 ±0.017** 0.333 ±0.015** 0.330 ±0.022**子宫 0.043 ±0.008 0.045 ±0.012 0.046 ±0.006 0.040 ±0.011卵巢 0.266 ±0.101 0.397 ±0.130 0.369 ±0.206 0.344 ±0.122(恢复期末)脑0.602 ±0.060 0.694 ±0.025** 0.735 ±0.020** 0.698 ±0.044**胸腺 0.053 ±0.021 0.056 ±0.014 0.045 ±0.015 0.044 ±0.018肝2.542 ±0.178 2.934 ±0.093 2.845 ±0.278 2.704 ±0.211脾0.165 ±0.020 0.177 ±0.019 0.186 ±0.020 0.170 ±0.032肾上腺 0.018 ±0.003 0.022 ±0.001 0.021 ±0.003 0.020 ±0.002肾0.548 ±0.046 0.657 ±0.039* 0.632 ±0.052* 0.641 ±0.060*肺0.446 ±0.032 0.488 ±0.047 0.478 ±0.028 0.482 ±0.020心0.294 ±0.027 0.349 ±0.016* 0.350 ±0.028** 0.361 ±0.028**子宫 0.290 ±0.062 0.379 ±0.044 0.318 ±0.057 0.332 ±0.127卵巢 0.043 ±0.006 0.034 ±0.005*脑0.049 ±0.007 0.046 ±0.003
3.7.2 组织病理学检查 给药 3 个月, 高剂量组有部分动物肺、肝、胰腺出现病理改变,分别为5、 3、 1 只, 对照组心、 肺、 肝、 胰腺出现病理改变动物数分别为 1、 3、 2、 1 只, 其病理改变主要特征为右心房壁肌层炎性细胞浸润灶;肺内血管周围炎细胞浸润及泡沫细胞聚集,气管腺体扩张;肝细胞微空泡化及脂肪变性,肝内微肉芽肿;胰腺导管增生,肠管扩张;垂体内的异位性颅咽管组织、膀胱黏膜水肿;前列腺炎等。给药6个月,高剂量组有部分动物肺、肝、睾丸、胸腺、子宫出现病理改变, 分别为 3、 1、 1、 8、 7 只, 对照组心、 肺、肝、肾、垂体、睾丸、胸腺出现病理改变数分别为2、 1、3、 1、 1、 1、 4 只,其病理改变主要特征为右心室壁肌层灶性纤维化伴炎症细胞浸润;肺内血管周围炎细胞浸润,支气管肺炎,气管腺腺管扩张;肝细胞微空泡化及脂肪变性;垂体内的异位性颅咽管组织;甲状腺鳃后体残留;肾小管上皮嗜碱性变;膀胱黏膜水肿;睾丸内局限性生精小管萎缩;前列腺炎;乳腺纤维腺瘤;子宫内膜炎、内膜水肿、内膜上皮核碎裂,子宫腔扩张。恢复期末:高剂量组有部分动物心、肺、肝、肾、甲状腺、垂体、胸腺、乳腺、 子宫出现病理改变, 分别为 2、3、 2、 1、 3、 1、 1、 1、 3 只, 对照组心、 肺、 肝、肾、甲状腺、胸腺、乳腺出现病理改变动物数为2、 2、2、 1、 3、 1、 1 只,其病理改变主要特征为心肌内灶性纤维化及单核细胞灶性浸润;肺内血管周围炎细胞浸润,肺泡内泡沫细胞;胃底腺扩张;肝细胞微空泡化及脂肪变性; 垂体内 Rathke’ s囊泡;胰岛纤维化;甲状腺鳃后体残留,甲状腺滤泡内单核细胞;肾小管上皮细胞内嗜酸性颗粒,肾小管嗜碱性变,肾间质内灶性炎细胞浸润;前列腺炎;乳腺腺癌;子宫内膜炎、内膜水肿,内膜上皮核碎裂,子宫腔扩张等。上述病理变化均散在出现,有的虽然仅见于高剂量组,但为单发性,因此认为这些变化系动物的自发、偶发或非特异性病理改变,均与受试药物没有明显关系。给药6个月高剂量组 1 只动物 (No.14) 气管、 食管周围软组织出血伴肉芽组织形成的原因不详,可能与机械损伤等因素有关;给药6个月和恢复期末出现的胸腺退缩属大鼠的生理性改变;肺出血可能与处死时应激反应有关;各剂量用药组雌性动物子宫内膜的变化和高剂量组乳腺变化可能因药物中所含某种成分的类激素样作用所致。 见表 4,表 5。

表4 葛黄神箭片对大鼠主要脏器组织形态学的影响 (出现脏器病理改变动物数)Tab.4 Effect of Gehuang Shenjian Tablets on the morphology of main organs of rats( organ pathological changes animal number)

表5 葛黄神箭片对大鼠子宫组织形态学的影响 (出现子宫病理改变动物数)Tab.5 Effect of Gehuang Shenjian Tablets on them orphology changes of uterine tissue of rats(u terus pathological changes animal number)
4 讨论
祖国医学在治疗糖尿病方面有着悠久的历史,在众多的医书和民间中隐藏着不少疗效确切、表本兼治的宝贵处方,虽然受限于当时的科学技术水平,其中有不尽完善之处,但随着现代科学的高速发展、研究手段的不断提高,从中药或民间草药中整理、发掘疗效确切、安全性好的防治糖尿病的处方,并在此基础上将其研发成为现代药物制剂已成为可能。所以,研究注重治本、标本兼治、或以调节机体整体平衡为特色的预防和治疗糖尿病及其并发症的中药验方或民间秘方,并在此基础上,采用现代技术和手段,提取其中各个活性部位进行药效活性筛选和安全性评估,根据不同活性部位对疗效的协同作用进行科学组方,进而开发成具有鲜明疗效特点、以中药有效部位群为物质基础的现代中药复方制剂,已成为现代中药复方制剂研发的方向之一[9]。
葛黄神箭片源于葛黄神箭汤,由葛根总黄酮、黄柏总生物碱、鬼箭羽水提物等有效部位按一定比例组合而成,具有滋阴清火的功效,主治中轻度Ⅱ型糖尿病。前期主要药效学研究显示,葛黄神箭片具有刺激胰岛B细胞分泌胰岛素,增加胰岛素受体的敏感性,抑制糖水解酶活性,改善脂质代谢的药效活性,对蛋白质非酶糖基化反应和醛糖还原酶活性亦有一定的抑制作用。在此基础上,本实验就其长期给药的安全性进行评判。
葛黄神箭片自给药2周起,各剂量组动物耗食量下降,4~6周开始, 雄、 雌动物体质量增长开始变缓,其中以高剂量组程度最甚,中剂量组次之,低剂量组再次,呈一定的量效关系;停药后,给药组动物耗食量下降态势虽有所改观,但体质量恢复态势不明显。结果显示,葛黄神箭片可致大鼠耗食量降低,体质量增长放缓,而体质量增长缓慢与食耗量降低显著相关,提示该药物引起的食耗量下降可能就是导致体质量增长缓慢的一个主要原因。在整个给药和恢复期间,各给药组和对照组大鼠精神状态良好,皮毛光滑,呼吸顺畅,粪便成型,行为活动正常,血液学和凝血指标检测均无明显异常。 但是, 在给药 13、 27 周时, 中剂量组ALP和高剂量组 CK偏高, 其他各剂量组 CHOLT偏低;停药4周后,各指标均恢复正常。经对生化指标出现异常的动物心、肝组织进行形态学检查,结果均未见有异常,故分析认为葛黄神箭片对大鼠心、 肝组织无明显影响, 其血液 CHOLT降低可能与其降糖降脂的主要药效学作用有关[10], 但不排除摄食量下降因素导致的可能。
脏器湿质量称定质量结果显示, 给药 13周,雄性各剂量组动物肺、肾、睾丸、附睾指数、雌性中、 高剂量组动物肝指数偏高;给药 27周, 雄性各剂量组动物脑、心、肺、肾、肾上腺、睾丸、附睾指数、雌性各剂量组动物脑、心、肝、肾、子宫指数偏高;停药4周,雄性各剂量组动物脑、心、肺、肾、肾上腺、睾丸、附睾指数、雌性各剂量组动物脑、心、肝、肾、子宫指数均偏高。但病理检测未发现上述脏器 (子宫除外) 有明显的与药物相关的病理改变,且以脏脑比 (脏器与脑的比值)为指标,结果与对照组比较无显著性差异,故分析认为上述各组出现的脏器 (子宫除外) 差异可能与给药组体质量较轻有关。组织形态学镜检显示,在给药 27 周及停药 4周时, 各剂量用药组雌性动物子宫腔扩张,子宫内膜水肿、上皮脱落、核碎裂,高剂量组雌性动物有乳腺导管扩张等组织学变化特征,均属典型的激素样作用,可能为受试药物中富含异黄酮类成分 (如受试药物的含测成分葛根素) 等所致[11-12]。
综上, 葛黄神箭片给大鼠灌胃 4.37、1.94、0.73 g/kg, 每日 1 次,连续 27 周,其中高剂量相当于临床推荐剂量的90倍, 可使动物耗食量减少、体质量增长缓慢、CHOLT降低, 高剂量还可使雌性动物发生子宫腔扩张,子宫内膜水肿、上皮脱落、核碎裂,乳腺导管扩张等组织学变化特征。动物食耗量减少主要由于受试药物药性苦寒所致,进食量的减少可能导致体质量增长缓慢; CHOLT降低属受试药物降糖降脂主要药效学活性所为,子宫内膜组织学变化则为受试药物中富含葛根素等异黄酮类成分所致。结果提示,葛黄神箭片经口长期给药的安全剂量为 4.37 g/(kg·d), 相当临床推荐剂量的90倍。但对于育龄期妇女, 建议就其长期给药的雌激素样作用作进一步的临床观察。
[ 1 ] 赵淑芹.葛根的药理作用与临床应用[J].中国医药科学,2013, 3(2): 40-41, 43.
[2] 徐灵源,黎 荣,梁 韬,等.葛根总黄酮逆转链脲佐菌素诱导糖尿病小鼠胰腺损伤的研究[J].中国实验方剂学杂志, 2013, 19(8): 231-234.
[3] 胡俊青, 胡 晓.黄柏化学成分和药理作用的现代研究[J].当代医学, 2009, 15(7): 139-141.
[4] 周明伟,范明松,季宇斌.黄柏中几种生物碱的分离、鉴定及促胰岛素分泌活性筛选[ J].中国医药指南, 2011, 9(7): 54-55.
[5] 郎素梅,朱丹妮,余伯阳,等.中药鬼箭羽降糖有效部位的药效学和化学研究[J].中国药科大学学报, 2003, 34(2): 128-131.
[6] 李玉杰,龚慕辛,来媛媛,等.鬼箭羽不同提取部位对糖尿病大鼠药理作用的研究[J].北京中医药大学学报,2010, 33(2): 179-182.
[7] 医药信息编辑部.中药、天然药物研究技术指导原则:第28 辑[J].医药信息专辑, 2005.
[ 8] 袁伯俊, 王治乔.新药临床前安全性评价与实践 [M].北京: 军事医学科学出版社, 1997: 23-42.
[9] 梁琼麟,罗国安,邹健强,等.中药复方新药创制及技术支撑体系[J].世界科学技术-中医药现代化, 2008, 10(3): 1-7.
[10] 沈 宁, 李彩娜, 环 奕, 等.小檗碱调节血糖血脂代谢紊乱 机 制 研 究 进 展 [ J].药 学 学 报, 2010, 45 (6 ):699-704.
[11] 张 伟, 汤旭磊, 田 泉.葛根素雌激素样作用的实验研究[J].中国妇幼保健, 2005, 20(17): 2243-2245.
[12] 巴音吉日嘎拉.葛根素对小白鼠乳房发育的影响及其作用机理的研究[D].呼和浩特: 内蒙古农业大学, 2008.
Safety evaluation of Gehuang Shenjian Tablets on rats
XIE Jia-jun1, ZHANG Guo-ming2, QIAO Zheng-dong3, RUAN Ke-feng1
(1.Shanghai University of Traditional Chinese Medicine, Shanghai 201203, China; 2.Shanghai Institute of Chinese Materia Medica, Shanghai 200032, China; 3.Shanghai Pudong Hospital, Shanghai 201399, China)
Gehuang Shenjian Tablets; rats; chronic toxicity test; safe dosage; estrogen-like effect
R285.5
: A
: 1001-1528(2014)03-0473-09
10.3969/j.issn.1001-1528.2014.03.007
2013-09-22
国家 “十二五” 科技重大专项课题 (2011ZX09301-009)
谢 家 骏 ( 1959—) , 男, 研 究 员, 硕 士生导 师, 研 究方向: 药 理 毒 理学研 究 与 中 药 新 药。 Tel: ( 021 ) 51322395, E-mail:xiejj001@163.com
