大孔吸附树脂富集天南星总黄酮部位的影响因素
2014-04-11申利娜张永太张素娟朱春赟冯年平
申利娜, 张永太, 王 芹, 张素娟, 朱春赟, 许 玲*, 冯年平*
(1.上海中医药大学,上海 201203; 2.上海中医药大学附属龙华医院, 上海 200032)
大孔吸附树脂富集天南星总黄酮部位的影响因素
申利娜1, 张永太1, 王 芹2, 张素娟1, 朱春赟1, 许 玲2*, 冯年平1*
(1.上海中医药大学,上海 201203; 2.上海中医药大学附属龙华医院, 上海 200032)
目的 系统考察各种因素对大孔吸附树脂富集天南星中总黄酮部位的影响,并探讨富集工艺各阶段的大孔吸附树脂表面形态变化。方法 以吸附率和解吸率为指标,采用静态吸附法富集黄酮类成分,采用紫外分光光度法测定总黄酮的量;考察树脂型号,洗脱溶剂体积分数,上样药液质量浓度,吸附时间,温度等因素对富集天南星中总黄酮部位的影响;以环境扫描电镜观察树脂吸附前、吸附后、解吸后的表面微观形态的变化。结果 所考察各因素均可对树脂对总黄酮部位的富集能力产生不同程度的影响, 优选的富集条件为: 采用 AB-8 树脂, 上样药液质量浓度为 1 g(生药) /mL, 在 25 ℃静态吸附 6 h, 在 45 ℃下以 60%乙醇为洗脱溶媒 (树脂∶洗脱溶媒为 1 ∶5, W/V) 洗脱; 树脂吸附药液后,表面增厚凸起,颜色加深,可观察到吸附较多物质,洗脱后表面凹凸不平,颜色变淡,推测吸附物质被有选择地洗脱。结论 大孔吸附树脂可有效富集天南星中总黄酮部位。
大孔吸附树脂;静态吸附;天南星;总黄酮;扫描电镜
天 南 星 为 天 南 星 科 植 物 天 南 星 Arisaema erubescens( Wall.) Schott、 异 叶 天 南 星 Arisaema heterophyllum Bl.或东北天南星 Arisaema amurense Maxim.的干燥块茎[1]。 天 南星性 味苦、 辛、 温、有毒, 具有抗肿 瘤、 镇 静、 镇 痛 等作用[2-4], 一般供外用。天南星主要化学成分有黄酮类、苷类、生物碱类等多种化学成分。黄酮类成分为天南星中有效组分之一[2], 居羚等[5]应用液质联用技术 ( LCMS) 研究天南星成分, 发现天南星中的黄酮组分为一组苷元以芹菜素为主,且相对分子质量与夏佛托苷相同或相近的黄酮碳苷同分异构体, 2010 年版 《中国药典》 中规定以芹菜素为标准物质, 三乙胺为显色剂, 在 400 nm处采用紫外分光光度法测定天南星中总黄酮量, 以此控制药材质量[1]。
大孔吸附树脂 ( macroporous absorption resin )是由聚合单体和交联剂、致孔剂、分散剂等添加剂经聚合反应制备而成的一类有机高聚物吸附剂,近几年已广泛应用于天然产物的分离纯化[6], 已报道 的 有 黄 酮 类[7], 生 物 碱 类[8]、 萜 类[9], 皂 苷类[10]等。 黄酮类化合物, 具有多酚结构, 依靠大孔吸附树脂与其之间的范德华力进行吸附,可取得良好分离纯化效果[11]。 本实验采用大孔吸附树脂富集天南星中的总黄酮部位,采用静态吸附法,系统考察各种因素对大孔吸附树脂富集效果的影响,优选富集工艺,并采用扫描电镜对大孔吸附树脂的表面进行表征,分析富集过程中,大孔吸附树脂表面微观形态的变化。
1 仪器与试药
UN754N型紫外分光光度仪 (上海精密科学仪器有限公司),HZS-H型水浴振荡器 (哈尔滨市东联电子技术开发有限公司), JA31002 型电子天平(上海精天电子仪器有限公司), XL30 型环境扫描电镜 (荷兰 Philips公司);生南星饮片 (上海康桥中药饮片有限公司, 产地为河北, 批号 110706),经我校生药学教研室专家鉴定, 为 2010 年版 《中国药典》 收载品种[1], 芹菜素对照品 ( 中国药品生物 制 品 检 定 所, 批 号 111901-201102 ); AB-8、HPD-100、HPD-300 型大孔吸附树脂 (上海摩速科学器材有限公司); 实验用试剂均为分析纯 (上海国药集团化学试剂有限公司)。
2 实验方法
2.1 总黄酮检测方法学考察
2.1.1 标准曲线的绘制[1]精密称取芹菜素对照品 1.23 mg, 置 100 mL量瓶中, 加 60%乙醇溶解,并稀释至刻度, 得 12.3 μg/mL对照品溶液 (母液)。 精密移取对照品溶液 1、2、3、4、5 mL, 分别置10 m L量瓶中, 各加60%的乙醇稀释至5 m L,再加1%的三乙胺水溶液至刻度, 摇匀, 以相应的试剂为空白, 在 400 nm波长处测定吸光度, 以进样量为横坐标,吸光度为纵坐标,绘制标准曲线,得回归方程为 y=0.017+0.128x, r=0.999 8, 即芹菜素在 1.23 ~6.15 μg范围内, 待测物质进样量与吸光度之间有良好的线性关系。
2.1.2 精密度试验 精密移取 2.0 mL芹菜素对照品母液置于10 mL量瓶中, 加60%的乙醇至5 m L。按照标准曲线的制备项下的方法, 自 “加 1%三乙胺水溶液”起,依法测定吸光度,连续5次。测得的吸光度的 RSD为 0.17%, 表明仪器精密度良好。
2.1.3 重复性试验 取 “2.2” 项下制备的天南星提取液的稀释液 5 份, 每份 2 mL, 置 10 mL量瓶中。按 “2.1.1” 项下 “自加 60%的乙醇至 5 mL” 起, 进行实验, 其 RSD为 0.14% (n=5),说明天南星总黄酮的测定方法重复性较好。
2.1.4 稳定性试验 取 “2.2” 项下制备的天南星提取液2 mL, 置10 mL量瓶中。 按 “2.1.1” 项下 “自加 60%的乙醇至 5 mL” 起, 制备样品, 分别于 0.5、 1、 2、 4、 8 h 测定吸光度。 其 RSD为0.17%,说明8 h 内待测样品稳定性较好, 可以满足实际实验中的样品检测时间要求。
2.1.5 回收率试验 取 10 m L量瓶 5 只, 1 号加提取液2 mL, 2 ~4号加2 mL提取液和2 m L对照品母液, 5 号加2 mL对照品母液。按 “2.1.1” 项下操作, 求得的回收率分别为 99.64%、 99.88%、97.85%, 其 RSD为 0.95%, 表明方法的回收率较好。
2.2 天南星提取液的制备 称取天南星饮片 600 g, 加6 倍量 (m/V) 的 80%的乙醇回流提取3 次,每次 1.5 h, 过滤, 合并滤液, 减压浓缩, 回收乙醇至无醇味,置 100 mL量瓶中, 加蒸馏水溶解,并稀释至刻度, 得 6 g(生药) /mL药液, 使用时以蒸馏水稀释至适当浓度。
2.3 树脂的预处理 取一定量的树脂, 用 95%的乙醇浸泡 24 h, 充分溶胀, 用蒸馏水洗至无醇味,吸干表面水分,备用。
2.4 树脂型号对天南星总黄酮富集的影响 取已处理好的 AB-8、 HPD-100、 HPD-300 3 种型号的大孔吸附树脂各 3 份, 每份 3 g, 置 50 mL具塞锥形瓶中, 加入 15 mL生药质量浓度为 0.4 g/mL的天南星提取液, 在 25 ℃下振摇 12 h, 静置 12 h, 使其达到饱和吸附,吸取上层液,水浴浓缩,按药典法测定总黄酮的量,计算各树脂的吸附量。上述经静态吸附总黄酮后滤出的树脂,用滤纸吸干表面水分, 称取2 g, 加入30%乙醇 10 mL, 同法振摇 12 h, 静置 12 h, 滤出, 测定洗脱液中总黄酮的量。
2.5 洗脱溶媒对天南星总黄酮解吸的影响 称取处理好的 AB-8 树脂, 每份 3 g, 加入质量浓度为0.4 g/mL的提取液 15 m L。 25 ℃振摇 12 h, 静置12 h使其达到饱和吸附, 分离树脂, 吸干表面水分。称取2 g含药树脂,对应加入体积分数分别为10%、 30%、 40%、 50%、 60%、 80% 的 乙 醇10 mL, 平行3 份, 同法振摇、 静置,测定洗脱液中总黄酮量,计算洗脱率。将洗脱液水浴挥干,干浸膏称定质量,计算洗脱纯度。取上样药液水浴挥干,计算上样药液所得干浸膏中总黄酮含量,比较吸附前后的纯度 (纯度 =干浸膏中总黄酮量/干浸膏质量×100%, 纯度比 =树脂纯化后纯度/纯化前纯度。
2.6 药液质量浓度对天南星总黄酮吸附的影响称取9份处理好的树脂, 每份3 g,分别加入生药质量浓度为 1、 0.4、 0.2 g/mL的提取液, 各平行操作3份,同法振摇静置,测定上层液中药物质量浓度, 计算吸附量和吸附率。 取含药树脂 2 g, 加10mL 60%的乙醇洗脱, 测定洗脱液的吸光度计算洗脱率。
2.7 温度和吸附时间对总黄酮吸附的影响 称取3 份处理好的树脂, 每份 3 g, 分别加入 15 m L生药质量浓度为 1 g/mL的提取液, 25 ℃下振摇, 分别于 2、 4、6、 8、12、 24 h 取上层液 2 mL,并补入同等体积的蒸馏水, 上层液用 0.45 μm微孔滤膜过滤后,照药典法测定吸光度,计算各个时间点的上层液中总黄酮残留量,计算吸附量和吸附率,同法测定在 35、 45、 55 ℃下不同时间的吸附率。
2.8 温度对总黄酮解吸的影响 称取 12 份处理好的树脂, 每份 3 g, 分别加入 15 mL生药质量浓度为 1 g/mL的提取液, 25 ℃振摇 12 h,静置 12 h,分离树脂, 吸干表面水分。 称取 12份含药树脂,每份 2 g, 加入 10 mL 60%的乙醇, 分别在 25、35、 45、 55 ℃洗脱, 计算洗脱率。
2.9 吸附及洗脱对树脂表面微观形态的影响 称取3 g处理好的树脂3份,1份置真空干燥箱中烘干, 另2 份置25 mL锥形瓶中, 分别加入15 mL天南星提取液, 水浴震荡 12 h, 静置 12 h,分离树脂。 其中一份含药树脂同法烘干, 另一份加 60%乙醇洗脱,分离洗脱后的树脂,同法烘干。3份干树脂分别经环境扫描电镜扫描,分析表面形态变化。
2.10 数据分析方法 结果以均值 ±标准偏差表示, 采用 SPSS 19.0 对结果进行单因素方差分析,P <0.05 时认为有统计学差异; P<0.01 时认为差异极显著。
3 实验结果
3.1 树脂型号对天南星总黄酮富集的影响 结果显示 (表1), 3 种树脂吸附率均较高,直观分析以 AB-8 和 HPD-100 树脂对天南星总黄酮吸附率几乎无差异, 且均高于 HPD-300 树脂, 统计分析结果显示, AB-8 树脂与 HPD-100 树脂相比, 吸附率差异不明显 (P>0.05), 而与 HPD-300 树脂相比具有显著性差异 (P<0.05); HPD-100 树脂解吸率最低,与其余两种型号树脂相比均有显著性差异(P<0.05), 以 AB-8 树脂对总黄酮的解吸率最高。综合分析, 优选 AB-8 树脂进行天南星中总黄酮部位的富集工艺研究。
表1 树脂型号对天南星中总黄酮富集的影响 (, n=3)Tab.1 Effects of macroPorous resin tyPes on the enrichm ent of total flavonoids from Arisaematis Rhizoma (, n=3)
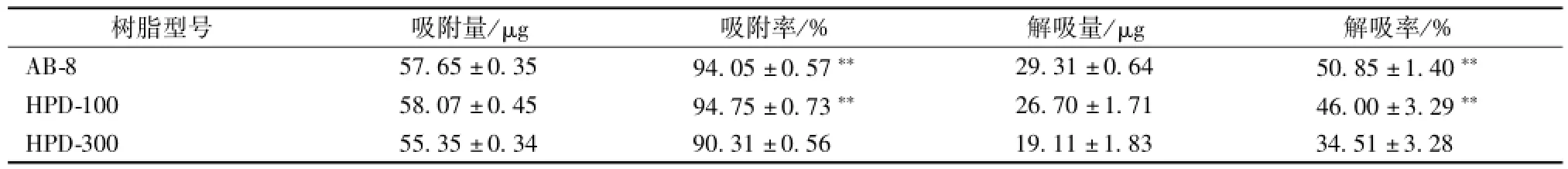
表1 树脂型号对天南星中总黄酮富集的影响 (, n=3)Tab.1 Effects of macroPorous resin tyPes on the enrichm ent of total flavonoids from Arisaematis Rhizoma (, n=3)
注: 与 HPD-300 树脂相比,**P<0.01吸附率 = (初始药液质量浓度 -吸附后药液质量浓度) /初始药液质量浓度 ×100%; 洗脱率 =洗脱液药物质量浓度 ×洗脱液体积/吸附量 ×100%
树脂型号 吸附量/μg 吸附率/% 解吸量/μg 解吸率 /% AB-8 57.65 ±0.35 94.05 ±0.57** 29.31 ±0.64 50.85 ±1.40**HPD-100 58.07 ±0.45 94.75 ±0.73** 26.70 ±1.71 46.00 ±3.29**HPD-300 55.35 ±0.34 90.31 ±0.56 19.11 ±1.83 34.51 ±3.28
3.2 洗脱溶媒与解吸温度对天南星总黄酮解吸的影响 随着乙醇体积分数的增加,解吸率增大(图1), 以60%及 80%乙醇洗脱所得解吸率较大,与其他组相比均有显著性差异 (P<0.01)。 但用高体积分数乙醇洗脱时,一些脂溶性的成分也被洗脱,影响纯度。通过计算干浸膏中总黄酮的纯度比发现 (图2), 60%乙醇洗脱纯度比最大, 且与其它组相比差异显著 (P<0.01)。
随着温度的升高,总黄酮洗脱率增大,至45 ℃时达到最高 (图 3)。 与 45 ℃下所得洗脱率相比, 25 ℃组及 35 ℃组下洗脱率均较小 (P<0.01), 而55 ℃下所得洗脱率与 45 ℃组无明显差异 (P>0.05)。
3.3 药液质量浓度对天南星总黄酮吸附的影响药液质量浓度对天南星总黄酮吸附率与解吸率均有影响,随着药液质量浓度的增加,吸附率与解吸率均呈升高趋势 (表 2)。 当药液质量浓度为 1 g/mL时,吸附率和解吸率均较高。
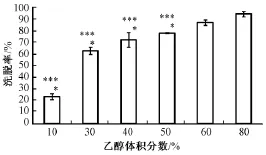
图 1 不同体积分数乙醇对 AB-8 树脂中天南星总黄酮洗脱率的影响Fig.1 Elu tion rate of total flavonoids from Arisaematis Rhizoma using macroPorous resin

图 2 不同体积分数乙醇洗脱对 AB-8 树脂中天南星总黄酮纯度比的影响Fig.2 Purity ratio ( Purity of enriched extract versus crude extract) of total flavonoids from Arisaematis Rhizoma using macroPorous resin AB-8 following different concentrations of alcohol solution as eluting solvent
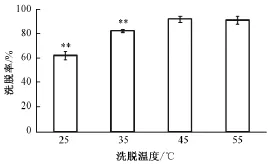
图 3 以 60%乙醇在不同温度下洗脱所得 AB-8 树脂中天南星总黄酮的洗脱率Fig.3 Elution rate of total flavonoids from Arisaematis Rhizoma usingm acroPorous resin AB-8 follow ing different elution tem Perature w ith 60% ethanol solution as eluting solvent
3.4 吸附时间和温度对天南星总黄酮吸附的影响
本实验比较了4个温度下吸附时间对天南星总黄酮吸附的影响。不同温度下总黄酮吸附率的变化趋势并不一致 (图 4), 在 25 ℃与 45 ℃下, 吸附率在2~8 h内随时间延长, 呈现先升后降的趋势,继而变化趋于平稳; 而35 ℃与55 ℃组则随时间延长,吸附率增大,8 h后趋于稳定,表明已经达到饱和吸附。 综合比较, 以在 25 ℃吸附 6 h所得吸附率最大, 为 (88.9 ±0.018)%。
综合以上研究结果,优化的工艺为:采用AB-8 树脂, 上样药液质量浓度为 1 g( 生药) /mL,树脂质量与药液体积比为 1 ∶5 ( m/V), 在 25 ℃静态吸附 6 h, 在 45 ℃下以 60%乙醇为洗脱溶媒(树脂 ∶洗脱溶媒为1 ∶5, m/V) 洗脱。
表2 药液质量浓度对天南星中总黄酮吸附的影响 (, n=3)Tab.2 Effects of various concentrations of extracting solu tions on the adsorPtion of total flavonoids from Arisaematis Rhizoma using macroPorous resin AB-8 (, n=3)

表2 药液质量浓度对天南星中总黄酮吸附的影响 (, n=3)Tab.2 Effects of various concentrations of extracting solu tions on the adsorPtion of total flavonoids from Arisaematis Rhizoma using macroPorous resin AB-8 (, n=3)
注: 与 1.0 g/mL组相比,**P<0.01,*P<0.05
药液 /( g·mL-1) 吸附 量 /μg 吸附 率 /% 解吸 量 /μg 解 吸率 /% 1.0 151.96 ±1.42 87.17 ±0.82 125.48 ±3.17 84.32 ±0.82 0.4 55.24 ±0.18 85.62 ±0.28* 45.96 ±1.26 83.21 ±2.15 0.2 27.28 ±0.12 79.95 ±0.35** 20.19 ±1.29 73.99 ±4.59**
3.5 树脂表面微观形态变化 树脂表面结构如图5 ~7。 吸附前树脂表面相对光滑, 结构紧密, 孔隙清晰。吸附后表面有突起,颜色加深,应为药液被吸附、干燥后所留固形物。洗脱后树脂表面颜色变浅,结构疏松且凹凸不平,应为洗脱溶媒对大孔吸附树脂吸附的物质进行有选择性的洗脱后,未洗脱的物质干燥后所留固形物。通过对树脂表面微观形态的展现,可较直观地观察大孔吸附树脂对药物成分的吸附与解吸情形。
4 讨论
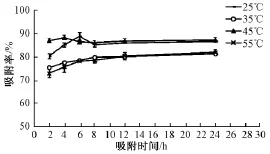
图 4 不同温度下 AB-8 树脂对天南星中总黄酮吸附率随时间变化的趋势Fig.4 AdsorPtion rate-time Profiles for total flavonoids from Arisaematis Rhizoma using macroPorous resin AB-8 follow ing different temPeratures

图 5 吸附前 AB-8 大孔吸附树脂表面结构Fig.5 Surface structure of AB-8macroPorous resin

图 6 吸附 天南星提取 液后 AB-8 大孔吸附树脂 表面结构Fig.6 Surface structure of extracting solution( from Arisaematis Rhizoma ) -adsorbed AB-8 macro-Porous resin
大孔吸附树脂对活性成分的吸附主要为树脂表面与有机分子间以范德华力或生成氢键实现,而对成分的选择性吸附,一般认为是由于树脂孔径、药物成分的分子量大小及与树脂间的吸附力不同引起。大孔吸附树脂的结构性质,如极性、孔径等,均可对药物成分的富集能力有一定影响[12], 而上样药液的质量浓度、解吸剂的种类,吸附与解吸温度等吸附处理过程的操作条件,也是在采用大孔吸附树脂富集有效成分时需要系统考察的因素。

图 7 以 60%乙醇洗脱后 AB-8 大孔吸附树脂表面形态Fig.7 Surface structure of extracting solution( from Arisaematis Rhizoma) -adsorbed AB-8 macro-Porous resin after having beeneluted w ith 60% ethanol solution
在本实验中,所需富集的天南星总黄酮部位为极性较弱的脂溶性部位, 因此弱极性的 AB-8 型树脂对该部位表现出较好的吸附效果, 采用 AB-8 型树脂,其对天南星总黄酮的吸附率与解吸率均较高。大孔吸附树脂的表面发生吸附作用后,树脂表面上溶质的浓度较高,而溶剂内溶质的浓度降低,引发体系内放热和自由能的下降。由于大孔吸附树脂的吸附作用主要为物理吸附,在吸附与解吸过程中,体系温度对实验结果可能有一定影响,因此需要进行综合考察。本实验结合实际生产需要,考察了 25 ~55 ℃下大孔吸附树脂对天南星总黄酮的吸附与解吸情况,发现温度升高,解吸率增加,而吸附率并不增加,这与文献报道的低温有利于吸附,高温有利于洗脱相一致,温度升高,树脂膨胀,多酚类成 分动能增加[13], 不利于吸附。 在 8 h 前,吸附率随时间变化有较大波动,8 h后趋于稳定,提示吸附作用可能需要较长时间的平衡,但物理吸附一般不需要活化能,故吸附和脱附速率都较快,分析本实验中吸附平衡时间较长的原因,可能与上样药液为总黄酮水混悬液有关,黄酮类成分需要在水溶液中溶解后以分子形式被有效吸附,大孔吸附树脂对游离黄酮分子的持续吸附,使混悬液中黄酮类成分不断溶解,而物理吸附对分子的吸附作用具有多层吸附能力,因此该吸附过程可持续较长时间,直至吸附饱和。大孔吸附树脂表现出的物理吸附作用,与吸附物质的质量浓度的大小密切相关,一般上样液质量浓度越低越利于吸附,但在本实验所考察的上样药液质量浓度中,随着质量浓度的增加,吸附率增大,推测其原因仍可能与上样药液为混悬液状态有关,综合考虑大孔吸附树脂的使用效率与生产成本, 确定以 1 g(生药) /mL的药液质量浓度上样较为适宜。实验中考察了不同温度下吸附率随时间的变化,但吸附率变化趋势与温度之间没有明显的规律,关于温度对吸附率的影响机理,尚需深入研究。
采用优选的富集工艺,所得干浸膏中总黄酮纯度较纯化前提高 2.6 倍, 纯化后所得干浸膏黏度明显减小,提示可能已除去较多的多糖类与蛋白类成分,为后期制剂研究奠定基础。
[ 1 ] 国家药典委员会.中华人民共和国药典: 2010 年版一部[S].北京: 中国医药科技出版社, 2010: 53.
[2] 杜树山,雷 宁, 徐艳春, 等.天南星黄酮成分的研究[J].中国药学杂志, 2005, 40(19): 1457-1459.
[ 3 ] 王志强.天南星化学成分与药理作用研究进展[J].药物评价研究, 2009, 32(2): 144-149.
[4] 汤建华,任雁林, 刘克勤, 等.天南星药理作用和临床应用研究概况[ J].陕西中医, 2010, 31(4) : 478-479.
[5] 居 羚,韩文静, 池玉梅.天南星药典品种黄酮含量测定和鉴别方法的研究[ J] .中成药, 2010, 32(2) : 308-311.
[6] 于智峰,王 敏.大孔吸附树脂在黄酮类化合物分离中的应用[J].中药材, 2006, 9(12): 1380-1384.
[ 7 ] Fu Y, Zu Y, Liu W, et al.Optimization of luteolin separation from pigeonpea[ Cajanus cajan ( L.) Millsp.] leaves bymacroporous resins[ J] .J Chromatogr A, 2006, 1137 ( 2 ) :145-152.
[ 8 ] Pi G, Ren P, Yu J, et al.Separation of sanguinarine and chelerythrine in Macleaya cordata (W illd) R.Br.based onmethyl acrylate-co-divinylbenzene macroporous adsorbents [ J] .J Chromatogr A, 2008, 1192(1) : 17-24.
[ 9 ] Fu Y, Zu Y, Li S, et al.Separation of 7-xylosyl-10-deacetyl paclitaxel and 10-deacetylbaccatin III from the remainder extracts free of paclitaxelusingmacroporous resins[ J] .JChromatogr A, 2008, 1177(1) : 77-86.
[10] Jia G, Lu X.Enrichment and purification ofmadecassoside and asiaticoside from Centella asiatica extractswith macroporous resins[ J].JChromatogr A, 2008, 1193(1/2) : 136-141.
[11] Geng X, Ren P, Pi G, et al.High selective purification of flavonoids from natural plants based on polymeric adsorbent with hydrogen-bonding interaction [ J] .J Chromatogr A, 2009,1216(47): 8331-8338.
[12] Li C, Zheng Y, Wang X, et al.Simultaneous separation and purification of flavonoids and oleuropein from Olea europaea L.( olive) leaves usingmacroporous resin [ J].JSci Food Agric,2011, 91(15): 2826-2834.
[13] Sun L, Guo Y, Fu C, et al.Simultaneous separation and purification of total polyphenols, chlorogenic acid and phlorizin from thinned young apples[ J].Food Chem, 2013, 136 ( 2 ) :1022-1029.
Enrichm ent of total flavonoids from Arisaematis Rhizoma usingm acroPorous resin
SHEN Li-na1, ZHANG Yong-tai1, WANG Qin2, ZHANG Su-juan1, ZHU Chun-yun1, XU Ling2*,FENG Nian-ping1*
(1.Shanghai University of Traditional Chinese Medicine, Shanghai201203, China; 2.Longhua Hospital Affiliated to Shanghai University of Traditional Chinese Medicine, Shanghai 200032, China)
macroporous resin; static adsorption; ArisaematisRhizoma; total flavonoid;scanning electronmicroscope
R944
: A
: 1001-1528(2014)01-0076-06
10.3969/j.issn.1001-1528.2014.01.019
2013-03-17
上海市卫生局卫生系统新百人 (优秀学科带头人培养) 计划项目 (XBR2011063)
申利娜 (1988—), 女, 硕士生, 研究方向: 中药新型给药系统。 Tel: (021) 51322684
*通信作者: 冯年平 (1967—) , 男, 教授, 研究方向: 中药新型给药系统。 E-mail: npfeng@hotmail.com许 玲 (1967—) , 女, 教授, 研究方向: 中医内科 ( 肿瘤专业) 。 Tel:(021)33324008-1303, E-mail: xulq67@gmail.com
