雷公藤内酯醇对 C57BL/6 小鼠亚慢性毒性作用的研究
2014-04-11刘星雨王笃军
吴 娜, 刘星雨, 王笃军, 罗 盼, 吴 瑶, 魏 渊
(江苏大学药学院, 江苏 镇江 212013)
雷公藤内酯醇对 C57BL/6 小鼠亚慢性毒性作用的研究
吴 娜, 刘星雨, 王笃军, 罗 盼, 吴 瑶, 魏 渊*
(江苏大学药学院, 江苏 镇江 212013)
目的 探讨长期应用雷公藤内酯醇对 C57BL/6 小鼠全身主要组织功能的毒性和生化指标的影响。 方法 8 周龄C57BL/6 小鼠 30 只, 随机分为 3 组。 分别腹腔注射雷公藤内酯醇连续 30 d。 观察小鼠体质量变化。 采用 ELISA法检测血清中谷丙转氨酶、谷草转氨酶和尿素氮水平并检测肝组织匀浆中谷丙转氨酶、谷草转氨酶,还原型谷胱甘肽和肾组织匀浆中还原型谷胱甘肽水平; 求脏器指数; 病理组织切片 H&E染色法观察 C57BL/6 小鼠肝脏、 肾、 胃、 肺、 睾丸、 脾、 十二指肠等组织。 结果 与正常对照组比较, 雷公藤内酯醇组小鼠28 d 时体质量增长明显降低; 雷公藤内酯醇高剂量组血清中的尿素氮有较显著上升,肝组织和肾组织中的还原型谷胱甘肽水平都出现降低并有显著性差异;雷公藤内酯醇组小鼠睾丸脏器指数都降低,而高剂量组小鼠脾脏脏器指数出现上升,其他脏器指数无显著性差异;观察病理组织切片发现 C57BL/6 小鼠低剂量组与高剂量组小鼠肾、 脾脏、 睾丸均有明显损伤, 高剂量组损伤更严重。结论 长期应用雷公藤内酯醇对 C57BL/6 小鼠全身主要组织功能有一定的影响, 尤其对小鼠肾、 脾脏和睾丸功能有较强的毒性作用。
雷公藤内酯醇; C57BL/6 小鼠; 亚慢性毒性
雷公藤 Tripterygium wilfordii Hook.f.为卫矛科一年生藤本植物,广泛分布于我国长江以南各省区及西南各地。雷公藤作为中医临床常用药物,应用十分广泛。近年来研究发现雷公藤对器官移植的排斥反应、自身免疫性疾病、肾病综合征、癌症等方面疗效显 著[1-2]。 雷 公 藤 内酯 醇 ( triptolide) 是从雷公藤中分离出的活性最高的环氧化二萜内酯化合物,是雷公藤的主要有效成分之一,其相关效价比雷公藤总苷高 100 ~200 倍[3]。 药理和临床试验表明 其 具 有 抗 肿 瘤、 免 疫 抑 制、 抗 炎[4]及 抗 生育[5]等生物活性。此外, 耶鲁大学 Crews研究组于2007 年在 《美国科学院院刊 (PNAS)》 上报道了雷公藤内酯醇能明显减少小鼠多囊肾 (PKD) 胞囊的形成[6], 为治疗这一导致肾衰竭的重要疾病提供了新的思路。 明尼苏达大学 Antonoff等在 2009年报道雷公藤内酯醇可降低胰腺癌细胞中的 HSP70水平,进而减少小鼠体内的肿瘤细胞,可以有效治疗胰腺癌[7]。
随着雷公藤内酯醇临床应用的推广,它的毒副作用也引起人们普遍关注,其不良反应主要发生在消化系统、泌尿系统、生殖系统、心血管系统、骨髓及血液系统,此外还可引起水肿、血糖升高、复视等[8]。 小鼠动物模型是研究雷公藤内酯醇体内毒性的良好工具, 刘良等[9]采用昆明种小鼠进行亚慢性中毒实验,发现长期应用雷公藤内酯醇能引起小鼠肾损伤及睾丸萎缩。然而雷公藤内酯醇对小鼠其他重要组织器官的亚慢性毒性作用影响目前仍不十分明确,因此急需对此进行更系统的研究。昆明种小鼠是我国生产量、使用量最大的远交群小鼠,被广泛应用于药理学、毒理学等领域的研究,但存在基因杂合率高, 遗传背景复杂的问 题[10],在毒理学研究方面存在一定的局限性,这就为后续的研究带来了障碍。为解决这一问题,本实验选用C57BL/6 小鼠这一标准近交品系, 对雷公藤内酯醇亚慢性毒性作用进行了初步的研究,以期得到精度更高,可比性更好,应激反应更为均一的实验数据,为更深入地研究雷公藤内酯醇的临床毒性提供依据。
1 材料与方法
1.1 主要试剂 雷公藤内酯醇 (纯度大于 99%)购买于 Chroma Dex。 谷丙转氨酶 (alanine transaminase, ALT) 、 谷草转氨酶 ( aspartate transaminase,AST)、尿素氮 (blood urea nitrogen,BUN) 和还原型谷胱甘肽 ( glutathione,GSH) ELISA检 测试剂盒均购买于南京建成生物工程研究所。 BCA蛋白浓度试剂盒购买于碧云天生物技术研究所。其余为国药集团化学试剂有限公司生产的分析纯或生化级试剂。
1.2 药品的配制 精密称取雷公藤内酯醇充分溶解于吐温 80, 再以氯化钠注射液稀释至所需剂量,吐温 80 在终溶液中比例不超过 1% (V/V), 4 ℃冰箱保存。
1.3 实验动物 本实验应用的 C57BL/6 小鼠, 均购买于南京大学模式动物研究所,合格证号:SCXK (苏) 2010-0001, 体质量 18 ~22 g(20 ± 2 g), 雄性, 8 周大小。 购买后在实验室适应性饲养一周后用于正式实验, 室温 22 ~25 ℃, 相对湿度 65%, 12 h 明暗交替照明, 自由进食、 饮水。
将实验动物完全随机分为3个实验组,每组10只, 分别设为正常对照组, 低剂量组和高剂量组。 给药期限为 30 d, 给药方式为每 48 h 腹腔注射 1 次, 雷公藤内酯醇小鼠腹腔注射的 LD50为0.86 mg/kg[11], 本实验采用正常临床给药剂量依次设为: 正常对照组, 用氯化钠注射液与吐温80按同样比例混和作溶剂对照,按体质量给予相当量的溶剂对照液; 低剂量组, 按 100 μg/kg腹腔注射雷公藤内酯醇溶液; 高剂量组, 按 200 μg/kg腹腔注射雷公藤内酯醇溶液。每次给药前称定质量,末次给药后, 隔天禁食12 h, 用二氧化碳窒息法处死小鼠。
1.4 观察指标及方法
1.4.1 小鼠体质量变化观察 分别于给药前、 给药 7、 14、 21、 28 d 时称量动物体质量, 称体质量前动物均禁食 12 h。
1.4.2 血清生化指标的测定 实验结束后, 将 3组小鼠以二氧化碳窒息法处死。心脏取血,室温血液自 然 凝 固 2 h, 离 心 20 min ( 3 000 r/min)收集上清, 放于 -80 ℃保存直至分析。 测定血清ALT、 AST及 BUN, 分别用于了解肝功能及肾功能。
1.4.3 组织中的生化指标的测定 处死后的小鼠, 取其各脏器称定质量后, 将肝脏 (3/4) 肾(1/2) 冻于 -80 ℃冰箱中待用。 准确称取肝组织的质量,按质量体积比加9倍的生理盐水制成10%的匀浆,3 500 r/min离心 10 min, 取上清待测。 测定肝组织中的 ALT、 AST及 GSH值进一步了解肝功能。
1.4.4 脏器指数的测定 实验结束后, 称取所有动物的体质量,并将心脏、肝脏、脾脏、肺、肾及双侧睾丸称定质量,求脏器指数。观察药物对各脏器的影响,进行初步的毒性判断。
1.4.5 病理组织切片观察 实验结束后, 将各组织器官剔除脂肪组织及筋膜后称定质量,取肝脏、肾、胃、肺、睾丸、脾、十二指肠等器官,随即放入装有10%中性福尔马林固定液的标本瓶中浸泡固定, 48 h后作病理组织学检查, 常规取材, 脱水, 石蜡包埋, 制片 (5 μm厚), H&E染色, 光镜观察各个器官组织形态学变化及黏膜、黏膜下间质形态学的改变。
2 结果
2.1 雷公藤内酯醇给药组 C57BL/6 小鼠体质量增长变缓 雷公藤内酯醇腹腔注射 C57BL/6 小鼠 7 d时所有动物体质量均较给药前上升,增加的幅度与正常对照组基本接近或稍低。实验进行到 14 d时各组动物体质量出现了明显不同的变化。低剂量组及高剂量组小鼠体质量仍表现为一定程度的增加,但增加的幅度较正常对照组有较大程度的减缓。而实验进行到21 d时, 高剂量组所有小鼠体质量与溶剂对照组小鼠相比,体质量增长幅度明显下降,平均体质量降至接近给药前。 实验进行到28 d时,低剂量组和高剂量组小鼠所有体质量增长幅度与溶剂对照组相比均明显下降,个别小鼠体质量甚至降至低于给药前的水平, 结果见图1。除体质量的变化外,给药后的小鼠外观未观察到明显的毒性表现。
2.2 雷公藤内酯醇给药对 C57BL/6 小鼠血清中生化指标的影响 雷公藤内酯醇给药对 C57BL/6 小鼠血清肝功能指标 ALT, AST和肾脏功能指标BUN的影响见表1。 低剂量组及高剂量组与正常对照组相比, 血清中的 ALT、AST值没有显著性差异; 而高剂量组血清中的 BUN有较显著上升, 增长 34.5% (P<0.05), 说明高剂量雷公藤内酯醇给药30 d后已明显导致小鼠肾小球尿素氮滤过率降低,功能受损。

图 1 雷公藤内酯醇给药后对 C57B/6 小鼠体质量增长的影响 (n=10,)Fig.1 Effects of consecu tive adm inistration of triptolide on gained body weights in the C57BL/6 m ice( n=10,)
表 1 雷公藤内酯醇给药对 C57BL/6 小鼠血清 ALT, AST及 BUN水平的影响 (n=10,)Tab.1 Effects of triptolide-treatments on serum biochem ical parameters in the C57/BL6m ice(n=10,)
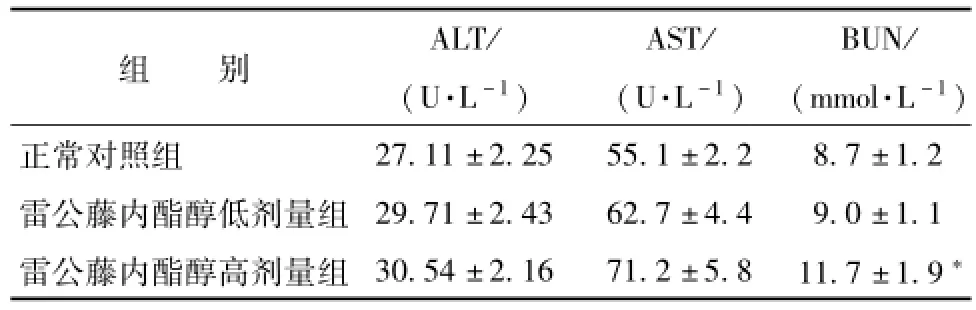
表 1 雷公藤内酯醇给药对 C57BL/6 小鼠血清 ALT, AST及 BUN水平的影响 (n=10,)Tab.1 Effects of triptolide-treatments on serum biochem ical parameters in the C57/BL6m ice(n=10,)
注: 与正常对照组比较,*P<0.05
组 别 ALT/(U·L-1)AST/(U·L-1)BUN/( mmol·L-1)27.11 ±2.25 55.1 ±2.2 8.7 ±1.2雷公藤内酯醇低剂量组 29.71 ±2.43 62.7 ±4.4 9.0 ±1.1雷公藤内酯醇高剂量组 30.54 ±2.16 71.2 ±5.8 11.7 ±1.9正常对照组*
2.3 雷公藤内酯醇给药对 C57BL/6 小鼠肝和肾组织中生化指标的影响 雷公藤内酯醇给药对C57BL/6 小鼠组织匀浆中生化指标 ALT, AST和GSH的影响见表 2。 低剂量组及高剂量组与正常对照组相比, 肝组织中的 ALT、 AST值没有显著性差异; 而高剂量组肝组织和肾组织中的 GSH水平分别降低了 27.0%和 15.80%,P<0.05 有显著性差异。
表 2 雷公藤内酯醇给药对 C57BL/6 小鼠肝组织中 ALT, AST及 GSH和肾组织中 GSH水平的影响 (n=10,)Tab.2 E ffects of triptolide-treatments on liver or kidney homogenates in the C57/BL6 m ice( n=10,)

表 2 雷公藤内酯醇给药对 C57BL/6 小鼠肝组织中 ALT, AST及 GSH和肾组织中 GSH水平的影响 (n=10,)Tab.2 E ffects of triptolide-treatments on liver or kidney homogenates in the C57/BL6 m ice( n=10,)
注: 与正常对照组比较,*P<0.05
组 别 肝 ALT/( U·gprot-1) 肝 AST/( U·gprot-1) 肝 GSH/( μmol·g prot-1) 肾 GSH/( μmol·g prot-1)72.5 ±4.0 72.1 ±5.4 11.4 ±3.8 12.2 ±0.7雷公藤内酯醇低剂量组 64.6 ±5.4 61.7 ±6.3 9.7 ±2.8 11.0 ±1.4雷公藤内酯醇高剂量组 60.1 ±3.2 59.6 ±4.5 8.3 ±1.5* 10.3 ±1.2正常对照组*
2.4 脏器指数的比较 雷公藤内酯醇亚慢性中毒对 C57BL/6 小鼠各脏器指数的影响, 见表 3。 低剂量组及高剂量组与正常对照组相比,小鼠的心、肝、肾脏、肺脏器指数没有显著性差异;低剂量组及高剂量组与溶剂组相比睾丸脏器指数显著降低(P<0.01); 高剂量组脾脏器指数显著增大 (P<0.05)。
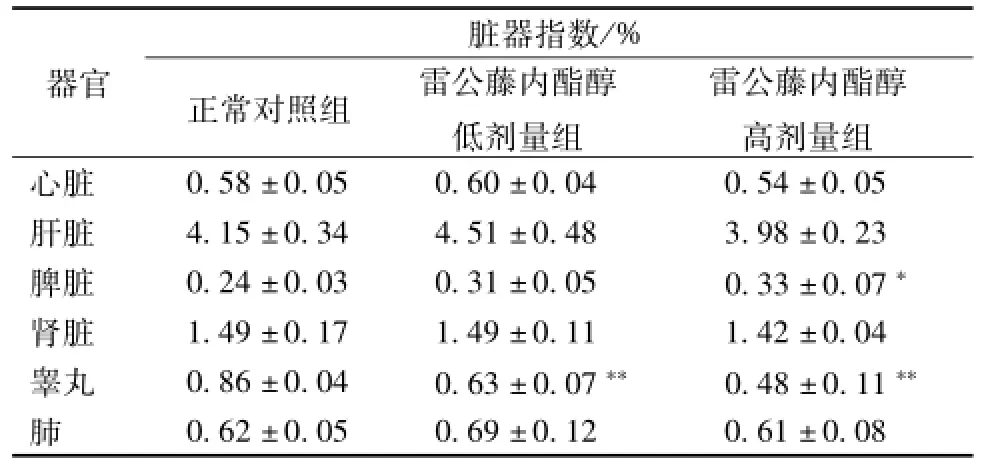
表 3 雷公藤内酯醇给药对 C57BL/6 小鼠各脏器指数的影响Tab.3 Viscera index of the C57/BL6 m ice adm inistered w ith triptolide by intraperitoneal injection for 30 days
2.5 病理组织切片观察 在光学显微镜下观察各组织病理切片,发现雷公藤内酯醇给药的小鼠的肾脏、脾脏和睾丸组织发生较明显的病理变化。低剂量组小鼠肾组织中大量炎症细胞聚集,高剂量组小鼠肾组织被大量炎性细胞浸润,肾小球病变毛细血管袢界限不清晰 (见图 2)。 低剂量组与高剂量组小鼠脾脏脾髓中红髓区域增多,脾窦充血,脾细胞间隙增大 (见图 3)。 对照组小鼠睾丸中生精小管中含有大量生殖细胞,小管中央可见小的、深染的椭圆形精子;低剂量组小鼠睾丸中显示局灶性生精小管萎缩,睾丸间质细胞受损,残存部分具有正常生精活性的生精小管;高剂量组小鼠睾丸中生精小管大量萎缩,少见具有正常形态的精细胞 (见图4)。 本次实验小鼠病理组织切片雷公藤内酯醇对小鼠的肝、肺、胃和十二指肠损伤不明显。
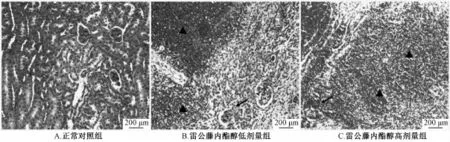
图 2 雷公藤内酯醇给药后各组小鼠肾脏组织病理学检查 ( ×100)Fig.2 M icrograph of kidney from a C57/BL6 rat treated with vehicle( ×100)

图 3 雷公藤内酯醇给药后各组小鼠脾脏组织病理学检查 ( ×100)Fig.3 M icrograph of spleen from a C57/BL6 rat treated with vehicle( ×100)
3 讨论
雷公藤内酯醇是中药雷公藤的主要生物活性成分,具有包括抗炎、抗肿瘤、抗生育在内的多重生物学作用,特别值得注意的是近年报道雷公藤内酯醇对 PKD和胰腺癌细胞抑制作用[6-7], 是学界最关注的天然活性产物之一。但由于雷公藤内酯醇具有较强的毒性,严重影响了其开发利用,如何保持其生物活性并降低其不良反应是亟待解决的问题。本实验采用 “标准” 的近交系 C57BL/6 小鼠研究雷公藤内酯醇亚慢性中毒对其全身主要组织功能的影响,实验精度高,均一性和可重复性较好。
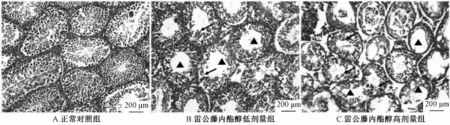
图 4 雷公藤内酯醇给药后各组小鼠睾丸组织病理学检查 ( ×100)Fig.4 M icrograph of testis from a C57/BL6 rat treated with vehicle( ×100)
在本实验中较低剂量 (100 μg/kg) 下, 雷公藤内酯醇对 C57BL/6 小鼠的肾脏、 脾脏、睾丸有明显损伤,对肝、肺、胃及十二指肠均未见明显影响; 在较高剂量 (200 μg/kg)下对 C57BL/6 小鼠肾脏、脾脏、睾丸损伤加重,对肝、肺、胃及十二指肠仍未见明显影响。 与刘良等报道[9]相比, 本实验在给药过程中并未出现死亡,该品系小鼠用于亚慢性中毒实验个体差异较小,均一性好,实验数据更加精确。并且发现雷公藤内酯醇亚慢性中毒除了对小鼠睾丸和肾脏有明显损伤外,还导致小鼠脾脏肿大,该区别是否由于小鼠品系差异导致,还有待于进一步确认。
本实验除测定 ALT、 AST和 BUN等常规生化指标外, 还测定了肝、肾组织匀浆中 GSH水平。与正常对照组相比,雷公藤内酯醇高剂量组小鼠肾组织匀浆和肝组织匀浆中 GSH水平下降。 GSH是细胞内的氧自由基最主要的清除剂,正常情况下,组织中总谷胱甘肽水平是相对恒定的, GSH水平主要因为清除细胞内氧自由基而下降。杨凌教授等研究组[12-14]分别报道 了肝药 酶 CYP3A是肝 脏中雷公藤内酯醇的主要解毒酶,可推测其解毒过程中产生的氧自由基是肝脏 GSH消耗的主要原因。 而本实验发现小鼠肾脏中 GSH同样显著降低, 肾脏中的细胞色素 P450 酶系是否同样可以起到解毒作用并导致 GSH消耗, 是本课题组继续研究的方向。
[ 1 ] Qin W Z, Lin J.Advance of the research on Tripterygium wilfordii Hook f.to a new height[ J] .Chin J Integr Med, 2005, 11(2): 87-88.
[ 2 ] 徐央丽.雷公藤的研究进展[J].现代中西医结合杂志,2008, 17(12): 1941-1942.
[3] 岗艳云, 张正行.雷公藤及其单体的药理作用研究进展[J] 中国药科大学学报, 1995 , 26(4) : 252-256.
[ 4 ] 夏志林, 郑幼兰.雷公藤内酯醇的药理和临床研究[J].中国药理学通报, 1992, 6(12): 427-431.
[ 5 ] Lue Y, Sinha Hikim A P, Wang C, et al.Triptolide: a potential male contraceptive[ J] .Andrology, 1998, 19 ( 4 ):479-486.
[ 6 ] Leuenroth S J, Okuhara D, Shotwell JD, et al.Triptolide is a traditional Chinesemedicine-derived inhibitor of polycystic kidney disease[ J] .Proc Natl Acad SciU SA, 2007 , 104(11):4389-4394.
[ 7 ] Mujumdar N, Mackenzie T N, Dudeja V, et al.Triptolide induces cell death in pancreatic cancer cells by apoptotic and autophagic pathways[ J] .Gastroenterology, 2010, 139 ( 2 ):598-608.
[ 8 ] 梅之南, 杨祥良, 徐辉碧.雷公藤内酯醇的药理研究[J],中国医院药学杂志, 2003, 23(9): 557-558.
[9] 刘 良,王战勇,黄光照, 等.雷公藤甲素亚慢性中毒对昆明种小鼠肾脏及睾丸的影响[J].同济医科大学学报,2001, 30(3): 214-217.
[10] 章根木, 姚甘火.中国昆明小鼠 (KM鼠) 遗传背景资料调查[ J] .中国实验动物学杂志, 1997, 7(4) : 246-251.
[11 ] Xue X, Gong L K, Qi X M, et al.Knockout of hepatic P450 reductase aggravates triptolide-induced toxicity[ J] .Toxicol Lett, 2011, 205(1) : 47-54.
[12 ] LiW, Liu Y, He Y Q, et al.Characterization of triptolide hydroxylation by cytochrome P450 in human and rat liver microsomes[J] .Xenobiotica, 2008, 38(12) : 1551-1565.
[13 ] Ye X, LiW, Yan Y, et al.Effects of cytochrome P4503A inducer dexamethasone on themetabolism and toxicity of triptolide in rat[ J].Toxicol Lett, 2010, 192(2) : 212-220.
[14 ] Liu L, Jiang Z, Liu J, et al.Sex differences in subacute toxicity and hepatic microsomalmetabolism of triptolide in rats[ J]. Toxicology, 2010, 271(1/2) : 57-63.
Sub-chronic toxicities of triptolide to C57BL/6 m ice
WU Na, LIU Xing-yu, WANG Du-jun, LUO Pan, WU Yao, WEIYuan*
(School of Pharmacy, Jiangsu University, Zhenjiang 212013, China )
AIM To investigate the sub-chronic effects of triptolide( TP) to the major organs of C57BL/6 mice.METHODS Thirty C57BL/6micewere evenly divided into three groups(n=10) , and treated with TP for 30 days.Their body weights were measured.The levels of alanine transaminase( ALT) , aspartate transaminase( AST) , blood urea nitrogen ( BUN) in serum, and the levels of ALT, AST, and glutathione( GSH) in liver and kidney homogenatesweremeasured by ELISA.Weights ofmice’smajor organsweremeasured to calculate the viscera index.The histopathological changesof liver, kidney, spleen, lung,stomach, testis,and intestine in C57BL/ 6 micewere investigated by H&E staining.RESULTS Compared with the control group, the gained body weights of the TP group on the 28th day significantly decreased (P<0.05).The serum BUN levels in high dose TP group significantly increased.The GSH level in liver homogenates and kidney homogenates of the 200 μg/kg TP group significantly decreased.In addition,the testis indexes of both low and high dose groups significantly decreased,while the spleen index of the 200 μg/kg TP group significantly increased.CONCLUSION TP has sub-chronic intoxication on major organs of C57BL/6 mice, especially kidney, spleen and testis.
triptolide;C57BL/6 mice; sub-chronic intoxication
R966
: A
: 1001-1528(2014)05-0904-05
10.3969/j.issn.1001-1528.2014.05.004
2013-04-20
国家自然科学基金青年项目 (81102522); 江苏省自然科学基金项目 (BK2011473); 江苏省博士后科研资助计划(1201081C)
吴 娜 (1989—), 女, 硕士生, 主要从事中药毒理学研究。
*通信作者: 魏 渊 (1981—) , 男, 副教授, 主要从事中 药的药 物代谢和毒 理学研究。 Tel: ( 0511) 88791526, E-mail: ywei@ujs. edu.cn
