白藜芦醇预处理对缺糖缺氧再灌注大鼠原代皮质神经元的保护作用
2014-04-11张黎黎黄家贵沈长波
张黎黎, 黄家贵, 沈长波, 刘 舒, 徐 兰, 杨 琴
(重庆医科大学附属第一医院神经内科,重庆 400016)
白藜芦醇预处理对缺糖缺氧再灌注大鼠原代皮质神经元的保护作用
张黎黎, 黄家贵, 沈长波, 刘 舒, 徐 兰, 杨 琴*
(重庆医科大学附属第一医院神经内科,重庆 400016)
目的 探讨白藜芦醇预处理对缺糖缺氧再灌注所致大鼠原代皮质神经元损伤的保护作用及机制。方法40 μmol/L白藜芦醇预处理大鼠原代皮质神经元 24 h, 皮质神经元缺糖缺氧 150 min, 恢复正常培养 24 h, 构建缺糖缺氧再灌注损伤。实验分为正常组,模型组,白藜芦醇组。倒置显微镜下观察细胞形态。免疫荧光染色鉴定神经元。MTT法检测细胞活力。 化学比色法测定培养上清液 LDH活性和细胞内 SOD活性。 TUNEL检测细胞凋亡。 免疫印迹法和免疫荧光法检测 Bcl-2、 Caspase-3、 Nrf-2、 NQO-1 蛋白表达。 结果 细胞培养 6 d, 免疫荧光染色显示 90% 的细胞是神经元特异性烯醇化酶阳性。与模型组相比,白藜芦醇预处理能明显降低培养上清液乳酸脱氢酶活性,增强细胞内SOD活性和神经元细胞活力, 减少细胞凋亡, 上调 Bcl-2、 Nrf-2 和 NQO-1 蛋白表达, 下调 Caspase-3 蛋白表达; 促进Nrf-2 蛋白从细胞浆转移到细胞核。 结论 白藜芦醇对大鼠原代皮质神经 元缺糖缺氧 再灌注 损伤有良好 的保护作用,其机制可能是通过抗凋亡和抗氧化途径实现。
白藜芦醇;预处理;神经元;再灌注损伤
缺血性脑卒中一旦发生,虽经多种药物或方法治疗,致死致残率仍极高,并且复发机率也高,因此预防缺血性脑血管疾病的发生具有重要意义。白藜芦醇 (resveratrol) 是一种含有芪类结构的非黄酮类多酚化合物,主要存在于葡萄、藜芦、虎杖、花生等植物中,具有抗肿瘤、抗炎、抗血小板聚集、 清除自由 基、 抗 氧化等多种药理活性[1-3]。 法国饮食能显著降减心脑血管疾病的发生率,与长期摄入富含白藜芦醇的葡萄酒有关。课题组前期的体内试验已证明白藜芦醇预处理能减轻脑缺血再灌注导致的脑损害[4],但在体外是否也能减轻缺糖缺氧再灌注对神经元的损伤,证据尚不充分,其机制亦未明确。本实验在体外采用大鼠原代皮质神经元缺糖缺氧再灌注损伤 ( oxygen and glucose deprivation/reperfusion, OGD/Rep) 模 型, 进 一 步 探 讨 白藜芦醇预处理对缺糖缺氧再灌注损伤大鼠原代皮质神经元的保护作用及可能的机制,为白藜芦醇预防缺血性脑血管疾病的发生提供依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 健康新生 24 h 内 SD大鼠, 雌雄不限,由成都医学院第一附属医院实验中心提供。 动物合格证号: 20120305。
1.1.2 主要试剂 白藜芦醇 (纯度 99%) 购自陕西慈缘生物有限公司, D-Hanks液、 DMEM/F12 培养基 购 自 Hyclone公 司,L-谷 氨 酰 胺、 Neurobasal medium、MTT、 B27购 自 Gibco 公 司, 一 步 法TUNEL细胞凋亡检测试剂盒、 细胞核蛋白与细胞浆蛋白抽提试剂盒购自碧云天生物技术研究所。超氧化物歧化酶 (SOD)、 乳酸脱氢酶 (LDH) 试剂盒购自南京建成生物工程研究所。兔抗大鼠核因子E2-相 关 因 子 2 ( nuclear factor erythroid-2-related factor 2, Nrf-2 )、 山 羊 抗 大 鼠 苯 醌 氧 化 还 原 酶[ NAD( P) H quinone oxidoreductase-1, NQO-1 ] 多克隆抗体购自 Abcam公司, 兔抗大鼠半胱氨酸天冬氨酸蛋白酶 (caspase-3) 和 Bcl-2 多克隆抗体购自 Santa Cruz公司, 兔抗大鼠 β-actin、 兔抗大鼠神经元特异性烯醇化酶 (NSE) 多克隆抗体购自北京博奥森生物技术有限公司, HRP标记的羊抗兔 IgG和 FITC标记的羊抗兔 IgG购自北京中杉金桥生物技术有限公司。
1.1.3 主要仪器 隔水式电热恒温培养箱 (上海市跃进医疗器械厂); 倒置相差显微镜 ( Olympus Japan); 自动酶标仪 (奥地利 Tecan 公司); 凝胶成像仪 (美国 Bio-Red); TCSSP2 激光共聚焦显微镜 (德国 Leica公司)。
1.2 方法
1.2.1 大鼠原代皮质神经元的培养 参照 Chen 等建立的方法[5], 75% 乙醇浸泡 SD大鼠,无菌条件下迅速分离大脑皮质并放置于 DMEM/F12 培养液中,小镊子剥离大脑皮质表面的脑膜和血管,去除海马部分,将其剪碎并置于培养皿中, 用 0.125%胰蛋白酶在 37 ℃、 5%CO2培养箱中消化 30 min(每隔 10 min 摇 晃 培 养 皿 数 次 以 充 分 消 化),DMEM/F12 培养基 (含 10% 胎牛血清) 终止消化, 先后用 400 目及 200 目的筛子过滤悬液, 离心取沉积物收集细胞,台盼蓝拒染法计数活细胞。将细胞接种于预先用多聚赖氨酸处理的孔板中 (添加 10% 胎牛血清和 DMEM/F12 培养基), 置于37 ℃、 5%CO2培养箱中培养。 细胞培养 6 h 贴壁后, 更 换 培 养 液 为 Neurobasal medium ( 2%B27、100 U/m L青霉素 /0.1 mg/mL链霉素、 0.5 mmol/L L-谷氨酰胺), 每两天换液 1 次。 培养至 6 d 的细胞用于实验。
1.2.2 神经元鉴定及纯度检测 皮质神经元培养6 d 后, 弃培养液, PBS 洗涤 3 次,加入 4%多聚甲醛室温固定 15 min 后, NSE多克隆抗体免疫荧光染色鉴定神经元。 在400 倍镜下分别计数 3 个孔各5个视野的阳性细胞数和总细胞数,计算阳性细胞的百分比,以此代表神经元纯度。
1.2.3 实验分组 将大鼠原代皮质神经元分为 3组。即正常组:按照原代皮质神经元培养方法培养。模型组:进行缺糖缺氧再灌注损伤处理。白藜芦醇组: 用含 40 μmol/L白藜芦醇的完全培养基对大鼠原代皮质神经元预处理24 h, 再进行缺糖缺氧再灌注损伤处理。
1.2.4 皮质神经元缺糖缺氧再灌注损伤 (OGD/ Rep) 模型的构建 参照 Chen 等[5]建立的方法,除去完全培养基, 以 D-Hanks液清洗 3 次后每孔加入 D-Hanks液 2 mL, 置 于 细 胞 缺 氧 培 养 箱,37 ℃、 通入 95%N2和 5%CO2培养 150 min。 缺糖缺氧后, 将 D-Hanks液更换为 Neurobasalmedium(含 2%B27) 并置于 37 ℃、 5%CO2培养箱中继续培养24 h, 模拟再灌注损伤。
1.2.5 MTT法测定细胞活力 细胞孵育终止前每孔加入 5 g/L的 MTT 20 μL, 37 ℃、 5%CO2培养箱中继续孵育4 h, 用无菌枪头小心吸弃培养液,然后每孔加入 200 μL二甲基亚砜 (DMSO), 避光震荡 10 min,使 用空白 对照孔 调零, 酶标仪 测490 nm处吸光度。 重复实验3 次,每次各组设5 个复孔。
1.2.6 SOD和 LDH活性的测定 正常组以及对模型组、白藜芦醇组神经元缺糖缺氧再灌注损伤后取各组培养上清液以及提取细胞蛋白,采用化学比色法测定 SOD和 LDH活性, 按照试剂盒使用说明操作。重复实验3次,每次各组设3个复孔。
1.2.7 TUNEL染色 用多聚赖氨酸预处理细胞爬片, 接种原代皮质神经元前用 PBS 清洗爬片 3 次,上述方法培养原代皮质神经元6 d。 经缺糖缺氧再灌注损伤后, 各组用 PBS 洗涤 3 次; 4% 多聚甲醛室温下固定 10 min, PBS 洗涤 3 次; 加入荧光素37 ℃避光孵育 1 h, PBS 洗涤 3 次,DAPI染核2 min, PBS 洗涤 3 次, 50% 甘油封片, 荧光显微镜检查拍照。重复实验3次。
1.2.8 免疫细胞化学染色 用注射器小心吸弃培养液, PBS 清洗细胞 3 次, 先后用 4%多聚甲醛固定细 胞 15 min, 0.3%Triton X-100 破 膜 5 min,10% 山羊血清封闭 30 min, 甩去多余血清; 各组加入兔抗大鼠 Nrf-2 (1 ∶500 稀释) 或兔 抗大鼠NSE(1 ∶100 稀释) 多抗, 4 ℃过夜,正常组用PBS 液代替一抗; PBS 清洗 3 次, 加入 FITC标记的羊抗兔 IgG (1 ∶50 稀释), 室温避光孵育 1 h,PBS 清洗 3 次, 用 PI染核 2 min, PBS 清洗 3 次,吸干残余的液体后用 50% 甘油封片, 荧光显微镜观察拍照。重复实验3次。
1.2.9 Western blot法 收取细胞, 按照蛋白抽提试剂盒说明 书 提 取蛋白。 Bradford 法检测 蛋 白 浓度。 将每组蛋白用 5 ×loading buffer稀释成相同浓度, 100 ℃水浴10 min, -80 ℃保存。 按照每个样本蛋白加样量 30 ~40 μg用 SDS-PAGE分离后电转移至 PVDF膜上。 取出膜用脱脂奶粉封闭 1 h, 置于杂交袋中, 分别加入 兔 抗 大 鼠 Caspase-3 多 抗(1 ∶200 稀释)、 兔抗大鼠 Bcl-2 多抗 (1 ∶200 稀释)、 兔抗大鼠 Nrf-2 多抗 (1 ∶1 000 稀释)、 山羊抗大鼠 NQO-1 多抗 (1 ∶1 000 稀释), 4 ℃孵育过夜。 TBST漂洗3 次,加入 HRP标记的山羊抗兔或驴抗山羊 IgG (1 ∶1 000 稀释), 37 ℃ 孵育 1 h,TBST漂洗 3 次。 PVDF膜上覆盖足量 ECL发光试剂显色并照相。 用 Quantity One 4.6.2 图像分析软件对图像进行分析, 以目的条带与 β-actin 光密度的比值作为蛋白表达相对水平。重复实验3次。
1.3 统计学处 理 应用 SPSS 17.0 软 件对实验结果进行统计学分析, 实验数据以均数 ±标准差() 表示, 多组数据参数间比较采用单因素方差分析, 组内两两比较采用 SNK-q 检验, 以 P<0.05 为差异有统计学意义。
2 结果
2.1 大鼠原代皮质神经元生长及鉴定 在倒置相差显微镜下观察, 接种前6 h, 细胞体积较小, 呈圆形;6 h后,细胞完全贴壁,并开始长出小突起。完全培养基培养3~4 d后,细胞体增大, 呈椭圆形或三角形,细胞突起呈稀疏网状连接,呈双极或多极。 培养至6 d, 胞体及突起立体感和折光性强, 此时免疫荧光染色显示 90% 的细胞为 NSE阳性,表明神经元的纯度能满足下一步的研究(见图1)。

图 1 大鼠原代皮质神经元形态学 ( ×200) 与鉴定 (FITC PI×400)Fig.1 Rat prim ary cortical neuronsm orphology ( ×200) and identification( FITC PI×400)
2.2 白藜芦醇对神经元 OGD/Rep 后细胞活力的影响 经过缺糖缺氧再灌注损伤后, MTT法检测结果显示, 模型组 (37.7% ±4.5%) 和白藜芦醇组(56.4% ±5.4%) 细胞活力较正常组明显降低(P<0.01)。 但白藜芦醇组细胞活力较模型组明显增高 (P<0.01) (见图 2)。
2.3 白藜芦醇对神经元 OGD/Rep 后 SOD和 LDH活性的影响 与正常组相比,经过缺糖缺氧再灌注损伤后, 模型组 SOD活性降低 (P<0.05), 白藜芦醇组SOD活性较正常组和模型组明显升高 (P<0.05); 与正常组相比, 模型组培养上清液 LDH活性显著升高(P<0.05), 白藜芦醇组培养上清液 LDH活性较正常组升高、 较模型组明显降低 (P<0.05) (见图3)。
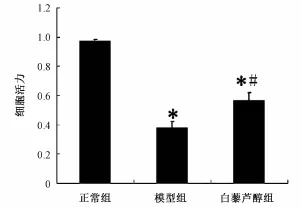
图 2 白藜芦醇对神经元 OGD/Rep后细胞活力的影响Fig.2 E ffect of resveratrol on cell viability of neu rons after OGD/Rep
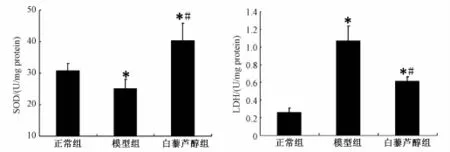
图 3 白藜芦醇对神经元 OGD/Rep后 SOD和 LDH活性的影响Fig.3 Effect of resveratrol on SOD and LDH activity of neurons after OGD/Rep
2.4 白藜芦醇对神经元 OGD/Rep 后细胞凋亡以及凋亡相关蛋白表达的影响 正常组有少量神经元细胞凋亡,经过缺糖缺氧再灌注损伤后,模型组神经元细胞凋亡明显,白藜芦醇组神经元细胞凋亡高于正常组但少于模型组 ( P<0.01)。 Western blot法分析显示白藜芦醇能明显降低促凋亡蛋白 Caspase-3 的表达 (P<0.01), 升高抗凋亡蛋白 Bcl-2 的表达 (P<0.01)(见图4 ~5)。
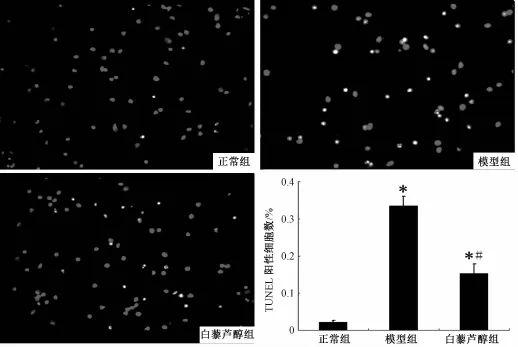
图 4 白藜芦醇对神经元 OGD/Rep后细胞凋亡的影响 (TUNEL staining ×200)Fig.4 Effect of resveratrol on apoptosis of neurons after OGD/Rep( TUNEL staining ×200)
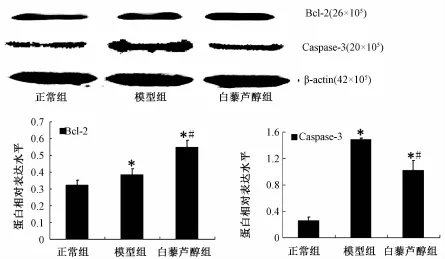
图 5 白藜芦醇对神经元 OGD/Rep后凋亡相关蛋白表达水平的影响Fig.5 Effect of resveratrol on apoptosis related protein expression in neurons after OGD/Rep
2.5 白 藜 芦 醇 对 蛋 白 Nrf-2 核 转 移 和 Nrf-2、NQO-1 表达的影响 免疫荧光结果提示,Nrf-2 蛋白主要存在于正常培养神经元的细胞浆,缺糖缺氧再灌注损伤可促使部分 Nrf-2 蛋白进入细胞核,而白藜芦醇预处理可 显著促 进 Nrf-2 蛋白 的核转移。 Western blot法分析显示,经过缺糖缺氧再灌注损伤后, 模型组 Nrf-2 和 NQO-1 蛋白的表达较正常组升高 (P<0.05); 与模型组相比, 白藜芦醇能明显升 高 Nrf-2 和 NQO-1 蛋白的表达 ( P<0.01)(见图 6 ~7)。

图 6 免疫荧光检测白藜芦醇对蛋白 Nrf-2 核移位的影响 (FITC PI×400)Fig.6 Effect of resveratrol on Nrf-2 nuclear translocation by immunofluorescence( FITC PI×400)

图 7 白藜芦醇对神经元 OGD/Rep后蛋 白 Nr f-2 和NQO-1 表达水平的影响Fig.7 Effect of resveratrol on protein expression of Nrf-2 and NQO-1 after OGD/Rep
3 讨论
白藜芦醇是多酚类化学物,是植物生长中为对抗紫外线照射、真菌感染等不利因素产生的一种植物抗毒素,广泛的存在于人类食物中,如葡萄、花生、凤梨、桑葚等。白藜芦醇进入血液后迅速与葡萄醛酸衍生物相结合,以结合的形式运输。该形式的白藜芦醇较易透过血脑屏障 (BBB),进入脑组织[6],易透过细胞膜,还可穿过细胞质进入细胞核, 更好的发挥抗氧化作用[7], 这成为白藜芦醇能起到脑保护作用的药理学基础。研究表明,白藜芦醇可以增强超氧化物歧化酶、过氧化氢酶、谷胱甘肽过氧化酶的活性,提高机体清除自由基的能力[8], 降低血管内皮细胞氧化应激损伤; 对大鼠脑缺血再灌注损伤具有保护作用[4]; 同时白藜芦醇还具有神经诱导潜能[9]。 LDH是细胞内酶, 其漏出多少可反映细胞膜的受损程度[10]。 SOD是生物体内重要的抗氧化酶,是生物体内清除自由基的首要物质。本实验结果发现,白藜芦醇可增强细胞活力, 降低培养液中 LDH活性, 升高细胞内 SOD活性, 表明其可以降低 OGD/Rep 后对神经元造成的伤害。
细胞死亡包括坏死和凋亡。坏死不可逆而凋亡可逆。缺血性脑卒中后,凋亡细胞的多少决定脑梗死体积的大小,因此抗凋亡治疗是减轻缺血性脑损害的策略之一。凋亡由一系列基因和蛋白酶控制。Caspase-3 参与了脑缺血后神经元损伤的病理过程,其表达的高低反映细胞凋亡的程度[11]。Bcl-2 是抗细胞凋亡基因之一,其表达的高低反映细胞抗凋亡的程度。本实验发现,正常组神经元细胞有散在的凋亡细胞及少量 Caspase-3 和 Bcl-2 蛋 白的表达。经过缺糖缺氧再灌注损伤后,凋亡细胞数目明显增多, Caspase-3 蛋白表达明显增强, 而经白藜芦醇预处理后, 凋亡细胞数目显著减少, Caspase-3 蛋白表达显著降低, Bcl-2 蛋白表达显著升高, 提示白藜芦醇预处理能抑制 Caspase-3 蛋白和促进 Bcl-2蛋白的表达,从而减轻缺糖缺氧再灌注后神经元的损伤。表明白藜芦醇具有抗凋亡作用。
在生物体抗氧化过程中, Nrf2/ARE信号通路发挥着重要作用[12-14]。 在 生 理状态下, Nrf-2 蛋 白位于胞浆,活性被抑制。在病理状态或某些因素作用下, Nrf-2 蛋白移位到胞核, 与 ARE结合, 启动一系列抗氧化酶 [如苯醌氧化还原酶 (NQO-1)]的转录。 NQO-1 是广泛分布的黄素腺碱二核苷依赖的黄素蛋白,具有很强的抗氧化功能和细胞保护作用。 本实验结果显示, 在正常培养条件下, Nrf-2蛋白主要表达于神经元胞浆。经缺糖缺氧再灌注损伤后, Nrf-2 蛋白部分移位到神经元胞核。 而白藜芦醇预处理则可显著促使 Nrf-2 蛋白移位到神经元胞核, 同时增强 Nrf-2 和 NQO-1 蛋白的表达, 表明缺血缺氧和白藜芦醇预处理均可激活 Nrf2/ARE信号通路,从而增强抗氧化酶的表达。这与本课题组 前 期 的 体 内 研 究 和 Yang等 的 体 内 研 究一致[14-15]。
本实验结果表明,白藜芦醇预处理对体外培养缺糖缺氧再灌注损伤的皮质神经元有保护作用,其保护机制至少部分是通过抗凋亡和抗氧化而实现。
[ 1 ] Ozkan O V, Yuzbasioglu M F, Ciralik H, et al.Resveratrol, a natural antioxidant, attenuates intestinal ischemia/reperfusion injury in rats[ J] .Tohoku J Exp Med, 2009, 218 ( 3 ):251-258.
[ 2 ] Baur JA, Sinclair D A.Therapeutic potential of resveratrol:the in vivo evidence[ J] .Nat Rev Drug Discov, 2006 , 5 ( 6 ):493-506.
[ 3 ] 杨迎暴, 罗景慧, 徐江平, 等.白黎芦醇对 fMLP诱导中性白细胞与人脐静脉内皮细胞粘附的抑制作用及机制[J].中国药理学通报, 2007, 23(12): 1588-1593.
[4] 任俊伟,杨 琴.白藜芦醇对大鼠脑缺血再灌注氧化应激损伤的影响 [ J].中国生物制品学杂志, 2011, 24 (3 ):292-296.
[ 5 ] Chen T, Liu W, Chao X, et al.Neuroprotective effect of osthole against oxygen and glucose deprivation in rat cortical neurons: involvement of mitogen-activated protein kinase pathway[J] .Neuro Sci, 2011, 183(2) : 203-11.
[ 6 ] Wang Q, Xu J, Rottinghaus G E, et al.Resveratrol protects against global cerebral ischemic injury in gerbils[ J] .Brain Res,2002, 958(2): 439-447.
[ 7 ] Belguendouz L, Fremont L, Gozzelino M T.Interaction of transresveratrolwith plasma lipoproteins[ J] .Biochem Pharmacol,1998, 55(6): 811-816.
[ 8 ] Spanier G, Xu H, Xia N, etal.Resveratrol reduces endothelial oxidative stress bymodulating the gene expression of superoxide dismutase 1 ( SOD1) , glutathione peroxidase 1 ( GPx1 ) and NADPH oxidase subunit( Nox4 ) [ J].J Physiol Pharmacol,2009, 60(4): 111-116.
[9] 黄家贵,沈长波,刘 舒,等.白藜芦醇体外诱导大鼠骨髓基质细胞向神经元样细胞的分化[J].中国生物制品学杂志, 2013, 26(2): 200-204.
[10] 丁爱石, 王福庄, 赵桂玲.缺氧对新生大鼠海马培养细胞的影响[J].细胞生物学杂志, 1993, 15(4): 167-169.
[11] 任俊伟, 杨 琴, 陈 娜, 等.白藜芦醇对脑缺血再灌注后细胞凋亡及 Caspase-3 表达的影响[J].中成药, 2011,33(4): 570-573.
[12] 任俊伟, 杨 琴.白藜芦醇对脑缺血/再灌注氧化应激损伤保护机制的研究进展[J].中国药理学通报, 2011, 27(4): 448-451.
[13 ] Ungvari Z, Bagi Z, Feher A, et al.Resveratrol confers endothelial protection via activation of the antioxidant transcription factor Nrf2 [ J] .Am J Physiol Heart Circ Physiol, 2010, 299(1): H18-24.
[14 ] Ren J, Fan C, Chen N, et al.Resveratrol pretreatment attenuates cerebral ischemic injury by upregulating expression of transcription factor Nrf2 and HO-1 in rats[ J] .Neurochem Res,2011, 36(12): 2352-2362.
[15 ] Yang C, Zhang X, Fan H, et al.Curcumin upregulates transcription factor Nrf2, HO-1 expression and protects rat brains against focal ischemia[J] .Brain Res, 2009, 1282: 133-141.
Effect of resveratrol on rat primary cortical neurons during oxygen and glucose deprivation/reperfusion injury
ZHANG Li-li, HUANG Jia-gui, SHEN Chang-bo, LIU Shu, XU Lan, YANG Qin*
(Department of Neurology, The First Affiliated Hospital of Chongqing Medical University, Chongqing 400016, China)
AIM To study the effectandmechanism of resveratrol on ratprimary cortical neurons during oxygen and glucose deprivation/reperfusion injury(OGD/Rep) .METHODS Rat primary cortical neurons were pretreated with 40 μmol/L resveratrol for 24 hours, then cultured with oxygen and glucose deprivation for 150 minutes and returned to normal culture for 24 hours.Cells were divided into three groups including the normal group, model group and resveratrol group.MTT assay detected cell viability.Chemical colorimetry detected SOD and LDH activity.TUNEL detected cellapoptosis.The expression levels of Bcl-2 ,Caspase-3 ,nuclear factor erythroid 2-related factor 2 ( Nrf-2), and NAD( P) H quinone oxidoreductase-1 ( NQO-1 ) proteins were detected by Western blot.RESULTS Compared with model group, resveratrol significantly reduced LDH activity, enhanced intracellular SOD activity and neuronal cell viability, decreased the numbers of apoptosis and the expression level of Caspase-3 protein,increased the expressions of Bcl-2 , Nrf-2 ,and NQO-1 proteins, and promoted the Nrf-2 to enter into the nuclei from the cytosol.CONCLUSION Resveratrol has a good protective effect on rat primary cortical neurons during OGD/Rep.Its protectivemechanism may be associated with antioxidation and anti-apoptosis.
resveratrol; pretreatment; neuron; reperfusion injury
R966
: A
: 1001-1528(2014)05-0897-07
98,ebook=19
10.3969/j.issn.1001-1528.2014.05.003
2013-05-18
国家自然科学基金面上项目 (81071119) ; 重庆市卫生局科研基金 (2009-2-359)
张黎黎 (1982—) , 女, 硕士生。 Tel: 13880039591, E-mail: hanyun.pear@163.com
*通信作者: 杨 琴 (1970—) , 女, 教授, 研究方向: 脑血管疾病与干细胞移植。 E-mail: xyqh200@126.com
