斑马鱼ca15b的克隆及在原始生殖细胞中的特异表达
2014-04-10杨明宇王厚鹏朱作言孙永华
杨明宇王厚鹏朱作言孙永华
(1. 中国科学院水生生物研究所, 淡水生态与生物技术国家重点实验室, 武汉 430072; 2. 中国科学院大学, 北京 100049)
斑马鱼ca15b的克隆及在原始生殖细胞中的特异表达
杨明宇1,2王厚鹏1朱作言1孙永华1
(1. 中国科学院水生生物研究所, 淡水生态与生物技术国家重点实验室, 武汉 430072; 2. 中国科学院大学, 北京 100049)
高保真PCR克隆获得了ca15b基因的全长, 利用胚胎整体原位杂交等技术研究了ca15b基因在斑马鱼早期发育过程中的动态表达。结果发现, ca15b在斑马鱼早期发育过程中存在显著的原始生殖细胞(Primordial germ cell, PGC)特异表达模式。ca15b是一个母源性表达的基因: 在分裂期的胚胎中, 其mRNA集中分布于位于分裂沟的生殖质(Germ plasm); 从囊胚期开始, 可以观察到其在 PGC中的特异表达; 在原肠胚中, 其mRNA在体细胞中急剧降解, 仅特异表达于PGC, 这一表达特征一直持续到受精后1d的胚胎。将体外合成的包含5′UTR和3′UTR的ca15b全长mRNA注射到斑马鱼胚胎后, 仅能增强原肠期之前胚胎中ca15b的整体杂交信号; 在原肠胚期之后, 注射的mRNA在体细胞中快速降解。这提示在ca15b mRNA上可能存在某种转录后调控其在早期胚胎体细胞中降解而在PGC中稳定存在的机制。
斑马鱼; 原始生殖细胞; 表达模式; ca15b
原始生殖细胞(Primordial germ cell, PGC)在胚胎发育早期就存在一套与体细胞完全不一样的表达程序[1], 在发育早期可以被特异地标记、分离, 甚至剔除,是开展基因操作和胚胎操作的极佳对象。由PGC发育而来的生殖细胞在成体中独立于体细胞而存在, 经过配子生成的一系列发育过程后, 最终产生成熟的配子——卵子和精子, 通过简单的受精过程即可获得遗传上来源于生殖细胞或PGC的新生个体, 从这一角度而言, PGC可以说是具有最好全能性的一类胚胎细胞。因此, 在PGC中特异表达的基因及其表达调控规律受到了越来越多的关注[2]。在鱼类中, 1997年Yoon, et al.利用斑马鱼首次克隆鉴定了斑马鱼原始生殖细胞特异表达的基因——果蝇vasa基因的同源基因[3]。斑马鱼vasa mRNA 是生殖质(Germ plasm)的组成部分[4,5], 对于生殖质的形成和生殖细胞的分化起着重要的作用[6,7]。vasa基因在其他一些鱼类(如日本青鳉、虹鳟等)中也得到克隆分析[8,9]。Koprunner, et al.于2001年鉴定出一个在斑马鱼的种质和PGC中特异表达的nanos-like (nanos1)基因[10], 他们发现了几种能使nanos1只在生殖细胞里表现出活性的机制, 包括mRNA的定位, 稳定性和翻译[10]。Gilbert Weidinger, et al. 发现了一个在生殖质和 PGC中特异表达的基因dnd[11]。一般而言, PGC特异的mRNA的定位通常是由其3′UTR上的定位元件(Localization elements, LE)来调控的, 并且可以被特定的反式作用因子如miRNA等所识别[12,13]。
我们通过公开数据库搜索, 发现碳酸酐酶(Carbonic anhydrase)家族的一个新基因——ca15b在斑马鱼胚胎中可能存在PGC特异表达。碳酸酐酶是一族含锌酶[14], 在哺乳动物中, 几乎所有的组织均可检测到碳酸酐酶[15]。碳酸酐酶至少有 14种同工酶, 其结构、动力学性质、对抑制剂的敏感性、组织内的分布及亚细胞的定位均有不同, 已知它们可能参与机体气体运输、酸碱调节和组织分泌等方面的功能, 在维持内环境的稳定方面发挥重要作用。本研究克隆鉴定了斑马鱼的 ca15b基因, 发现ca15b是一个在斑马鱼 PGC中特异表达的新基因,并初步研究了其可能的作用机理。
1 材料与方法
1.1 实验鱼
本研究所用实验鱼为AB品系的野生型斑马鱼(来自于国家斑马鱼资源中心, 武汉)。用于显微注射和原位杂交试验的斑马鱼胚胎由野生型斑马鱼雄鱼与雌鱼自然产卵获得。斑马鱼的养殖及胚胎发育阶段定义参考斑马鱼手册[16]。
1.2 斑马鱼ca15b基因的克隆及过表达载体的构建
取斑马鱼胚盾(Shield)时期的胚胎 100个, 利用TRIZOL试剂(Invitrigen公司)提取总 RNA。通过oligo(dT)18反转录合成cDNA。根据NCBI数据库里预测的斑马鱼ca15b mRNA序列(GenBank登录号为NM_213182), 设计了能扩增出包括5′UTR和3′UTR在内的ca15b全长序列的引物(ca15b-S, ca15b-A)(表1), 预期产物大小为1.74 kb。我们在正向引物上加上了 EcoRⅠ酶切位点, 在反向引物上加上了 NotⅠ酶切位点。以 shield时期的胚胎 cDNA为模板, 利用KOD-plus高保真酶(Takara)PCR扩增ca15b cDNA的全长。PCR程序如下: 94℃预变性5min; 以94 ℃ 30s, 60 ℃ 3 0s, 68 ℃ 1 min 反应10个循环, 每个循环退火温度降0.5 ℃ ; 然后以94 ℃ 30s, 60 ℃ 30s, 68 ℃ 1min 反应20个循环; 最后68℃延伸5min。切胶回收PCR产物后用EcoRⅠ和NotⅠ双酶切PCR产物和pCMV SPORT6.1载体, 然后用T4连接酶16℃连接过夜。将连接产物转化, 挑克隆摇菌, PCR鉴定阳性克隆,测序检测, 获得pCMV-SPORT6.1- ca15b载体。为考察ca15b的CDs是否参与了ca15b mRNA的表达调控, 我们构建了 pCS2-ca15bCDs载体。根据 ca15b序列设计扩增ca15b CDs的引物ca15bCDS-f-EcoRI和ca15bCDS-r-XhoI (表1), 用KOD-plus在pCMVSPORT6.1-ca15b上扩增出ca15b CDs, 然后将扩出片段和 p CS2+载体同时用 E coRⅠ和 X hoⅠ双酶切, 回收酶切产物, 用 T4连接酶连接, 将连接产物转化,挑克隆摇菌, PCR鉴定阳性克隆, 测序检测。

表1 本研究所用引物Tab. 1 Primers used in the present study
1.3 半定量PCR
分别取斑马鱼未受精卵及2细胞期、4细胞期、1k细胞期、圆球(Sphere)时期、30%外包期、shield时期、75%外包期、体节早期、体节中期和受精后1天(1 day post-fertilization, 1dpf)的胚胎, 提取总RNA, 并按照1.2所述方法反转录合成cDNA。然后以各发育时期的cDNA为模板, 用ca15b特异引物(根据斑马鱼ca15b基因序列设计的引物ca15b-F和ca15b-R, 能扩出的片段大小预期 416 bp)进行半定量RT-PCR检测, 以β-actin为内参(GenBank登录号为NM_181601, 根据斑马鱼β-actin基因序列设计的特异性引物β-actin S和β-actin A, 扩增片段大小为135 bp)。半定量RT-PCR按如下程序进行扩增: 94℃预变性5min, 然后以94℃ 30s, 54℃ 30s, 72℃ 50s反应25个循环, 再以72℃延伸10min。其中引物序列见表1。
1.4 cDNA和蛋白序列分析及系统发育树构建
用Vector NTI[17]软件分析斑马鱼ca15b的cDNA序列。用SMART在线程序(http://smart.embl-heidelberg. de/)预测ca15b的蛋白结构[18]。用CluatalW在线程序[19](http://www.genome.jp/tools/clustalw/)将 Ca15b蛋白序列与几个碳酸酐酶家族成员(斑马鱼Ca15a、Ca15c, 大鼠、小鼠和爪蟾的 Ca15)的蛋白序列进行对比分析并用MEGA 5软件[20]构建蛋白序列的系统发育树。
1.5 mRNA合成及注射
为考察外源ca15b mRNA在斑马鱼早期胚胎发育过程中的时空分布, 我们以 pCMV-SPORT6.1-ca15b载体为模版及载体上的 sp6启动子序列体外转录包括5′UTR和3′UTR在内的ca15b的mRNA。先用 NotⅠ酶切 pCMV-SPORT6.1-ca15b, 作为体外转录的模板。用mMESSAGE mMACHINE SP6试剂盒(Ambion)进行体外转录合成ca15b的全长mRNA。另外, 我们还分别用 pCS2-EGFP载体和 pCS2-ca15bCDs载体按上面同样的方法合成了 EGFP-sv40 mRNA和ca15bCDs-sv40 mRNA。
将合成好的ca15b mRNA、EGFP-sv40 mRNA和ca15bCDs-sv40 mRNA用显微注射仪按每个1-细胞期的斑马鱼胚胎注入1 ng样品[21,22]。
1.6 探针合成与胚胎整体原位杂交
由于pCMV-SPORT-ca15b载体上存在反向的T7启动子, 我们以 EcoRⅠ线性化的 pCMV-SPORT6.1-ca15b载体为模板, 在有地高辛标记的UTP (Roche公司)存在的前提下, 以 T7 RNA聚合酶(Omega公司)合成ca15b反义RNA探针。收集在2细胞期、拱顶(Dome)时期、shield时期、1—3体节期、体节中期和1 dpf的野生型和注射后的斑马鱼胚胎, 用4%的甲醛固定, 甲醇脱水, –20℃保存。利用合成的ca15b反义RNA探针对收集的斑马鱼胚胎进行原位杂交。原位杂交主要按照胚胎复水、蛋白酶消化、预杂交、杂交、染色和终止等步骤进行, 具体方法见参考文献[23]。
2 结果
2.1 ca15b cDNA的克隆和体外转录载体构建
利用 shield时期的斑马鱼胚胎 cDNA为模板,我们通过高保真PCR扩增出了片段大小为1.7 kb的ca15b cDNA的目的片段。利用酶切连接的办法将该片段克隆质粒载体 pCMV-SPORT6.1, 测序分析发现所克隆获得的序列与网络公开数据库的序列(GenBank登录号: BC056289)完全一致。因此, 我们克隆获得了斑马鱼的 ca15b全长 cDNA, 同时构建了包含斑马鱼ca15b基因5′UTR和3′UTR的cDNA的全长序列的体外转录载体 pCMV-SPORT6.1-ca15b。此外, 我们将 ca15b的编码区亚克隆到pCS2+载体, 获得仅包含其 CDS的体外转录载体pCS2-ca15b-sv40。这两个载体将用于后续的体外转录和mRNA注射试验。
2.2 Ca15b蛋白序列分析
我们利用SMART在线程序预测了Ca15b蛋白的结构, 发现 Ca15b蛋白有存在两个主要的潜在的结构域: 位于N-端的碳酸酐酶功能域和位于C-端的跨膜结构域(图1A)。将推测的Ca15b蛋白序列与斑马鱼 Ca15a、斑马鱼 Ca15c, 大鼠、小鼠和爪蟾的Ca15等蛋白序列进行对比分析, 发现Ca15b氨基酸序列上第97—146个氨基酸之间有三个保守的组氨酸位点(图1B)。这三个组氨酸位点是潜在的锌离子结合位点, 也是碳酸酐酶的活性区域[14]。在 Ca15b氨基酸序列上第 263—305个氨基酸之间有一段 20个氨基酸左右的片段为潜在的跨膜结构域(图1B中黑框内)。这表明, Ca15b蛋白的基本结构域在斑马鱼和其他脊椎动物中保守, 斑马鱼 Ca15b蛋白是一种具有跨膜结构域的碳酸酐酶。
我们用 MEGA程序构建蛋白序列系统发育树,发现斑马鱼Ca15a和Ca15c的蛋白序列相似度最高(图1C), 相比爪蟾、大鼠和小鼠的Ca15蛋白, 斑马鱼的Ca15a和Ca15c更接近于斑马鱼的Ca15b。这提示斑马鱼基因组中的 3个 Ca15基因是来自于鱼类基因组的复制加倍。已有的研究表明, Ca15a 在调节斑马鱼H+-ATPase富集的细胞中的酸碱平衡和钠离子浓度方面有非常重要的作用[24]。
2.3 ca15b是一个母源性表达的基因并在胚胎发育过程中快速降解
通过搜集斑马鱼未受精卵、受精卵和早期发育各时期的受精卵做半定量RT-PCR, 我们发现ca15b在胚胎发育早期都有很高的表达, 并且一直持续 1k细胞期。到了shield时期, ca15b的表达量迅速降低,至体节发育早期之后, 几乎检测不到其可见的表达(图2A)。
2.4 ca15b是一个在斑马鱼 P GC 中特异表达的新基因
通过收集斑马鱼在各个时期的胚胎, 用 ca15b探针做原位杂交, 我们发现在斑马鱼两细胞期的胚胎中, ca15b具有很强的表达, 虽然其mRNA分布广泛, 但在位于分裂沟的生殖质中有大量聚集(图2B)。在shield时期的胚胎中, 可以发现ca15b mRNA在体细胞中发生大量降解, 但在 PGC中非常稳定(图2C、D)。在发育到体节早期的胚胎中, 我们可以清晰地观察到ca15b mRNA很对称地分布在背脊的两侧的原始生殖细胞中(图2E、F)。在发育到1 dpf的胚胎中, ca15b的mRNA在PGC依然稳定存在(图2G、H)。原位杂交的结果表明, 斑马鱼ca15b是一个典型的PGC特异表达的新基因。
2.5 外源注射的 ca15b mRNA在斑马鱼原肠胚后的体细胞中迅速降解

图1 斑马鱼Ca15b蛋白结构、序列分析及系统发育树Fig. 1 Protein structure, sequence analysis and phylogenetic tree of zebrafish Ca15b
为 了 研 究 ca15b mRNA在体细胞中急剧降解且在PGC中稳定存在的机制, 我们体外合成了包含3′UTR和5′UTR的ca15b mRNA, 向斑马鱼受精卵注射大量ca15b mRNA (每胚胎1 ng mRNA), 收取不同发育时期的胚胎, 用 ca15b探针做原位杂交。结果发现在shield时期, 相比野生型胚胎, ca15b mRNA的存在量有较高水平的提高(图3A)。但是到了体节早期, 体细胞中的ca15b mRNA依然被大量降解, 仅能在 PGC中检测到其特异的表达信号(图3B)。而在平行注射的GFP-sv40 mRNA样品中,我们观察到注射的GFP-sv40 mRNA能够在发育到体节中期的胚胎中依然非常稳定地被检测到(图3C、 D)。这一结果提示, 在ca15b全长mRNA上存在着某种令其在体细胞中急剧降解而在PGC中稳定存在的作用元件。
2.6 在 ca15b mRNA上控制其PGC稳定性的元件位于其编码区
为了探讨这种作用元件位于ca15b mRNA的哪部分区段, 我们将 ca15b编码区的 cDNA与 sv40 polyA信号相串联, 将体外合成的 ca15bCDs-sv40mRNA显微注射入斑马鱼受精卵, 利用ca15b探针对胚胎进行原位杂交分析。结果发现, 虽然在发育到shield时期的胚胎中, ca15b的原位杂交信号在体细胞中显著增强(图 3E), 但在发育到体节中期的胚胎中, 其原位杂交信号在体细胞中完全消失, 仅在PGC中被检测到(图3F)。这提示我们在ca15b mRNA的编码区(CDS)上存在令其 mRNA在体细胞中极不稳定的转录后调控元件。
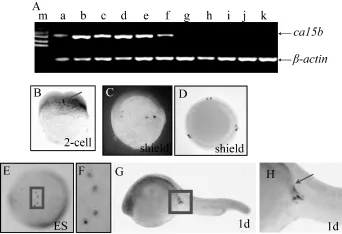
图2 ca15b在斑马鱼早期胚胎中的PGC特异表达Fig. 2 PGC-specific expression of ca15b in zebrafish embryos
我们通过用Vector NTI软件的motif analysis程序分析ca15b的序列发现, ca15b全长cDNA上存在5个与miRNA430识别位点核心序列GCACTTT相类似的序列(正义链2个, 反义链3个), 其中有1个位点位于ca15b基因的CDs区(图3G)。
3 讨论
得益于国际斑马鱼信息网络(ZFIN)提供的高通量基因表达谱数据库(http://zfin.org/cgi-bin/webdriver? MIval=aa-xpatselect.apg), 我们搜索到ca15b这样一个可能在斑马鱼PGC中存在特异表达的基因。通过分子克隆、序列特征分析、基于 RT-PCR和原位杂交的表达分析等手段, 确认了 ca15b是在斑马鱼PGC中存在特异表达一个新基因。截止2013年11月, ZFIN提供了一万两千多个基因的高通量表达数据库, 这不仅可以为寻找斑马鱼特定组织和细胞类型的标记基因提供方便, 而且为挖掘在感兴趣的组织中特异表达的新基因提供了一个有力的平台。

图3 决定斑马鱼ca15b的PGC特异元件位于其编码区Fig. 3 PGC-specified element locates in the coding region of zebrafish ca15b mRNA
通过对ca15b基因在斑马鱼早期胚胎发育过程中表达量的半定量RT-PCR分析, 考察了ca15b基因在发育时序中的相对表达量的动态变化。发现它在未受精卵中有高水平的表达, 由此可知 ca15b mRNA是斑马鱼卵细胞所提供的母源因子的组成部分。斑马鱼ca15b在受精之后到30%外包期都存在高水平的表达, 直到shield时期表达水平出现骤降。从shield时期开始直到1 dpf的胚胎, ca15b的表达都维持在一个较低的水平。这些表达特征与斑马鱼中另一个PGC特异的基因HuB(elavl2)完全一致[25],提示这两个基因可能存在着类似的转录或转录后调控机制。利用胚胎整体原位杂交技术, 观察到ca15b mRNA在两细胞期主要分布于位于斑马鱼胚胎分裂沟的生殖质中, 除此之外, 在胚盘的其他部位也存在杂交信号的均匀分布, 这是因为ca15b mRNA是一种卵细胞质所提供的母源因子。从shield时期开始, ca15b mRNA从体细胞中完全消失, 只稳定存在于原始生殖细胞中。这一表达特征与其他已深入研究过的斑马鱼PGC特异基因的表达模式非常一致。本研究发现了斑马鱼 PGC特异表达的一个新基因ca15b, 并揭示了其PGC特异的表达模式。
出于对ca15b mRNA在体细胞中迅速降解的机制产生的好奇, 我们向斑马鱼胚胎胚胎注射了大量的外源 ca15b mRNA。结果发现, 虽然体外注射的ca15b mRNA可以在shield时期大大增强ca15b的杂交信号, 但是到了原肠晚期之后, 特别是在体节发育早期, 外源注射的 ca15bmRNA从斑马鱼体细胞中完全消失, 只特异存在于斑马鱼的 PGC。而在平行注射EGFP-sv40 mRNA的样品中, 可以观察到外源注射的mRNA一直稳定存在到体节发育中期的胚胎中。这表明, 在ca15b全长mRNA上存在某种令其在体细胞中降解, 且在 PGC中稳定的作用元件。为了进一步弄清斑马鱼ca15b转录后调控的机制, 我们将ca15bCDs-sv40 mRNA通过显微注射注入斑马鱼受精卵, 然后用 ca15b探针进行原位杂交发现, 到了 shield时期原位杂交信号都很强, 到了体节中期原位杂交的信号在体细胞中完全降解, 仅在PGC中被检测到。这里所用的sv40 polyA是一种能将 mRNA广泛定位和稳定的 UTR[26], 这表明在ca15b mRNA的编码区(CDS)上存在令mRNA在体细胞中极不稳定的转录后调控元件, 即使这种mRNA携带有sv40的polyA信号, 也不足以使这种融合mRNA在体细胞中稳定存在。
调节 mRNA稳定的顺式作用元件一般位于其3'UTR, 例如nanos mRNA的3′UTR上面有miRNA的作用位点, 能够使其mRNA通过转录后调控只存在于PGC[27—29]。斑马鱼miR430在母源mRNA的清除过程中扮演了重要角色[30], 因此我们重点考察了ca15b cDNA上是否存在与miR430相匹配的潜在作用位点。结果发现ca15b上有5个位点(正义链2个、反义链3个, 其中只有1个在CDs区)与miR430的核心作用序列仅存在一个碱基的差异。这些位点将成为对ca15b开展转录后调控研究的重点考察对象。通常原始生殖细胞特异的 mRNA在体细胞和PGC的不同稳定性是由 miRNA(如斑马鱼中的miRNA430和爪蟾中的miRNA18等)[31]介导的在体细胞降解作用和原始生殖细胞中特异表达的蛋白(如Elr、Dazl等)[25]介导的在PGC的保护作用共同实现的。蛋白对mRNA的保护作用主要是通过抑制miRNA跟mRNA结合或抑制mRNA的去腺苷酸化这两种途径来实现的[30,32]。将 ca15b mRNA 的3′UTR替换为一个能使mRNA不被高效去腺苷酸化的UTR(sv40)之后, 它仍在体细胞和PGC表现出不同的稳定性, 这说明ca15b mRNA在PGC能够稳定存在很有可能是因为有蛋白抑制了特定 miRNA(如miRNA430)与它的结合。
一般而言, 在PGC特异表达的基因对PGC的存活或者发育有着重要的功能。譬如, Vasa蛋白是DEAD-box 蛋白家族的重要成员[33,34], 是决定生殖系发育的重要调控因子之一; Nanos在生殖细胞发育过程中是必须的[35—38], nanos基因的突变会导致性腺中的极细胞不能正常迁移, 也无法形成生殖细胞, 并在胚胎发生过程中大量死亡[39]; 斑马鱼 dnd基因对于原始生殖细胞的存活也是必需的[11,40], 斑马鱼dnd RNA是生殖质的组成部分并且特异的在原始生殖细胞中表达[32]。已经深入研究的鱼类PGC特异表达基因所翻译的蛋白多为 RNA结合蛋白或RNA互作蛋白, 他们的功能与生殖质的形成、生殖细胞的形成和迁移相关[2]。斑马鱼ca15b作为在PGC特异表达的基因, 它所编码的蛋白为在PGC中特异表达的一类全新的蛋白——碳酸酐酶。已有研究表明Ca15a在调节斑马鱼H+-ATPase富集的细胞中的酸碱平衡和钠离子浓度方面有非常重要的作用[24],斑马鱼 Ca15a和 Ca15b的重要功能域存在保守性,所以我们推测 Ca15b蛋白可能存在类似的功能。ca15b在斑马鱼PGC发育中有什么重要的作用将是一个值得深入研究的课题。
[1] Wylie C. Germ cells [J]. Current Opinion in Genetics & Development, 2000, 10(4): 410—413
[2] Xu H, Li M, Gui J, et al. Fish germ cells [J]. Science China Life Sciences, 2010, 53(4): 435—446
[3] Yoon C, Kawakami K, Hopkins N. Zebrafish vasa homologue RNA is localized to the cleavage planes of 2- and 4-cell-stage embryos and is expressed in the primordial germ cells [J]. Development, 1997, 124(16): 3157—3165
[4] Knaut H, Pelegri F, Bohmann K, et al. Zebrafish vasa RNA but not its protein is a component of the germ plasm and segregates asymmetrically before germline specification [J]. Journal of Cell Biology, 2000, 149(4): 875—888
[5] Hashimoto Y, Maegawa S, Nagai T, et al. Localized maternal factors are required for zebrafish germ cell formation [J]. Developmental Biology, 2004, 268(1): 152—161
[6] Gavis E R, Lunsford L, Bergsten S E, et al. A conserved 90 nucleotide element mediates translational repression of nanos RNA [J]. Development, 1996, 122(9): 2791—2800
[7] Styhler S, Nakamura A, Swan A, et al. vasa is required for GURKEN accumulation in the oocyte, and is involved in oocyte differentiation and germline cyst development [J]. Development, 1998, 125(9): 1569—1578
[8] Shinomiya A, Tanaka M, Kobayashi T, et al. The vasa-like gene, olvas, identifies the migration path of primordial germ cells during embryonic body formation stage in the medaka, Oryzias latipes [J]. Development, Growth & Differentiation, 2000, 42(4): 317—326
[9] Yoshizaki G, Sakatani S, Tominaga H, et al. Cloning and characterization of a vasa-like gene in rainbow trout and its expression in the germ cell lineage [J]. Molecular Reproduction and Development, 2000, 55(4): 364—371
[10] Koprunner M, Thisse C, Thisse B, et al. A zebrafish nanos-related gene is essential for the development of primordial germ cells [J]. Genes & Development, 2001, 15(21): 2877—2885
[11] Weidinger G, Stebler J, Slanchev K, et al. Dead end, a Novel Vertebrate Germ Plasm Component, Is Required for Zebrafish Primordial Germ Cell Migration and Survival [J]. Current Biology, 2003, 13(16): 1429—1434
[12] Kloc M, Etkin L D. Two distinct pathways for the localization of RNAs at the vegetal cortex in Xenopus oocytes [J]. Development, 1995, 121(2): 287—297
[13] King M L, Messitt T J, Mowry K L. Putting RNAs in the right place at the right time: RNA localization in the frog oocyte [J]. Biology of the Cell, 2005, 97(1): 19—33
[14] Mafra D, Cozzolino S M F. Erythrocyte zinc and carbonic anhydrase levels in nondialyzed chronic kidney disease patients [J]. Clinical Biochemistry, 2004, 37(1): 67—71
[15] Kuo W H, Yang S F, Hsieh Y S, et al. Differential expression of carbonic anhydrase isoenzymes in various types of anemia [J]. Clinica Chimica Acta, 2005, 351(1-2): 79—86
[16] Westerfield M, The Zebrafish Book. A Guide for the Laboratory Use of Zebrafish (Danio rerio) [M]. 4th ed. Eugene: Univ. of Oregon Press. 2000, 253—309
[17] Lu G, Moriyama E N. Vector NTI, a balanced all-in-one sequence analysis suite [J]. Briefings in Bioinformatics, 2004, 5(4): 378—388
[18] Letunic I, Copley R R, Schmidt S, et al. SMART 4.0: towards genomic data integration [J]. Nucleic Acids Research, 2004, 32(Database issue): D142—144
[19] Thompson J D, Higgins D G, Gibson T J. CLUSTAL W: improving the sensitivity of progressive multiple sequence alignment through sequence weighting, position-specific gap penalties and weight matrix choice [J]. Nucleic Acids Research, 1994, 22(22): 4673—4680
[20] Tamura K, Peterson D, Peterson N, et al. MEGA5: molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods [J]. Molecular Biology and Evolution, 2011, 28(10): 2731—2739
[21] Chen C H, Sun Y H, Pei D S, et al. Comparative expression of zebrafish lats1 and lats2 and their implication in gastrulation movements [J]. Developmental Dynamics, 2009, 238(11): 2850—2859
[22] Ishtiaq Ahmed A S, Yu L Q, Zhu Z Y, et al. Comparative expression analysis of GHR signaling related factors in zebrafish (Danio rerio) and an in vivo model to study GHR signaling [J]. Acta Hydrobiologica Sinica, 2011, 35(5): 727—738 [Abu Shufian Ishtiaq Ahmed, 于力群, 朱作言,等. 生长激素受体信号相关因子在斑马鱼中的比较表达分析及GHR信号通路体内研究模型的建立. 水生生物学报, 2011, 35(5): 727—738]
[23] Thisse C, Thisse B. High-resolution in situ hybridization to whole-mount zebrafish embryos [J]. Nature Protocols, 2008, 3(1): 59—69
[24] Lin T Y, Liao B K, Horng J L, et al. Carbonic anhydrase 2-like a and 15a are involved in acid-base regulation and Na+ uptake in zebrafish H+-ATPase-rich cells [J]. American Journal of Physiology-Cell Physiology, 2008, 294(5): C1250—C1260
[25] Cooney A J, Wiszniak S E, Dredge B K, et al. HuB (elavl2) mRNA is restricted to the germ cells by post-transcriptional mechanisms including stabilisation of the message by DAZL [J]. PLoS One, 2011, 6(6): e20773
[26] Higashijima S, Okamoto H, Ueno N, et al. High-frequency generation of transgenic zebrafish which reliably express GFP in whole muscles or the whole body by using promoters of zebrafish origin [J]. Developmental Biology, 1997, 192(2): 289—299
[27] Gavis E R, Lehmann R. Translational regulation of nanos by RNA localization [J]. Nature, 1994, 369(6478): 315—318
[28] Bashirullah A, Halsell S R, Cooperstock R L, et al. Jointaction of two RNA degradation pathways controls the timing of maternal transcript elimination at the midblastula transition in Drosophila melanogaster [J]. The EMBO Journal, 1999, 18(9): 2610—2620
[29] D'Agostino I, Merritt C, Chen P L, et al. Translational repression restricts expression of the C. elegans Nanos homolog NOS-2 to the embryonic germline [J]. Developmental Biology, 2006, 292(1): 244—252
[30] Giraldez A J, Mishima Y, Rihel J, et al. Zebrafish MiR-430 promotes deadenylation and clearance of maternal mRNAs [J]. Science, 2006, 312(5770): 75—79
[31] Koebernick K, Loeber J, Arthur P K, et al. Elr-type proteins protect Xenopus Dead end mRNA from miR-18-mediated clearance in the soma [J]. Proceedings of the National Academy of Sciences, 2010, 107(37): 16148—16153
[32] Kedde M, Strasser M J, Boldajipour B, et al. RNA-binding protein Dnd1 inhibits microRNA access to target mRNA [J]. Cell, 2007, 131(7): 1273—1286
[33] Lasko P, FAshburner M. The product of the Drosophila gene vasa is very similar to eukaryotic initiation factor-4A [J]. Nature, 1988, 335(6191): 611—617
[34] Hay B, Jan L Y, Jan Y N. A protein component of Drosophila polar granules is encoded by vasa and has extensive sequence similarity to ATP-dependent helicases [J]. Cell, 1988, 55(4): 577—587
[35] Kobayashi S, Yamada M, Asaoka M, et al. Essential role of the posterior morphogen nanos for germline development in Drosophila [J]. Nature, 1996, 380(6576): 708—711
[36] Subramaniam K, Seydoux G. nos-1 and nos-2, two genes related to Drosophila nanos, regulate primordial germ cell development and survival in Caenorhabditis elegans [J]. Development, 1999, 126(21): 4861—4871
[37] Tsuda M, Sasaoka Y, Kiso M, et al. Conserved role of nanos proteins in germ cell development [J]. Science, 2003, 301(5637): 1239—1241
[38] Jiang W B, Zhao D M, Hu W, et al. Molecular cloning and expression pattern of zar1 and zar1l in the zebrafish [J]. Acta Hydrobiologica Sinica, 2011, 35(4): 572—577 [江文波, 赵冬梅, 胡炜, 等. 斑马鱼 Zar1 和 Zar1-like 基因的克隆及其表达分析. 水生生物学报, 2011, 35(4): 572—577]
[39] Wang Z, Lin H. Nanos maintains germline stem cell self-renewal by preventing differentiation [J]. Science, 2004, 303(5666): 2016—2019
[40] Youngren K K, Coveney D, Peng X, et al. The Ter mutation in the dead end gene causes germ cell loss and testicular germ cell tumours [J]. Nature, 2005, 435(7040): 360—364
CLONING, IDENTIFICATION AND EXPRESSION ANALYSIS OF CA15B, A NOVEL GENE SPECIFICALLY EXPRESSED IN PRIMORDIAL GERM CELLS OF ZEBRAFISH
YANG Ming-Yu1,2, WANG Hou-Peng1, ZHU Zuo-Yan1and SUN Yong-Hua1
(1. State Key Laboratory of Freshwater Ecology and Biotechnology, Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan 430072, China; 2. University of Chinese Academy of Sciences, Beijing 100049, China)
Primordial germ cells (PGCs) are the ancestor cells of adult gametes at embryonic stage. PGCs-specific gene expression plays a fundamental role in germ cell induction, development, migration and differentiation. Understanding the functional role of PGCs-specifically expressed genes could provide us some tools to perform gene and embryo manipulations. Screening a public database of zebrafish (http://www.zfin.org) we found a PGCs-specific candidate gene, carbonic anhydrase 15b (ca15b). To confirm this, whole-mount in situ hybridization and other technologies were utilized to analyze the expression of ca15b during zebrafish early development. We observed that ca15b is a maternally expressed gene and it is highly expressed in germ plasm during cleavage stage. The expression of ca15b at mRNA level was specifically detected in the PGCs at blastula stage. At gastrula stage, ca15b is still strictly expressed in PGCs while its expression is undetectable in somatic cells. This specific expression pattern of ca15b persisted until one day post-fertilization. More importantly, the post-transcriptional regulation elements that mediate PGCs-specific expression of ca15b may locate in its coding sequence.
Zebrafish; Primordial germ cells; Expression pattern; ca15b
Q344+.1
A
1000-3207(2014)01-0142-08
10.7541/2014.19
2012-12-03;
2013-10-14
国家科技部973计划课题(2010CB126306); 国家自然科学基金优秀青年科学基金(31222052)资助
杨明宇(1987—), 男, 四川遂宁人; 硕士; 主要从事鱼类遗传学研究。E-mail: myysss87@gmail.com
孙永华, E-mail: yhsun@ihb.ac.cn
