大鲵铁蛋白重链FTH基因的克隆、鉴定及表达分析
2014-04-10辉李锋刚蓝青景胡伟刘小林王立新
杨 辉李锋刚蓝青景胡 伟刘小林王立新
(1. 西北农林科技大学动物科技学院, 杨凌 712100; 2. 陕西省农业分子生物学重点实验室, 杨凌 712100)
大鲵铁蛋白重链FTH基因的克隆、鉴定及表达分析
杨 辉1,2李锋刚1,2蓝青景1,2胡 伟1刘小林1王立新1,2
(1. 西北农林科技大学动物科技学院, 杨凌 712100; 2. 陕西省农业分子生物学重点实验室, 杨凌 712100)
从大鲵皮肤cDNA文库中, 筛选出大鲵铁蛋白重链AdFTH的cDNA序列, 其全长为864 bp, 开放阅读框为531 bp, 编码176个氨基酸, 5′和3′非翻译编码区(Untranslated region, UTR)分别为120 bp和214 bp, 预测蛋白质的分子量为20.6 kD, 理论等电点PI为5.41, 预测蛋白无信号肽及跨膜结构, 在5′-UTR的22—51 bp处有一个特殊的铁反应元件(Iron response element, IRE)。同源性和系统进化分析表明, 铁蛋白重链在进化上有着较高的保守性。实时定量PCR结果表明, 大鲵铁蛋白重链mRNA在各个组织中广泛表达, 其中肝脏的表达量高于其他8种组织, 表明肝脏是大鲵主要的参与铁储存代谢的器官。成功构建了大鲵铁蛋白重链的重组表达载体pET32a-AdFTH, 利用大肠杆菌Escherichia coli BL21表达系统和Ni2+亲和层析方法, 获得了纯度较高的重组大鲵铁蛋白, 并证实重组大鲵铁蛋白(Recombinant AdFTH protein, rAdFTH)具有氧化和吸收铁离子的功能, 为进一步制备AdFTH抗体了解其在大鲵体内的多种作用机制打下坚实的基础。
大鲵; 铁蛋白重链; 序列分析; 原核表达; 组织分布
在生物有机体中, 铁元素参与了多种活动, 如氧的运输、DNA复制、电子传递、光合作用和细胞增殖等, 对维持细胞正常生长和代谢起着重要的作用[1]。但是, 细胞内过高的铁含量会对机体细胞造成一定的损伤和死亡[2]。因此对于生物体而言, 细胞内铁的代谢和其稳态的维持有着重要的意义, 并由一类特定的蛋白质完成[3]。
铁蛋白(Ferritin)是广泛存在于生物体内的一种铁储存和生物矿化蛋白质, 脊椎动物通常含有轻链(L)和重链(H)两种铁蛋白亚基, 两栖类动物拥有另外一种铁蛋白中型链(M), 而无脊椎动物只有一种与重链最为相似的亚基[4,5]。铁蛋白的三维结构是一个可容纳铁离子的球形结构, 在脊椎和无脊椎动物体内均高度保守。铁蛋白在功能上也具有较高的保守性, 其主要作用是结合、吸收细胞内的铁离子并使其矿化, 在维持机体铁平衡中发挥着重要作用[6]。铁蛋白的铁以一种三价铁离子氧化物的形式存在,不仅能储存机体内过剩的铁, 为含铁元素蛋白质的合成提供铁原子, 也可以防止铁氧化过程中所产生的自由基带来的伤害[7]。此外, 铁蛋白还具有抗氧化功能及作为应激和炎症的反应蛋白, 在机体免疫中也起着一定作用[8,9]。
中国大鲵(Andrias davidianus)俗称娃娃鱼, 隶属于两栖纲, 有尾目, 隐鳃鲵科, 是我国特有的大型珍稀两栖动物, 也是现今世界上体形最大的两栖动物。由于大鲵是野生动物从水生向陆生的过渡物种, 因此在研究物种起源、基因家族进化上具有重要的研究价值。近年来, 大鲵也逐渐成为我国淡水养殖的一种经济种类, 不仅具有食用和药用价值[10,11],而且有着极高的经济效益, 其养殖业的发展也具有一定规模。但是, 与其他物种相比, 有关中国大鲵的研究相对较少, 关于大鲵铁蛋白ferritin基因的研究尚属空白。因此, 研究大鲵在细胞代谢和生长发育中有重要作用的铁蛋白ferritin具有着重要的意义。本文首次研究和报道了大鲵铁蛋白ferritin一个亚基(铁蛋白重链, AdFTH)同源基因的全长 cDNA序列,对其可能的结构进行了分析和预测, 研究了在大鲵组织中的表达分布特征, 并利用大肠杆菌体外表达系统重组表达了大鲵铁蛋白, 分析重组蛋白活性,为认识大鲵铁蛋白和研究该分子的进化和功能奠定了基础。
1 材料与方法
1.1 实验材料
本实验所用的健康的3尾3龄以上大鲵(Andrias davidianus)购自陕西汉中天利大鲵养殖场。大鲵麻醉致死后, 在无菌条件下, 取肝脏、肌肉、皮肤、肾脏、脾脏、肺、心脏、胃、肠等组织样, 迅速放入液氮中浸泡冷冻, 并用锡箔纸包装放入–80℃保存,用于总RNA提取。
Escherichia coli BL21 (DE3)由本实验室保存, pET-32a(+)表达载体购自 Novagen公司, 大鲵皮肤cDNA文库由本实验室构建保存。
1.2 实验方法
大鲵铁蛋白重链AdFTH 基因的序列分析 通过构建大鲵皮肤 cDNA文库, 挑选单克隆测序, 获得大鲵铁蛋白重链AdFTH (ferritin heavy chain)基因的全长cDNA序列。使用NCBI数据库(http://blast. ncbi.nlm.nih.gov/)的Blastn 和Blastx软件进行基因同源性的搜索, 使用Vector NTI Suit 8.0软件来分析序列的开放阅读框及翻译氨基酸序列, 利用signalP4.0在线软件(http://www.cbs.dtu.dk/services/ SignalP/)和 TMHMM跨膜预测软件(http://www.cbs. dtu.dk/services/TMHMM/)分别预测信号肽序列和跨膜区预测, 使用 ExPASy网站(http://prosite.expasy. org/)预测分析蛋白质特性及可能的二级结构, 不同物种氨基酸序列的多重比对使用Clustal W 1.8软件,系统进化树使用 MEGA 4.1软件的邻近法 NJ (Neighbor-joining tree)构建, 设置1000次bootstraps进行评估。
大鲵组织RNA 的提取及cDNA 的合成 取出于–80℃保存的组织样, 迅速放入液氮中, 按照Trizol (Invitrogen)试剂盒说明书提取以上组织的总RNA, 并通过 1%的琼脂糖凝胶电泳和核酸分析仪来检测所提取RNA的质量以及浓度。
cDNA合成采用PrimeScript™ RT reagent Kit试剂盒(TaKaRa)。参照试剂盒说明, 取500 ng总RNA, 10 μL的反应体系, 在37℃反转录反应15min, 85℃灭活酶活性5s。
大鲵AdFTH 基因的组织表达 实时荧光定量PCR采用SYBR GreenⅠ染料法(SYBR®Premix Ex TaqTMII, TaKaRa), 在 Bio-Rad荧光定量 PCR仪CFX-96上进行。反应终体系为25 μL, 包括12.5 μL 2×SYBR Green Msater mix缓冲液, 150 ng DNA模板量, 正反引物各1.25 μL (10 μmol/L)。铁蛋白重链基因的两个特异性引物为FTH-F: 5'-ATGAGTGGAAC AACACCCT-3', FTH-R: 5'-GTCTCCAGGAAGTCA CAGAG-3', 扩增产物为133 bp。选用β-actin作为内参基因并设计特异性引物为β-actin-F: 5'-GCCAT CAATCGTCCACCG-3', β-actin-R: 5'-CCGCATCAA GCACCAGAA-3', 扩增产物为132 bp。反应条件为: 95℃ 3min; 95℃ 10s, 60℃ 30s, 40个循环; 反应完成后进行熔解曲线分析, 95℃变性15s, 按0.1℃ /s的增速缓慢从 65℃升至 95℃。使用 CFX Manager Software采集数据, 并且按照 2–△△Ct法来计算相对表达量。
pET32a-AdFTH 重组质粒的构建 根据获得的大鲵AdFTH全长cDNA序列与重组表达载体pET-32a(+)多克隆位点的特征, 设计引物 FTH-F: 5'-CCGGAATTC ATGGAGTCCCAGGTGCGC-3'(下划线为EcoRⅠ酶切位点)FTH-R: 5'-CCGCTCGAGT TAGCTGCTCTCCCCCAT-3'(下划线为XhoⅠ的酶切位点)。以大鲵cDNA为模板, 利用FTH-F和FTH-R引物序列扩增大鲵 FTH成熟肽序列。将纯化后的PCR产物与表达载体 pET-32a(+)分别用 EcoRⅠ、XhoⅠ进行双酶切处理, 用 1%的琼脂糖凝胶电泳分离目的片段和表达载体, 切胶纯化。目的片段与表达载体在T4DNA连接酶的作用下, 16℃连接过夜。并将连接产物转化到 BL21(DE3)感受态细胞中, 涂布于终浓度为50 μg/mL氨苄青霉素的LB固体培养基上, 利用菌落PCR的方法筛选阳性克隆, 并进行测序。
重组AdFTH蛋白的表达及纯化 对经检测插入正确目的片段的重组质粒进行诱导表达。将筛选的工程菌接种至1 mL含氨苄青霉素浓度为50 μg/mL的LB液体培养基中, 37℃ 220 r/min振荡培养4—6h后, 并按照1∶50比例接种于200 mL LB培养基中, 37℃培养至 A600值至 0.6—0.8之间时, 加入终浓度为1 mmol/L的IPTG进行诱导表达。并分别于0、0.5、1、2、3、4、5h取样, 5000 r/min 4℃离心10min,收集菌体, 并用无菌PBS缓冲液重悬菌体。经超声破碎后, 分别收集上清和沉淀, 加入上样缓冲液煮沸后, 经15%分离胶和5%浓缩胶SDS-PAGE进行检测。通过SDS-PAGE电泳, 分析重组大鲵铁蛋白重链是以包涵体还是以可溶性存在。
10000 r/min 4℃离心10min, 收集上清液, 并负载上 Ni-NTA亲和层析柱, 分别用 Soluble Binding Buffer (20 mmol/L Tris-HCl, 500 mmol/L NaCl, 10 mmol/L咪唑, pH 7.9)和 Soluble Elution Buffer (20 mmol/L Tris-HCl, 500 mmol/L NaCl, 500 mmol/L咪唑, pH 7.9)洗脱, 收集 Soluble Elution Buffer洗脱后的洗脱峰, 经 SDS-PAGE电泳检测纯化效果。
重组AdFTH 蛋白的活性检测 利用Bradford方法, 对纯化出来的重组大鲵铁蛋白(Recombinant AdFTH protein, rAdFTH)进行定量, 测定其浓度并用于活性检测。根据Kim, et al.[12]研究的方法, 利用1%巯基乙酸的乙酸钠溶液(0.1 mol/L, pH 5.5), 除去rAdFTH中的铁离子, 通过2,2-联吡啶螯合该溶液中的铁离子并在Hepes缓冲液 (0.1 mol/L, pH 7.0)中透析。然后将20 μg/mL rAdFTH, 纯化后的标签蛋白, 20 μg/mL的牛血清蛋白(BSA)在含有1 mmol/L硫酸亚铁铵的0.1 mol/L Hepes中室温孵育10min, 并于310 nm光度值处检测OD值的变化。
2 结果
2.1 大鲵铁蛋白重链AdFTH 基因cDNA 序列分析
从本实验室构建的大鲵皮肤 cDNA文库[13]中得到的 AdFTH cDNA全长 864 bp, 开放阅读框(Open reading frame, ORF)长531 bp, 编码176个氨基酸, 5′-UTR长120 bp, 3′-UTR长214 bp, 终止密码子为 TAA, 3′末端存在加尾信号“AATAAA”, 在距离加尾信号19个核苷酸处有polyA的尾巴。开放阅读框编码蛋白的, 预测分子量大小为20.6 kD,理论等电点PI为5.41。利用SignalP4.0软件分析,在其N末端没有发现信号肽序列, TMHMM预测序列不存在跨膜结构, 序列中存在着一个潜在的 N-糖基化位点“N91-N-T-L”。在5'非编码区核苷酸序列的22—51 bp的位置, 有个特殊的铁反应元件(IRE),并含有一个 CAGUGU序列。二级结构分析表明,大鲵铁蛋白重链是由6段α螺旋组成, 可以形成一个4-bundle的螺旋结构, 在NCBI GenBank登录号为JX195179。
2.2 大鲵铁蛋白重链AdFTH 的多序列比对及系统进化树分析
将大鲵铁蛋白重链cDNA编码的氨基酸序列与其他无脊椎动物和脊椎动物进行多序列比对, 发现与金属结合位点相关的7个残基 (以大鲵的FTH氨基酸序列为例E24、Y31、E58、E59、H62、E104、Q138)呈现高度的保守性。
氨基酸序列同源性分析显示, 大鲵与非洲爪蟾(Xenopus laevis)的铁蛋白重链相似性最高, 达89.8%;与节肢动物的罗氏沼虾(Macrobrachium rosenbergii)、小 龙 虾 ( Pacifastacus leniusculus)、 中 国 对 虾(Fenneropenaeus chinensis)的同源性分别为 6 0.8%、51.4%、62.4%; 与硬骨鱼类的斑点叉尾 鮰 (Ictalurus punctatus)、斑马鱼(Danio rerio)、金目鲈(Lates calcarifer)、文昌鱼(Branchiostoma lanceolatum)的同源性分别为 7 1.2%、69.5%、71.2%、64.0%; 与鸡(Gallus gallus)、褐家鼠(Rattus norvegicus)、牛(Bos taurus)、人(Homo sapiens)的同源性分别为 71.8%、69.5%、68.4%、68.9%。利用Mega软件临近(NJ)法则, 经1000次bootstraps计算, 构建进化树。进化树分析表明, 所选动物的铁蛋白重链氨基酸序列分为两支, 脊椎动物为一支, 无脊椎动物为另一支, 脊椎动物的分支关系同物种的进化关系保持一致, 大鲵铁蛋白重链与非洲爪蟾的铁蛋白重链聚为一支(图1)。
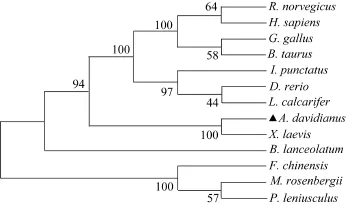
图1 铁蛋白重链的系统进化树Fig. 1 Phylogenetic tree of the FTH amino acid sequence
2.3 大鲵铁蛋白重链AdFTH 基因的组织表达分析
选择大鲵的 β-actin基因作为内参基因, 以AdFTH 基因特异性引物作为扩增引物, 利用Quantitative Real-time PCR的方法检测AdFTH基因在大鲵不同组织中的相对表达量。熔解曲线显示为单一峰值, 表明无非特异性扩增和引物二聚体。如图2所示, AdFTH基因mRNA在所选的9个组织中均有表达, 在肝脏中的表达量最高, 在皮肤、胃、肺、肠、肌肉中的表达量相对较低, 在心脏、肾脏、脾脏中的表达量介于两者之间。

图2 大鲵铁蛋白重链的组织表达分析Fig. 2 Tissue distribution analyses of Andrias davidianus FTH
2.4 大鲵铁蛋白重链AdFTH 原核表达及纯化分析
将 EcoRⅠ、XhoⅠ双酶切的目的片段和载体质粒, 利用T4连接酶进行连接, 并转化进入感受态细胞中 BL21(DE3), 挑选阳性单克隆, 送华大基因公司测序。对测序结果进行比对分析, 挑选出正确的重组载体序列, 即确定重组载体 p ET32a-AdFTH构建的正确性。
经 SDS-PAGE电泳检测, 重组质粒 pET32a AdFTH在大肠杆菌中高效表达异源蛋白。该重组蛋白分子量大小在 36.0 kD左右, 与预测的大鲵铁蛋白(20.6 kD)和标签蛋白(Trx-tag、S-tag、His-tag; 共18.0 kD)之和大体一致, 重组表达载体经IPTG诱导后, 融合蛋白得到表达, 而大肠杆菌没有相应的蛋白表达。同时, 对细菌裂解液的上清和沉淀分析表明, 重组融合蛋白是以可溶性的形式存在于上清中。利用 N i2+螯合亲和层析柱纯化上清中的重组蛋白, 用不同浓度的咪唑洗脱液进行置换, 洗脱特异性结合的蛋白质。SDS-PAGE检测显示, 只有一条分子量 36.0 kD左右的目的条带, 并且无其他蛋白质杂带。-
2.5 重组铁蛋白活性检测分析
对纯化出来的蛋白质, 利用Bradford方法进行测定, 所测样品光度值与标准曲线相比较得出, 纯化的重组铁蛋白浓度为285.8 μg/mL, 并计算其菌体表达量为24.29 μg/mL。利用Kim, et al.的方法进行rAdFTH活性检测分析, 发现在 310 nm 处检测rAdFTH的OD值为0.921(图3), 明显高于(P<0.01)对照组BSA(0.113)和标签蛋白Tag (0.135), 表明重组大鲵铁蛋白重链具有氧化吸收铁离子的功能。

图3 重组大鲵铁蛋白重链活性检测Fig. 3 The activity test of recombinant AdFTH protein
3 讨论
3.1 大鲵铁蛋白重链AdFTH cDNA 序列分析
本研究从构建的大鲵皮肤cDNA文库[13]中筛选得到大鲵铁蛋白重链AdFTH同源基因的全长cDNA序列。在NCBI数据库BLAST比对, 结果显示其核苷酸序列和氨基酸序列与热带爪蟾同源性均为90%, E值分别为5e–110和2e–116。信号肽和跨膜结构分析表明, 该序列无信号肽及跨膜结构域。有研究指出,铁蛋白可分为胞质内铁蛋白和分泌型铁蛋白[14], 且分泌型铁蛋白以微量形式存在于脊椎动物的血液中[15]。在本研究中, 大鲵铁蛋白重链的氨基酸序列中无信号肽及跨膜结构, 表明所筛选到的铁蛋白为胞质内铁蛋白。对比中华绒螯蟹[16]、中国对虾[17]、文昌鱼[18]及仿刺参[19]等动物铁蛋白基因序列发现, 大鲵AdFTH cDNA序列5′-UTR中同样含有一个特殊的铁反应元件(IRE), 该元件是一个由CAGUGU序列形成的茎环结构[20,21], 这预示着大鲵铁蛋白重链 A dFTH的表达可能是通过铁离子在翻译水平上受到调控的。二级结构分析表明, 大鲵铁蛋白重链是由6段α螺旋组成, 可以形成一个 4-bundle的螺旋结构, 而4-bundle的螺旋结构是H亚基铁氧化酶活性中心。
在人体内的研究表明, 铁蛋白氨基酸 E63、H66残基和Y30、Y33、Y35残基分别参与多晶体Fe复合物及亚铁氧化酶中心形成[22], 而这些氨基酸残基与大鲵铁蛋白重链完全一致。氨基酸序列多重比对分析结果表明, 铁蛋白的 7个与铁离子结合相关的氨基酸残基, 在大鲵和其他动物中均高度保守; 经序列同源性分析, 与已报道的两栖动物非洲爪蟾的铁蛋白重链同源性最高, 与其他无脊椎动物和脊椎动物也有较高的相似性; 进化树分析结果也表明, 作为两栖动物的大鲵与非洲爪蟾在进化关系上最为接近, 同聚为一支, 其他铁蛋白的进化关系基本同物种进化关系保持一致。据此, 从重要位点及结构的保守性上可确认所筛选的序列是大鲵铁蛋白的 H亚基,并且该基因在进化和功能上具有较高的保守性。
3.2 大鲵铁蛋白重链AdFTH mRNA组织表达分析
在生物体内, 铁蛋白不仅是主要的铁调节蛋白,而且也是细胞用来抵抗应激和炎症的一种蛋白[8,23]。有研究表明, 铁蛋白是一种急性时相反应蛋白, 并在粒细胞和巨噬细胞产生过程中起到调节作用[24],对骨髓起源细胞、造血系统细胞和淋巴细胞增殖有抑制作用[25]。不同物种的铁蛋白mRNA组织分布和储铁器官是不一样的, 通过对铁蛋白mRNA在不同组织分布的研究, 能够更有效地理解其作用机理及调控机制。在中华鲟中, 铁蛋白mRNA在肝胰脏、肌肉、胃、心脏、鳃等多种组织均有表达, 其中肝胰脏和心脏是参与铁储存的主要器官[26]; 在南美白对虾中, 血细胞是参与铁储存代谢的主要器官, 铁蛋白mRNA在血细胞、肝胰脏、眼柄、腹神经节、胸神经节等组织中均有表达[27]; 在合浦珠母贝中,其肌肉组织的mRNA有着较高含量[28]。本研究表明,大鲵铁蛋白重链mRNA在大鲵肝脏、胃、肺、皮肤、肌肉、肠、肾、心脏、脾脏中均有表达, 其中在肝脏中的表达量最高, 在皮肤、胃、肺、肠、肌肉中的表达量相对较低, 在心脏、肾脏、脾脏中的表达量介于两者之间。铁蛋白重链mRNA在各个组织中成广泛性的组成型表达, 可能与胞质内铁蛋白的性质有关, 也暗示着可能参与多种生理功能[29,30]。在肝脏中的表达量最高, 可能与细胞核铁蛋白主要存在于肝细胞等细胞中相关[31], 也表明肝脏是大鲵主要的铁代谢和储存器官。铁蛋白有着一定的免疫功能, 而肾和脾脏作为动物体内重要的免疫器官, 便解释了大鲵铁蛋白重链mRNA在肾脏和脾脏中的高效表达。与其他物种一致, 铁蛋白的重链亚基(H),也称作为心脏型, 在大鲵的心脏中也有着较高表达量。此外, 有研究报道指出, 铁蛋白表达水平的异常与多种疾病密切相关[32,33]。铁蛋白水平的增加既能反映干细胞破坏和炎症程度, 也可作为肝脏代谢的功能性检测指标[34]。目前在大鲵上的研究相对较少,对相关疾病的检测尚不完整, 通过对大鲵铁蛋白研究的深入, 铁蛋白很可能成为养殖动物疾病检测的一个重要指标[35]。
3.3 大鲵铁蛋白重组表达分析
大肠杆菌表达系统具有生长周期短、操作方便、培养简单、成本低廉等优点, 已成为许多异源蛋白质的首选表达系统[36]。表达载体 pET-32a(+)具有 6个组氨酸标签能够与 Ni2+高亲和结合, 便于重组蛋白的纯化。因此, 本研究选择 pET-32a(+)为表达载体, 构建了大鲵铁蛋白重链 AdFTH的重组表达载体。SDS-PAGE结果显示, 重组载体在IPTG诱导后,铁蛋白重链在大肠杆菌中得到高效表达, 经 Ni2+亲和层析柱纯化后, 在36.0 kD出现单一性条带, 表明纯化质量较好。对纯化出来的重组大鲵铁蛋白进行活性分析, 与对照相比, 重组大鲵铁蛋白重链具有氧化吸收铁离子功能, 与报道的重组文蛤铁蛋白相一致[37], 表明本实验采用的原核表达体系能够在体外获得具有生物活性的重组大鲵铁蛋白。在生物体内, 铁蛋白除了储存铁离子的功能外, 还具有一定的机体免疫防御功能[30,38]。重组血吸虫铁蛋白研究表明, 其对抵抗应激和炎症也有一定作用[39]。此外有研究指出, 与铁蛋白有着类似作用机理的重组转铁蛋白, 表现出一定的抑菌作用[40], 但对铁蛋白的研究还尚未报道。铁蛋白所储藏的铁常以可溶性形式存在, 不具有毒性, 属于具有生物利用价值的铁源[41], 对外源铁蛋白研究的深入, 为缓解铁营养缺乏病提供了可能。另有研究发现, 一些细胞吸收了外源的铁蛋白后可增强抗氧化能力。铁蛋白能够增加对氧化损害的抵抗能力, 随着更进一步的研究,外源表达的铁蛋白也许可作为一种饲料免疫添加剂,来增强机体的氧化能力, 提高机体免疫能力。
综上所述, 本文从已构建的大鲵皮肤cDNA文库中成功筛选出大鲵铁蛋白重链的全长cDNA序列,对其进行生物信息学分析, 表明铁蛋白重链在进化和功能上有一定的保守性。对其mRNA组织分布的研究发现, 在大鲵肝脏中mRNA的含量最高, 表明肝脏是大鲵主要的参与铁储存和代谢的器官。利用原核表达系统和 Ni2+亲和层析法, 已成功诱导并纯化具有生物学活性的重组大鲵铁蛋白重链, 为进一步制备大鲵铁蛋白抗体, 了解其在大鲵体内的生物学活性及作用机制, 打下坚实的基础。
[1] Thomson A M, Rogers J T, Leedman P J. Iron-regulatory proteins, iron-responsive elements and ferritin mRNA translation [J]. International Journal of Biochemistry & Cell Biology, 1999, 31(10): 1139—1152
[2] Reif D W. Ferritin as a source of iron for oxidative damage [J]. Free Radical Biology Medicine, 1992, 12(5): 417—427
[3] Aust S D. Ferritin as a source of iron and protection from iron-induced toxicities [J]. Toxicology Letters, 1995, 82—83: 941—944
[4] Xie M, Hermann A, Richter K, et al. Nitric oxide up-regulates ferritin mRNA level in snail neurons [J]. European Journal of Neuroscience, 2001, 13(8): 1479—1486
[5] Zhang Y, Meng Q, Jiang T, et al. A novel ferritin subunit involved in shell formation from the pearl oyster (Pinctada fucata) [J]. Comparative Biochemistry and Physiology B-Biochemistry& Molecularl Biology, 2003, 135(1): 43—54
[6] Wang D, Kim B Y, Lee K S, et al. Molecular characterization of iron binding proteins, transferrin and ferritin heavy chain subunit, from the bumblebee Bombus ignites [J]. Comparative Biochemistry and Physiology B-Biochemistry & Molecularl Biology, 2009, 152(1): 20—27
[7] Li M, Saren G, Zhang S. Identification and expression of a ferritin homolog in amphioxus Branchiostoma belcheri: evidence for its dual role in immune response and iron metabolism [J]. Comparative Biochemistry and Physiology B-Biochemistry & Molecularl Biology, 2008, 150(3): 263—270
[8] Torti F M, Torti S V. Regulation of ferritin genes and protein [J]. Blood, 2002, 99(10): 3505—3516
[9] Orino K, Lehman L, Tsuji Y, et al. Ferritin and the response to oxidative stress [J]. Biochemical Journal, 2001, 357(Pt 1): 241—247
[10] Ai W M , Chen S B, Zeng G Q, et al. Analysis of artificial simulation of ecological farming sub-second generation of Chinese giant salamander muscle nutrients [J]. Journal of Hydroecology, 2008, 1(6): 120—123 [艾为明, 陈少波, 曾国权, 等. 人工模拟生态养殖子二代大鲵肌肉营养成分分析. 水生态学杂志, 2008, 1(6): 120—123]
[11] Wu G F, Tian W S, Huang Q Y, et al. Rare and economic amphibians in China [J]. Sichuan Journal of Zoology, 2000, 19(3): 192—195 [吴贯夫, 田婉淑, 黄庆云, 等. 中国珍稀及经济两栖动物. 四川动物, 2000, 19(3): 192—195]
[12] Kim T Y, Joo I J, Kang S Y, et al. Paragonimus westermani: molecular cloning, expression, and characterization of a recombinant yolk ferritin [J]. Experimental Parasitology, 2002, 102(3—4): 194—200
[13] Wang L X, Zheng Y, Ai M, et al. Construction of cDNA library of Andrias davidanus skin tissue with analyzing the cDNA sequence and expression of Arpc5l gene [J]. Chinese Journal of Biochemistry Molecular Biology, 2011, 27(3): 273—281 [王立新, 郑尧, 艾闽, 等. 大鲵皮肤cDNA文库构建及Arpc5l基因cDNA序列和组织表达分析. 中国生物化学与分子生物学报, 2011, 27(3): 273—281]
[14] Huang T S, Law J H, Soderhall K. Purification and cDNA cloning of ferritin from the hepatopancreas of the freshwater crayfish Pacifastacus leniusculus [J]. European Journal of Biochemistry, 1996, 236(2): 450—456
[15] Linder M C, Madani N, Middleton R, et al. Ferritin synthesis on polyribosomes attached to the endoplasmic reticulum [J]. Journal of Inorganic Biochemistry, 1992, 47(3—4): 229—240
[16] Guo H Z, Fu J P, Chang M X, et al. Cloning and expression analysis of ferritin from Chinese mitten crab Eriocheir sinensis [J]. Journal of Fisheries of China, 2010, (6): 725—732 [郭慧芝, 付建平, 昌鸣先, 等. 中华绒螯蟹铁蛋白基因的克隆及表达分析. 水产学报, 2010, (6): 725—732]
[17] Zhang J, Li F, Wang Z, et al. Cloning, expression and identification of ferritin from Chinese shrimp, Fenneropenaeus chinensis [J]. Journal of Biotechnology, 2006, 125(2): 173—184
[18] Li X Y, Zhang W, Lin Y S, et al. Sequence analysis, homology comparison and secondary structure prediction of ferritin protein gene in Qingdao amphioxus [J]. Journal of Shandong University, 2003, 38(5): 116—120 [李忻怡, 张伟,林浴霜, 等. 青岛文昌鱼铁蛋白ferritin基因的序列分析、同源性比较及二级结构预测. 山东大学学报, 2003, 38(5): 116—120]
[19] Yang A F, Zhou Z C, Sun D P, et al. Sequence and expression analysis of ferritin gene in Apostichopus japonJioucrnaal osf F ish[eriJes ]of .Ch ina, 2010, (6): 710—717 [杨爱馥, 周遵春, 孙大鹏, 等. 仿刺参铁蛋白ferritin基因的序列分析及表达. 水产学报, 2010, (6): 710—717]
[20] Henderson B R, Menotti E, Bonnard C, et al. Optimal sequence and structure of iron-responsive elements. Selection of RNA stem-loops with high affinity for iron regulatory factor [J]. Journal of Biological Chemistry, 1994, 269(26): 17481—17489
[21] Munro H. The ferritin genes: their response to iron status [J]. Nutrition Reviews, 1993, 51(3): 65—73
[22] Beck G, Ellis T W, Habicht G S, et al. Evolution of the acute phase response: iron release by echinoderm (Asterias forbesi) coelomocytes, and cloning of an echinoderm ferritin molecule [J]. Developmental and Comparative Immunology, 2002, 26(1): 11—26
[23] Durand J P, Goundard F, Barbot C, et al. Ferritin and hemocyan: 210Po molecular traps in marine fish oyster lobster [J]. Marine Ecology Progress Series, 2002, 233: 199—205
[24] Broxmeyer H E, Bognacki J, Dorner M H, et al. Identification of leukemia-associated inhibitory activity as acidic isoferritins. A regulatory role for acidic isoferritins in the production of granulocytes and macrophages [J]. Journal of Experimental Medicine, 1981, 153(6): 1426—1444
[25] Broxmeyer H E. H-ferritin: a regulatory cytokine that down-modulates cell proliferation [J]. Journal of Laboratory and Clinical Medicine, 1992, 120(3): 367—370
[26] Chen X W, Shi Z Y, Cheng Q Q. Cloning and tissue distribution analysis of full-length cDNA ferritin sequence in Chinese sturgeon Acipenser sinensis [J]. Zoological Research, 2009, 30(2): 144—150 [陈晓武, 施志仪, 程千千.中华鲟铁蛋白基因cDNA全长克隆与组织表达分析. 动物学研究, 2009, 30(2): 144—150]
[27] Hsieh S L, Chiu Y C, Kuo C M. Molecular cloning and tissue distribution of ferritin in Pacific white shrimp (Litopenaeus vannamei) [J]. Fish and Shellfish Immunology, 2006, 21(3): 279—283
[28] Zhang Y, Meng Q, Jiang T, et al. A novel ferritin subunit involved in shell formation from the pearl oyster (Pinctada fucata) [J]. Comparative Biochemistry and Physiology B-Biochemistry & Molecularl Biology, 2003, 135(1): 43—54
[29] Durand J P, Goudard F, Pieri J, et al. Crassostrea gigas ferritin: cDNA sequence analysis for two heavy chain type subunits and protein purification [J]. Gene, 2004, 338(2): 187—195
[30] Recalcati S, Invernizzi P, Arosio P, et al. New functions for an iron storage protein: the role of ferritin in immunity and autoimmunity [J]. Journal of Autoimmunity, 2008, 30(1—2): 84—89
[31] Cheepsunthorn P, Palmer C, Connor J R. Cellular distribution of ferritin subunits in postnatal rat brain [J]. Journal of Comparative Neurology, 1998, 400(1): 73—86
[32] Huang C W, Bai L, Cui S D, et al. Study on the relationship between serum iron, serum ferritin and fatty liver [J]. Chinese Journal of Digestion, 2003, 23(4): 211—212 [黄聪武, 白岚, 崔生达, 等. 血清铁、铁蛋白和脂肪肝关系的研究. 中华消化杂志, 2003, 23(4): 211—212]
[33] Shao F, Zhu F Q, Li C J. Clinical meaning of serum ferritin, iron in chronic hepatitic B [J]. Journal of Xi’an Jiaotong University (Medical Science), 2006, 27(3): 292—294 [邵飞, 朱凤群, 李春姬. 慢性乙型病毒性肝炎血清铁及铁蛋白检测. 西安交通大学学报(医学版), 2006, 27(3): 292—294]
[34] Qu R, Liu R, Xie Y B, et al. Research advance in ferritin expression on chronic liver diseases and liver cancer [J]. Medical Recapitulate, 2009, 15(23): 3545—3548 [屈锐, 刘锐, 谢云波, 等. 铁蛋白在慢性肝病和肝癌中表达情况的研究进展. 医学综述, 2009, 15(23): 3545—3548]
[35] Orino K, Watanabe K. Molecular, physiological and clinical aspects of the iron storage protein ferritin [J]. Veterinary Journal, 2008, 178(2): 191—201
[36] Manning D S, Leong J C. Expression in Escherichia coli of the large genomic segment of infectious pancreatic necrosis virus [J]. Virology, 1990, 179(1): 16—25
[37] Yao X L, Sun J S, Zhang Q, et al. Recombinant expression and tissue distribution analysis of ferritin in Meretrix meretrix [J]. Oceanologia et Limnologia Sinica, 2011, 42(6): 863—867 [姚学良, 孙金生, 张勤, 等. 文蛤(Meretrix meretrix)铁蛋白的重组表达及其组织表达特征分析. 海洋与湖沼, 2011, 42(6): 863—867]
[38] Gueguen Y, Cadoret J P, Flament D, et al. Immune gene discovery by expressed sequence tags generated from hemocytes of the bacteria-challenged oyster, Crassostrea gigas [J]. Gene, 2003, 303: 139—145
[39] Wang M, Yi X Y, Zeng X F, et al. Schistosoma japonicum recombinant ferritin: expression, purification and its protective immunity against Schisyosoma japonicum in mice [J]. Chinese Journal of Zoonoses, 2004, 20(2): 113—116 [王敏, 易新元, 曾宪芳, 等. 重组日本血吸虫铁蛋白的表达纯化及诱导小鼠保护性免疫研究. 中国人兽共患病杂志, 2004, 20(2): 113—116]
[40] Gao M Y, Zhu X P, Shi Y, et al. Recombinant expression and antimicrobial activity analysis of transferring in asian yellow pond turtle [J]. Acta Hydrobiologica Sinica, 2012, 36(5): 892—897 [高明英, 朱新平, 史燕, 等. 黄喉拟水龟转铁蛋白重组表达及抗菌活性分析. 水生生物学报, 2012, 36(5): 892—897]
[41] Liu Q Q, Yao Q H, Wang H M, et al. Endosperm-specific expression of the ferritin gene in transgentic rice (Oryza sativa L.) results in increased iron content of milling rice [J]. Acta Genetica Sinica, 2004, 31(5): 518—524 [刘巧泉, 姚泉洪, 王红梅, 等. 转基因水稻胚乳中表达铁结合蛋白提高稻米铁含量. 遗传学报, 2004, 31(5): 518—524]
CLONING, IDENTIFICATION AND EXPRESSION OF FERRITIN HEAVY CHAIN FROM CHINESE GIANT SALAMANDERS, ANDRIAS DAVIDIANUS
YANG Hui1,2, LI Feng-Gang1,2, LAN Qing-Jing1,2, HU Wei1, LIU Xiao-Lin1and WANG Li-Xin1,2
(1. College of Animal Sciences, Northwest A&F University, Yangling 712100, China; 2. Shaanxi Key Laboratory of Molecular Biology for Agriculture, Yangling 712100, China)
Ferritin is an important iron storage protein in organism with the function of detoxification, anti-inflammatory and anti-stress. In this study, the full length cDNA of Andrias davidianus ferritin heavy chain (AdFTH) was isolated from the constructed skin cDNA library, and it consists of 864 bp including an open reading frame (ORF) of 531 bp, a 5′-terminal untranslated region (UTR) of 120 bp, and a 3′-UTR of 214 bp. The predicted molecular weight is 20.6 kD and the theoretical isoelectric point is 5.41 with no amino-terminal signal peptide and transmembrance domain. A complete iron-responsive element (IRE) locates at the 5′-UTR corresponding to the nucleotide sequence at the positions of the 22—51 bp. The homology and phylogenetic analysis of FTH among other animals indicated that it is an evolutionarily conserved gene. The results of quantitative real time PCR demonstrated that AdFTH was ubiquitously expressed, and the highest level of adFTH was observed in the liver from total 9 tissues, which may support that the liver is the major organ for the storage and metabolism of iron in Andrias davidianus. Additionally, a recombinant expression vector pET32a-AdFTH was constructed, and the recombinant protein was purified using the expression system in E. coli BL21 (DE3) pLysS and Ni2+-chelating chromatography. The purified recombinant AdFTH protein (rAdFTH) promoted iron oxidation and iron uptake in vitro, suggesting that the rAdFTH protein may be used to produce the monoclonal antibodies and provide a foundation for further investigation of the physiological function of AdFTH.
Andrias davidianus; Ferritin heavy chain; Sequence analysis; Tissue distribution; Prokaryotic expression
786
A
1000-3207(2014)01-0027-08
10.7541/2014.04
2012-10-08;
2012-11-22
陕西省科技攻关(2012K01-18); 西北农林科技大学基本科研业务费专项(QN2011062); 西北农林科技大学后稷学者支撑计划(Z11021007)资助
杨辉(1988—), 男, 河南南阳人; 研究生; 主要从事水产动物资源保护与利用。E-mail: victor1900@nwsuaf.edu.cn
王立新(1968—), 男, 副教授, 硕士研究生导师; E-mail: fisherwanglx@163.com
