初春马来眼子菜分解对水体和底泥碳、氮和磷积累及释放的影响
2014-04-09李法云范志平
王 博, 李法云, 范志平
(辽宁石油化工大学生态环境研究院, 辽宁 抚顺 113001)
沉水植物在湖泊水环境中具有特殊的生态功能,在污染水体的净化和湖泊富营养化的生物防治等方面有重要作用,还被广泛应用于生物修复工程和生态湿地的建设[1-2]。经过水生态修复后,沉水植物生物量逐渐恢复,但经过恢复的沉水植物衰亡分解会对水体产生较大的影响[3-4]。因此,国内外研究人员针对沉水植物分解已开展较多研究,主要研究方向为沉水植物分解释放动力学[5]和沉水植物衰亡分解对水体影响[6]2个方面。目前对沉水植物的分解过程及其释放对水体影响的系统性研究较少,对沉水植物分解过程中气体产生的研究报道也较少,并且大部分实验研究是在模拟冬季温度的条件下进行。而中国南部大部分水域的沉水植物在秋、冬寒冷季节开始衰亡,此时植物体分解较为缓慢,大量营养物质仍保留在植物残体中,至翌年初春回暖,植物体才开始迅速进行腐败分解,大量营养盐释放至水体中[7]。因此,了解初春沉水植物的分解特征及其影响效应,对水体生物修复及生态湿地建设具有重要意义。
作者采用分解袋法,在实验室条件下模拟初春温度条件,研究太湖原位沉水植物马来眼子菜(PotamogetonmalaianusMiq.)腐烂、分解过程中其自身和水体以及底泥中碳、氮和磷含量的变化状况;同时,水环境中的氮以氮气(N2)及温室气体氧化亚氮(N2O)的形式逸出,因此对马来眼子菜分解过程中水体中这2种气体的释放情况也进行了研究,以期为衰亡期沉水植物的精细化管理提供实验依据。
1 材料和方法
1.1 材料
供试马来眼子菜以及底泥于2010年9月末采自江苏太湖区域(北纬31°01′50″、东经120°20′18″),采样现场水生植物茂密,沉水植物、浮叶植物和挺水植物生物量均较大,底泥肥厚、水体清澈。
1.2 方法
1.2.1 处理及取样方法 实验前将新鲜马来眼子菜放入6 ℃冰箱中处理1周,以模拟沉水植物在衰亡分解时的状态,然后使用微米滤布(孔径20 μm)包裹植物体(便于实验期间将植物残体回收)。在5 L塑料圆桶内装入200 g底泥,将微米滤布包裹的25 g马来眼子菜置于底泥表面,然后加入4 L人工湖水。人工湖水的氮、磷含量参照沉水植物采集区域水体进行配制:硝态氮含量1 mg·L-1、铵态氮含量0.3 mg·L-1、总磷含量0.05 mg·L-1。空白组只放入底泥以及人工湖水,不放马来眼子菜。实验设3次重复。
实验在人工气候室内进行,设定实验温度17 ℃,光照时间12 h。实验采用破坏法进行取样,分别在实验的0、7、14、21、28、35、42、49、56、63和70 d从水桶中取水样,每次取3个桶进行采样,即为3次重复。分别测定水体溶解氧含量、氧化还原电位以及有机碳、总氮、总磷、铵态氮和硝态氮含量。同时,用不透气塑料薄膜盖住各取样桶,6 h后用针筒抽取空气,供N2和N2O释放通量的测定。
在实验初始(0 d)以及实验结束后(70 d)测定底泥中总磷、总氮和有机碳的含量。在实验初始称取新鲜马来眼子菜25 g,测定其干质量;在实验结束后测定马来眼子菜的剩余干质量以及有机碳、总氮和总磷的含量。实验均重复2次。
1.2.2 指标测定方法 水体中溶解氧含量采用YSI DO200型溶氧仪(美国YSI公司)测定,氧化还原电位采用SG-2型ORP仪(瑞士METTLER TOLEDO公司)测定,有机碳含量采用TOC-VCPH型总有机碳分析仪(日本岛津公司)测定,总氮含量采用碱性过硫酸钾消解法[8]255-257测定,总磷含量采用钼酸铵分光光度法[8]246-248测定,铵态氮含量采用纳氏试剂光度法[8]279-281测定,硝态氮含量采用紫外分光光度法[8]266-268测定。
底泥中有机碳含量采用重铬酸钾-硫酸消化法[9]102-104测定,总氮含量采用凯氏定氮法[9]156-158测定,总磷含量采用SMT法[9]189-190测定。
马来眼子菜干质量采用烘干法(105 ℃~110 ℃)测定,有机碳含量采用重铬酸钾-硫酸消化法测定,总氮含量采用凯氏定氮法测定,总磷含量采用氢氟酸-硫酸溶钼锑抗比色法测定[10]。
N2O释放通量采用Agilent 6890N型气相色谱仪(美国Agilent公司)测定;色谱条件:电子捕获检测器ECD,HP-PLOT Q分离柱,载气为高纯度N2,流速8 mL·min-1,分离柱工作温度50 ℃,检测器工作温度350 ℃[11]。N2释放通量采用HF-800型N2检测仪(济南航帆商贸有限公司)测定。
1.3 数据统计和处理
采用SPSS 18.0和Orgin 8.6统计分析软件进行数据分析和作图。采用单因素方差分析(One-way ANOVA)和LSD法进行方差分析和差异显著性检验(α=0.05)。
2 结果和分析
2.1 马来眼子菜分解过程中自身碳、氮和磷的释放量分析
实验结果表明:在70 d的实验周期内马来眼子菜分解率较高,至实验结束其失重率达86.92%。实验初始和结束时马来眼子菜的有机碳、总氮和总磷含量分别为205.35、57.15、2.06和190.33、28.36、2.14 mg·g-1,实验初始和结束时其体内有机碳量、总氮量和总磷量分别为328.55、91.45、3.29和37.74、10.12、0.44 mg。由此可见,在70 d的实验周期内马来眼子菜体内的碳、氮和磷大部分已矿化并释放,至实验结束时其体内的有机碳量、总氮量和总磷量较实验初始时分别减少了88.51%、88.93%和86.63%。
2.2 马来眼子菜分解过程中底泥有机碳、总氮和总磷含量的变化
测定结果表明:在实验初始时放入马来眼子菜的处理组中底泥的有机碳、总氮和总磷含量分别为15.841、1.231和0.506 mg·g-1;至实验结束时,其底泥中的有机碳、总氮和总磷含量分别为16.721、1.441和0.517 mg·g-1,分别较实验初始时增加了5.56%、17.06%和2.17%。
2.3 马来眼子菜分解过程中水体溶解氧含量和氧化还原电位的变化
马来眼子菜分解过程(70 d)中水体溶解氧含量和氧化还原电位的变化分别见图1-A和图1-B。由图1-A可知:因马来眼子菜分解导致处理组水体溶解氧含量在实验初期迅速下降,至第14天降至最低,随后逐渐上升;整个实验过程中处理组水体溶解氧含量均低于空白组,至实验结束时,空白组水体溶解氧含量为处理组的1.16倍。
由图1-B可见:马来眼子菜分解过程中水体氧化还原电位的动态变化趋势与溶解氧含量近似。在实验初期因马来眼子菜分解导致处理组水体氧化还原电位迅速降低,在第7天时降至最低,随后逐渐上升,第49天后波动变化但变化幅度较小。整个实验过程中处理组水体氧化还原电位均低于空白组。
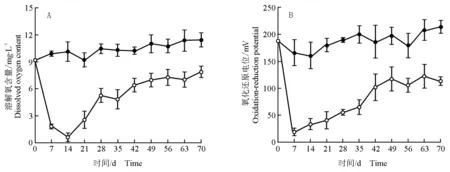
—●—: 对照 Control; —○—: 马来眼子菜Potamogeton malaianus Miq.
2.4 马来眼子菜分解过程中水体有机碳、总氮和总磷含量的变化
2.4.1 水体有机碳含量的变化 马来眼子菜分解过程(70 d)中水体有机碳含量的变化见图2。由图2可见:因马来眼子菜分解导致处理组水体有机碳含量在实验初期迅速上升并在第7天达到最大值,稳定一段时间后从第21天开始下降并从第49天开始处于稳定水平;而空白组水体有机碳含量则在实验前期略有升高且在整个实验过程中保持稳定。在整个实验过程中处理组水体有机碳含量均明显高于空白组。
2.4.2 水体总氮含量的变化 马来眼子菜分解过程(70 d)中水体总氮含量的变化见图3。由图3可见:因马来眼子菜分解导致处理组水体总氮含量在实验初期迅速上升并在第7天达到峰值,随后逐渐下降并于第63天后接近空白组的水平,整体变化幅度大。空白组水体总氮含量略有下降但变化幅度很小。在整个实验过程中处理组水体总氮含量均明显高于空白组。
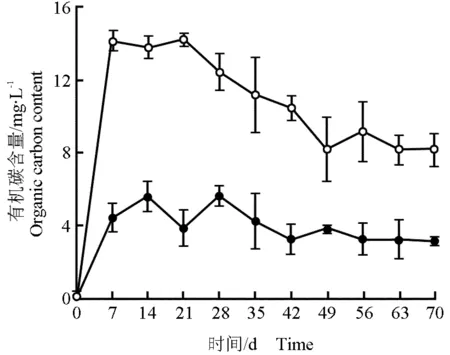
—●—: 对照 Control; —○—: 马来眼子菜Potamogeton malaianus Miq.
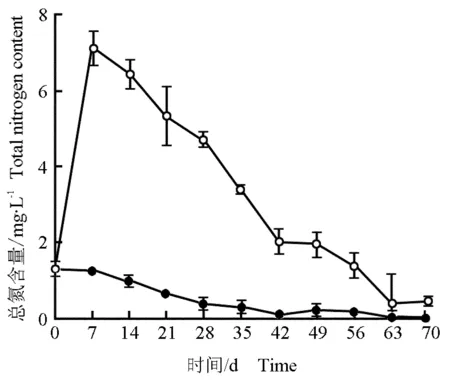
—●—: 对照 Control; —○—: 马来眼子菜Potamogeton malaianus Miq.
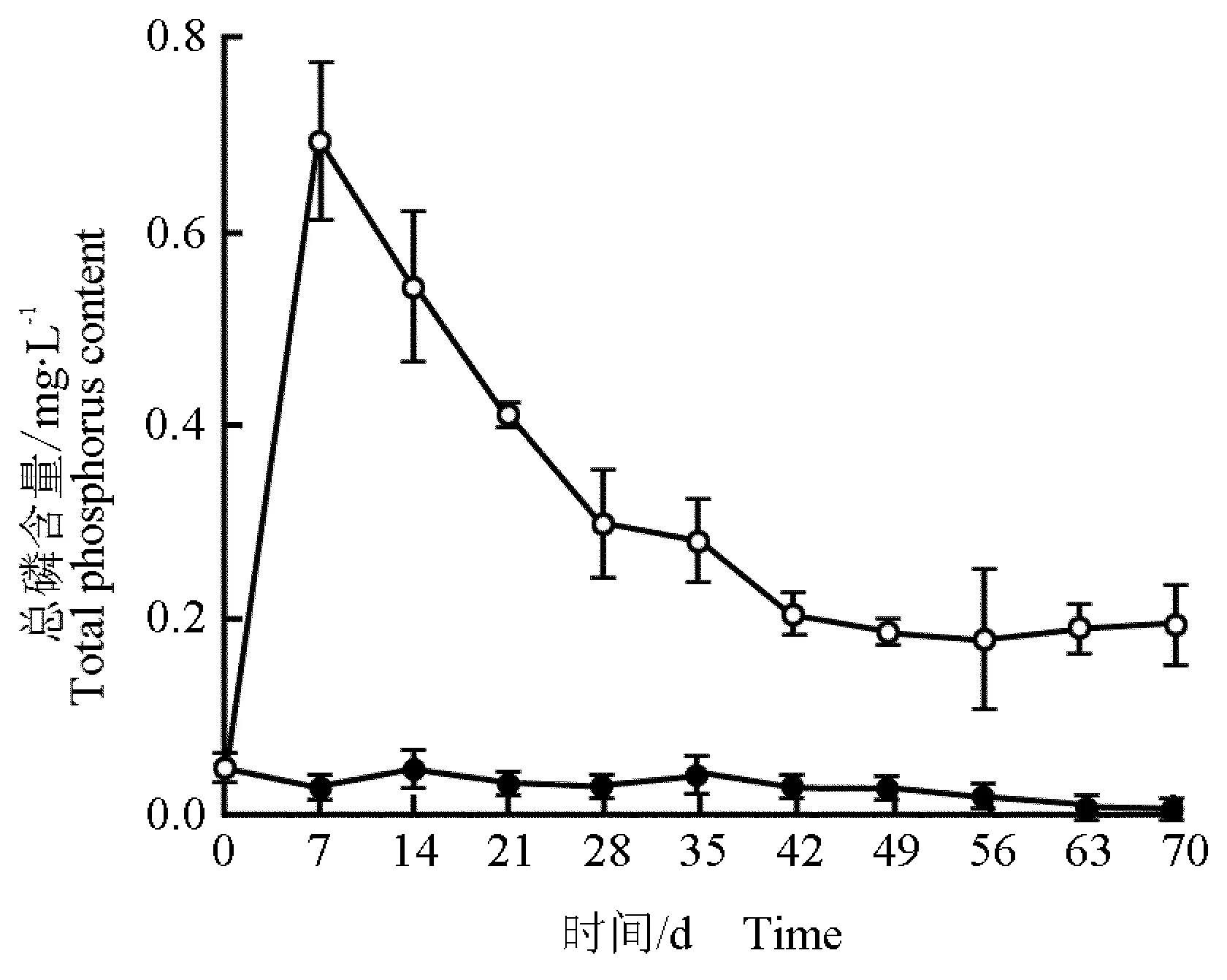
2.4.3 水体总磷含量的变化 马来眼子菜分解过程(70 d)中水体总磷含量的变化见图4。由图4可知:与水体总氮含量的变化趋势一致,马来眼子菜分解过程中处理组水体总磷含量在实验初期迅速升高并在在第7天达到峰值,随后逐渐下降并在实验后期(第49天以后)趋于稳定。而空白组水体总磷含量则无明显变化。在整个实验过程中处理组水体总磷含量均高于空白组,差异极显著(P<0.01),实验结束时处理组水体总磷含量为空白组的15.86倍。
2.5马来眼子菜分解过程中水体无机态氮含量的变化
马来眼子菜分解过程(70 d)中水体铵态氮和硝态氮含量的变化分别见图5-A和图5-B。由图5-A可见:马来眼子菜分解过程中处理组水体铵态氮含量的变化趋势与总磷和总氮含量的变化趋势相似,在实验初期铵态氮含量迅速升高并在第14天达到峰值,随后逐渐下降并于第42天后趋于稳定。空白组水体铵态氮含量在实验初期略有上升,之后逐渐下降,第21天后空白组水体中几乎不含铵态氮。在整个实验过程中处理组水体铵态氮含量均明显高于空白组。
—●—: 对照 Control; —○—: 马来眼子菜Potamogeton malaianus Miq.
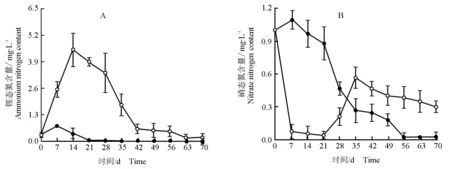
—●—: 对照 Control; —○—: 马来眼子菜Potamogeton malaianus Miq.
由图5-B可见:实验初期处理组水体硝态氮含量迅速下降并在第7天至第21天时维持在最低水平,在第21天至第35天持续上升,之后逐渐下降。空白组水体硝态氮含量在实验初期小幅上升并在第7天达到峰值,随后逐渐降低并在第56天后趋于稳定。整体上看,在实验初期至第28天,处理组硝态氮含量明显低于空白组,而在实验的第35天至实验结束,处理组的硝态氮含量明显高于空白组。
2.6 马来眼子菜分解过程中水体N2和N2O释放通量的变化
马来眼子菜分解过程(70 d)中水体N2和N2O释放通量的变化分别见图6-A和图6-B。
由图6-A可见:因马来眼子菜分解,在实验的0~28 d处理组水体N2释放通量逐渐上升,之后N2释放通量逐渐降低并在第56天达到最低值,随后仅小幅上升并趋于稳定,其中处理组第7天至第35天的N2释放通量明显大于其余各时间段。在整个实验过程中空白组水体N2释放通量均很低且变化幅度不大,且均明显低于处理组。
由图6-B可见:处理组水体N2O释放通量在实验前期逐渐上升并在第21天达到峰值,随后N2O释放通量降低,并在实验后期(第42 天后)趋于稳定。整个实验过程中空白组水体N2O释放通量均很低且变化幅度不大,且均明显低于处理组。
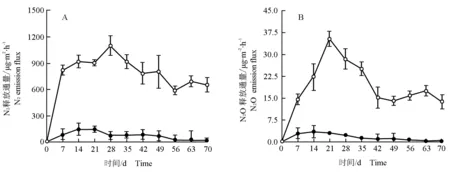
—●—: 对照 Control; —○—: 马来眼子菜Potamogeton malaianus Miq.
3.1 马来眼子菜分解及碳、氮和磷的释放机制分析
经过70 d的实验,至实验结束时马来眼子菜的最终失重率达到86.92%,这与沉水植物体内的碳、氮和磷含量水平密切相关。Wider等[12]以及Moore等[13]均指出,植物的化学组分直接影响其分解过程,低碳氮比有利于植物分解;但Chimney等[14]则认为,高氮含量以及低木质纤维含量有利于植物快速分解,分解速率较大程度上取决于碳、氮和磷含量。
Thomaz等[15]认为,木质素以及纤维素是沉水植物分解的重要指标,沉水植物的分解取决于植物体内难以腐烂的纤维素和木质素部分。大量研究结果[3,16]表明:沉水植物的分解率由其化学组成决定,木质素和纤维素含量较高则腐烂率较低,因而,狐尾藻(MyriophyllumverticillatumLinn.)等沉水植物的腐烂率较高,而苦草〔Vallisnerianatans(Lour.) H. Hara〕等沉水植物的腐烂率较低。木质素以及纤维素是植物体内碳的主要形态,马来眼子菜植株分解率较高,与其体内碳含量相对较低有关。
3.2 水环境中碳、氮和磷的迁移规律
在水体中,有机碳和总氮含量均呈先上升后下降的趋势;而在底泥中,有机碳和总氮的含量均有所增加,同时一部分氮以N2和N2O等形式逸出水体。说明碳和氮的流动是部分由水体向底泥、部分由水体向大气进行的。在本实验中,实验结束时马来眼子菜体内的碳进入底泥中的比例最高,而其体内的氮则是进入大气中的比例最高。
本研究中,水体中总磷含量的变化过程与有机碳和总氮近似,也经过了先上升后下降的过程,说明在水体生态系统中马来眼子菜、底泥和上覆水中总磷进行了再分配。马来眼子菜体内的总磷释放至水体中导致水体总磷含量升高,然后水体中的总磷随时间推移逐步迁移至底泥中,导致水体中总磷滞留量减少,至实验结束时水体和底泥中的总磷含量均较实验初始时有一定程度增加;并且由于底泥对水体总磷的吸附,导致实验结束时其分配比例更高,马来眼子菜体内的大部分总磷迁移至底泥中。前人的研究结果表明[17-18]:沉积物对上覆水中的磷有很强的积聚及吸附作用,磷在湖泊水环境系统中的循环是不完整的,是一个单向流动的过程,因此大多数磷均会因沉淀作用进入底泥而使得水体中磷含量降低。
3.3 水体氮形态的转化规律
本研究结果表明:水体铵态氮含量在实验初期迅速升高,之后缓慢下降;而硝态氮含量在实验初期迅速下降,在实验中期则逐渐上升并在实验后期趋于稳定。
在实验初期由于反硝化作用引起硝态氮含量下降,通过反硝化作用,将水环境中的氮素以N2和N2O等气体形态去除;而影响反硝化作用的主要因素是水体O2含量以及有机碳含量[19-20]。
在本实验中,因马来眼子菜分解导致水体中有机碳大量增加的同时也使水体形成低氧环境,促进水环境反硝化作用的进行,因此,实验初期水体硝态氮含量迅速下降;而在实验中期硝态氮含量逐渐上升是由于马来眼子菜分解过程的需氧量降低,导致水中溶解氧浓度上升、硝化作用增强、反硝化作用减弱,分解产生的铵态氮通过硝化作用转化成硝态氮引起水体硝态氮含量的上升。
3.4 马来眼子菜分解对水环境的影响
Jewell[21]认为,水体保留适量的沉水植物有助于促进底泥和水体中氮素的移出以及水系统中氮素负荷总量降低。这是因为反硝化作用是自然水体中氮去除的主要途径,在水生态系统中具有重要生态意义,因此,沉水植物的分解可促进水体的反硝化作用。同时,由于沉水植物衰亡分解阶段很长,因而对减缓水环境系统中营养物质的循环速率、控制“水环境营养负荷”和推迟淡水水体的富营养化进程具有一定的意义[5]。
但是,水体中滞留大量水生植物也易使水体缺氧并向水体释放大量营养物质,导致水体发黄发臭,有可能成为春季水华爆发的诱因[21]。另外,由于水体中沉水植物的分解使水体反硝化作用增强,促使N2O逸出水体,而N2O是除CH4和CO2之外的另一种重要的温室气体[22],对大气环境也有一定的影响。因此,用沉水植物可以改善水体水质并修复受损的水体环境,但须控制水体中沉水植物的种植量并适时收割,以避免水体中滞留的沉水植物在温度升高时分解,消除对水环境产生的负面效应。
3.5 结论
通过以上研究和分析可以得出以下结论:在70 d的实验周期内,在模拟初春温度条件下马来眼子菜分解率较高,导致其失重率达86.92%;其体内碳、氮和磷释放速率均较快且释放量较大,有机碳量、总氮量和总磷量较实验初期分别减少了88.51%、88.93%和86.63%。在马来眼子菜分解过程中水体中总氮和总磷含量均出现先上升后下降的变化过程,同时在实验中期出现N2和N2O的释放高峰。在初春的温度条件下因马来眼子菜分解向水体释放大量氮和磷,随时间推移水体中的磷大部分沉积到底泥中,而水体中的氮则部分沉积到底泥中、部分以气体形式逸出水体。马来眼子菜分解导致水体O2减少,并使大量有机碳释放进入水体,有助于促进水体中的反硝化作用并降低水体硝态氮含量。马来眼子菜分解期过多的植物残体将对水环境产生负面效应并释放较多的温室气体,因此必须控制分解期沉水植物在水环境中的残留量。
参考文献:
[1] 曹 昀, 胡 红, 时 强. 沉水植物恢复的透明度条件研究[J]. 安徽农业科学, 2012, 40(3): 1710-1711.
[2] 周 婕, 曾 诚. 水生植物对湖泊生态系统的影响[J]. 人民长江, 2008, 39(6): 88-91.
[3] PABST S, SCHEIFHACKEN N, HESSELSCHWERDT J, et al. Leaf litter degradation in the wave impact zone of a pre-alpine lake[J]. Hydrobiologia, 2008, 613: 117-131.
[5] 潘慧云, 徐小花, 高士祥. 沉水植物衰亡过程中营养盐的释放过程及规律[J]. 环境科学研究, 2008, 21(1): 64-68.
[6] 成小英, 王国祥, 濮培民, 等. 凤眼莲腐烂分解对湖泊水质的影响[J]. 中国环境科学, 2004, 24(3): 303-306.
[7] 李文朝, 陈开宁, 吴庆龙, 等. 东太湖水生植物生物质腐烂分解实验[J]. 湖泊科学, 2001, 13(4): 331-336.
[8] 国家环境保护总局《水和废水监测分析方法》编委会. 水和废水监测分析方法[M]. 4版. 北京: 中国环境科学出版社, 2002.
[9] 中国科学院土壤研究所. 土壤理化分析[M]. 上海: 上海科学技术出版社, 1978.
[10] 吕伟仙, 葛 滢, 吴建之, 等. 植物中硝态氮、氨态氮、总氮测定方法的比较研究[J]. 光谱学与光谱分析, 2004, 24(2): 204-206.
[11] 杨兰芳, 蔡祖聪. 施氮和玉米生长对土壤氧化亚氮排放的影响[J]. 应用生态学报, 2005, 16(1): 100-104.
[12] WIDER R K, LANG G E. A critique of the analytical methods used in examining decomposition data obtained from litter bags[J]. Ecology, 1982, 63: 1636-1642.
[13] MOORE T R, TROFYMOW J A, PRESCOTT C E, et al. Nature and nurture in the dynamics of C, N and P during litter decomposition in Canadian forests[J]. Plant and Soil, 2011, 339: 163-175.
[14] CHIMNEY M J, PIETRO K C. Decomposition of macrophyte litter in a subtropical constructed wetland in south Florida (USA)[J]. Ecological Engineering, 2006, 27: 301-321.
[15] THOMAZ S M, BINI L M, BOZELLI R L, et al. Floods increase similarity among aquatic habitats in river-floodplain systems[J]. Hydrobiologia, 2007, 579: 1-13.
[16] CHABBI A, RUMPEL C. Decomposition of plant tissue submerged in an extremely acidic mining lake sediment: phenolic CuO-oxidation products and solid-state13C NMR spectroscopy[J]. Soil Biology and Biochemistry, 2004, 36: 1161-1169.
[17] ROYER T V, MONAGHAN M T, MINSHALL G W. Processing of native and exotic leaf litter in two Idaho (U.S.A.) streams[J]. Hydrobiologia, 1999, 400: 123-128.
[18] 张 智, 刘亚丽, 段秀举. 湖泊底泥磷释放影响因素显著性试验分析[J]. 植物资源与环境学报, 2006, 15(2): 16-19.
[19] 傅利剑, 郭丹钊, 史春龙, 等. 碳源及碳氮比对异养反硝化微生物异养反硝化作用的影响[J]. 农村生态环境, 2005, 21(2): 42-45.
[20] 廖晓数, 贺 锋, 徐 栋, 等. 低C/N对湿地中硝化反硝化作用的影响[J]. 中国环境科学, 2008, 28(7): 603-607.
[21] JEWELL W J. Aquatic weed decay: dissolved oxygen utilization and nitrogen and phosphorus regeneration[J]. Journal of Water Pollution Control Federation, 1971, 43: 1457-1467.
[22] 孙 丽, 宋长春, 黄 耀. 沼泽湿地N2O通量特征及N2O与CO2排放间的关系[J]. 中国环境科学, 2006, 26(5): 532-536.
