田菁茎瘤固氮根瘤菌在小麦体内的定殖及营养元素相关miRNA的表达
2014-04-08刘华伟王渭玲
李 强, 刘华伟, 王渭玲
(西北农林科技大学生命科学学院, 陕西杨凌 712100)
近年来,化肥的不合理施用不仅造成了土壤生产力的衰退,而且引发的农业生态环境问题日益严重,因而探寻新型肥料(尤其是生物肥料)以替代或部分替代化肥的研究倍受关注[1]。如果小麦等非豆科作物能够实现生物固氮,不仅能够提高产量,而且可以减少化肥的使用、 保护环境,建立生态平衡,实现农业的可持续发展[2]。
植物根际促生菌(PGPR,Plant Growth-promoting Rhizobacteria)是指定殖于植物根际系统并能促进植物生长的一类细菌[3]。PGPR可以通过产生植物激素(IAA,GA等),促进根部生长增加根表面积,增加植物幼苗的活力[4-5], 提高植物对土壤中氮素的利用率[4]和对矿质元素的吸收能力[6],促进可溶磷盐的吸收[7]和根呼吸作用[8],从而促进植物的生长。
田菁茎瘤固氮根瘤菌AzorhizobiumcaulinodansORS 571(A.caulinodans)属于固氮根瘤菌属,在其天然寄主豆科植物田菁(Sesbaniarostrata)的根部和茎部结瘤固氮,共生固氮效率较高,对氧的要求低于其他根瘤菌,已成为研究非豆科作物生物固氮的模式菌之一,在农业领域表现出极大的应用潜力[11]。本研究在室内限菌条件下利用绿色荧光蛋白(GFP)标记的A.caulinodans侵染小麦种子,利用激光共聚焦显微镜检测 GFP-A.caulinodans在小麦根中的定殖规律。利用实时定量PCR研究A.caulinodans侵染后小麦幼苗根中与营养元素有关的 miRNA 的表达变化,为深入研究A.caulinodans对小麦的促生机制,更好地将其应用于农业生产提供依据。
1 材料与方法
1.1 材料
1.1.1 小麦品种与菌株 小麦品种小偃22由西北农林科技大学农学院赵继新博士提供。GFP标记A.caulinodans(GFP-A.caulinodans)由中国科学院植物研究所荆玉祥研究员馈赠。
1.1.2 培养基与培养条件 TY液体培养基: 胰蛋白胨5 g/L、酵母粉3 g/L、 CaCl2·2H2O 0.88 g/L、pH 7.4,120℃灭菌20 min,用于A.caulinodans的活化和扩培。PBS液体缓冲液: KH2PO40.24 g/L,KCl 0.2 g/L,NaCl 8 g/L,Na2HPO41.44 g/L, pH 7.4,120℃灭菌20 min,用于A.caulinodans菌液稀释。琼脂粉-水固体培养基: 1 L水加琼脂粉5 g,120℃灭菌20 min,用于小麦种子预培养。1/2 Hoagland培养基[12]: 清洗石英砂,放在烘箱中180℃烘4h,冷却后分装至1L的三角瓶中,每瓶加400 mL石英砂,然后再向每瓶石英砂中加50 mL的1/2 Hoagland培养基,120℃灭菌20 min,模仿大田土壤结构,用于小麦种子的接菌培养。
1.2 方法
1.2.1 种子处理及培养 选取饱满、 均匀一致的小麦种子,用75%酒精浸泡30 s,无菌水冲洗3次,进行表面消毒; 再用1%次氯酸钠浸泡10 min,无菌水冲洗3次。参照Senthilkumar方法将表面消毒的小麦种子均匀置于大三角瓶中已事先灭菌的琼脂粉-水固体培养基上,种沟朝下,胚朝向同一个方向[13]。培养条件: 光照16 h,光强4级,温度25℃,相对湿度46%; 黑暗 8 h,光强0级,温度18℃,相对湿度37%。


1.2.4 根系总RNA的提取及miRNA的反转录 先采集0 h的小麦幼根,然后在无菌条件下向处理组中均匀加入20 mL PBS稀释GFP-A.caulinodans菌液,同时向对照组中均匀加入等量的PBS缓冲液。用透明膜封住瓶口,放入光照培养箱培养。分别在6 h、 12 h、 24 h、 48 h、 72 h、 96 h等不同时间点取样,每个样品做3个重复,平行对照组同步进行,样品迅速冷冻于液氮中,-80℃保存。
根系总RNA采用Trizol(Invitrogen)提取。提取总RNA后使用One Step PrimeScript® miRNA cDNA Synthesis Kit(宝生物工程有限公司,大连)试剂盒, 包括小RNA3’加polyA和利用带有接头的oligo dT进行反转录2个过程。反应体系为20 μL,包括3 μL总RNA、 10 μL 2×miRNA Reaction Buffer Mix、 2 μL 0.1%BSA和2μL miRNA PrimeScript RT Enzyme Mix。反应条件为37℃ 1 h,然后85℃ 5 s。将反转录产物保存于-20℃。
1.2.5 实时定量RT-PCR 使用SYBR® Premix Ex TaqTMⅡ(宝生物工程有限公司,大连)试剂盒在CFX96 Real-Time System(BIO-RAD,USA)仪器上进行实时定量RT-PCR,使用β-tubulin作为内参基因,所用每条miRNA的正向引物和通用反向引物由上海生工公司合成(表1)。反应体系为25 μL,包括1 μL cDNA、 1 μL(10 μmol/L)miRNA上游引物、 1 μL(10 μmol/L)miRNA反向引物、 12.5 μL SYBR Premix Ex Taq和9.5 μL dH2O。反应条件为: 95℃ 30 s, 95℃ 5 s,60℃ 30 s,40循环。将PCR产物的温度从45℃上升到95℃,每升高0.5℃测定1次荧光值,最后由仪器生成溶解曲线,根据溶解曲线可验证PCR反应产物的单一性。每个样品设置3个重复,每次反应均设置1个无模板对照。实时定量的miRNA表达量采用相对定量法,即2-ΔΔCT法进行处理[14]。

表1 实时定量RT-PCR所用引物序列
1.2.6 miRNA靶基因预测 植物miRNA与靶基因高度互补,便于预测靶基因。使用psRNATarget 在线软件(http: //plantgrn.noble.org/psRNATarget/)进行预测。
2 结果与分析
2.1 激光共聚焦显微镜检测GFP-A.caulinodans在小麦幼苗组织中的定殖
为了检测GFP-A.caulinodans在小麦根中的定殖情况,利用激光共聚焦显微镜对GFP-A.caulinodans侵染的小麦幼苗根进行扫描,结果显示GFP-A.caulinodans可定殖于根的表皮细胞和细胞间隙(图1A、 B),在根尖的破损处和根毛部位也发现了GFP-A.caulinodans(图1C、 D)。对根进行横切,在根的维管组织和细胞间隙等部位发现了GFP-A.caulinodans(图1E)。
利用激光共聚焦显微镜对小麦幼苗叶片进行扫描,结果显示定殖于小麦根中的GFP-A.caulinodans可向上迁移至小麦叶片,在气孔定殖(图1F)。
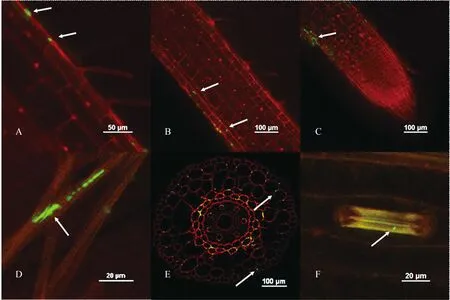
图1 激光共聚焦显微镜检测GFP-A.caulinodans 在小麦体内的定殖Fig.1 Colonization of GFP-A.caulinodans in wheat seedings via confocal laser scanning microscopy
2.2 根中营养元素相关miRNA的表达
实时定量RT-PCR(图2)分析结果表明,所选取的6条与营养元素代谢有关的miRNA相对表达量均发生了变化,其中miR164、 miR167和miR827相对表达量呈现出先上调后下调的趋势,miR169 和miR398相对表达量也基本呈现出这一趋势。miR164、 miR167、 miR169和miR398的相对表达量在接菌12 h时上调至最高点,分别为对照的4.13倍、 2.84倍、 2.46倍和3.99倍; miR827相对表达量在接菌24 h时上调至最高点,为对照的2.17倍。miR399相对表达量呈现出先下调后上调的趋势,在接菌24 h时相对表达量下调至最低点,为对照的0.21倍。
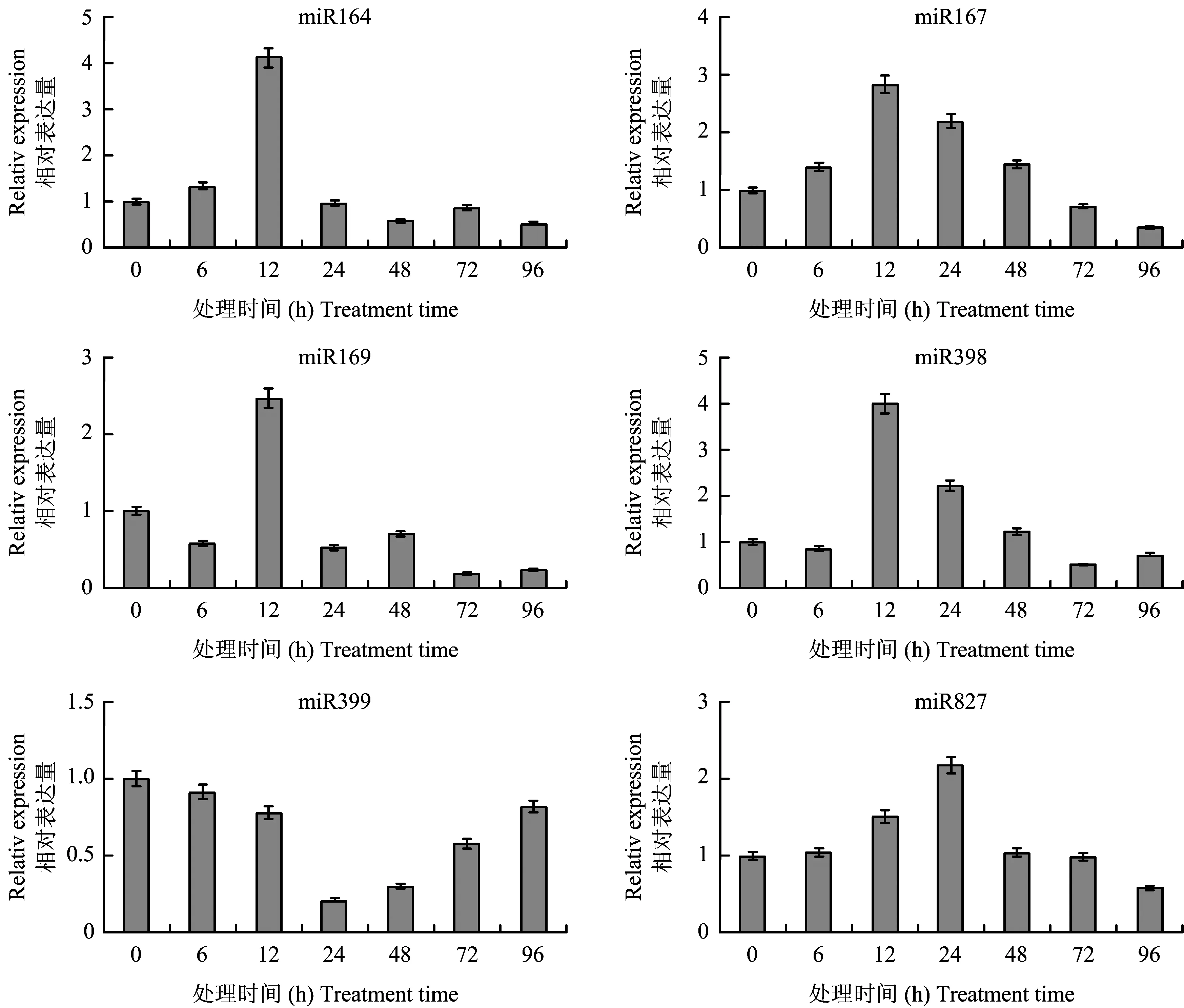
图2 GFP-A.caulinodans侵染小麦后根中营养元素相关miRNA的表达变化Fig.2 Nutrient-related miRNAs Expression of wheat roots after noculation of GFP-A.caulinodans
2.3 小麦根中6条miRNAs的靶基因预测
利用psRNATarget 在线软件对miRNAs进行靶基因预测(表2),在小麦现有的EST序列信息中没有找到miR167、 miR399和miR827的靶基因,但在水稻基因组中可以预测到其靶基因,分别编码生长素应答因子(ARF)、 蛋白缀合酶PHO2和SPX-MFS(Major Facility Superfamily)亚家族蛋白。在小麦中预测到miRNA的靶基因,其中miR164的靶基因编码的是调节生长素信号通路的转录因子NAC1,miR169的靶基因是可与CCAAT框结合并控制基因表达的转录因子HAP,miR398的靶基因是Cu/Zn 超氧化物歧化酶(Cu/Zn-superoxide dismutase, CSD)。
3 讨论
3.1 A.caulinodans在小麦幼苗中的定殖与迁移
根瘤菌可以和多种宿主植物通过联合作用对植物产生有益影响,不仅可以通过经典的豆科根瘤共生,还可以通过内生菌的形式与谷类植物产生有益的联合作用。迟峰等[15]研究表明,多种根瘤菌不仅可以通过“裂隙进入”的方式侵入到水稻的根内定殖,而且可以以动态的过程从植物内部上升迁移至鞘和叶。刘华伟等[16]研究了巴西固氮螺菌(azospirillum brasilense)在小麦体内的定殖规律及其促生作用。
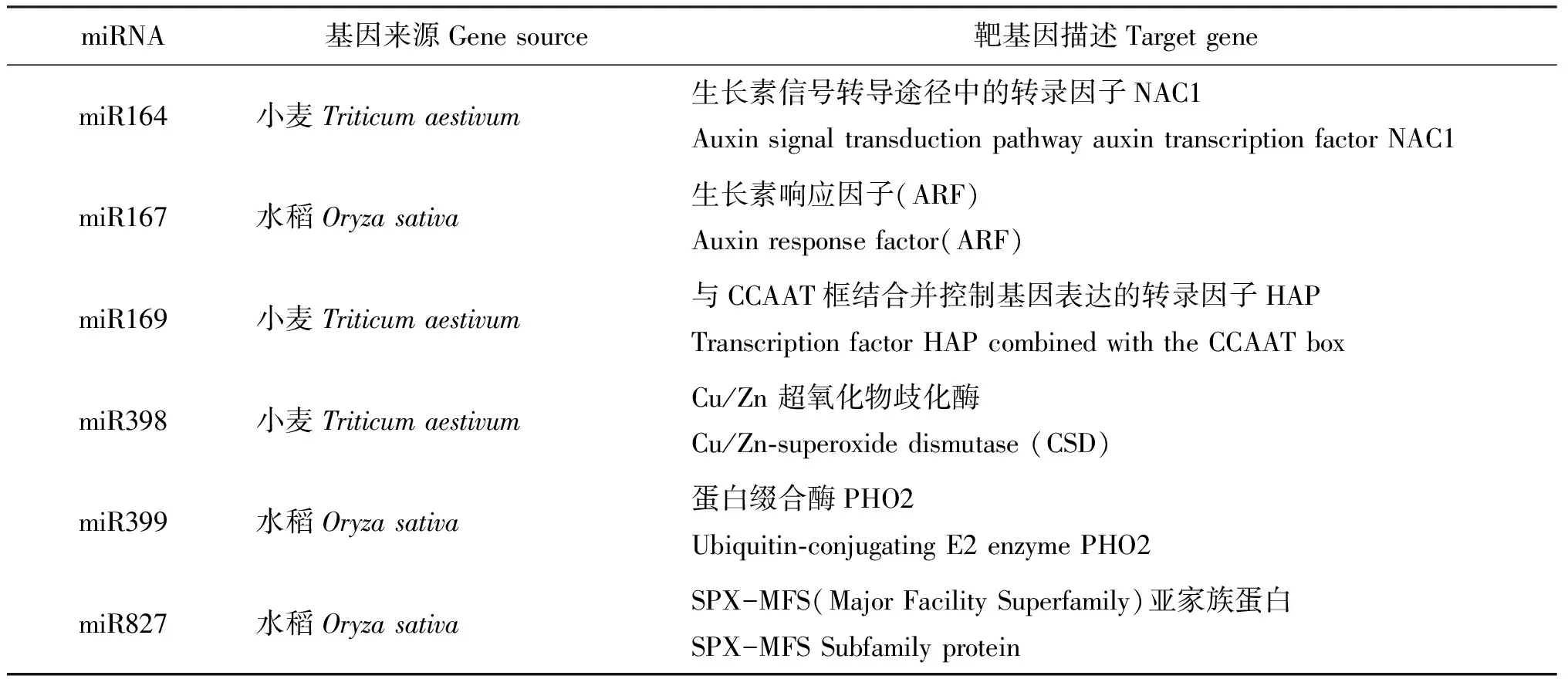
表2 6条miRNAs的靶基因预测
本研究利用激光共聚焦显微镜检测发现,小麦幼苗根与根际环境在与PGPR的互作中发挥关键作用。A.caulinodans可通过侧根表面、 根尖破损处和根毛等部位侵入小麦根部,进入根维管束组织,并可以向上迁移至叶片,通过气孔从小麦叶内迁移到叶表。本研究结果与Chi等[15]研究固氮菌在水稻、 烟草等非豆科作物中的分布定殖与迁移规律一致。
3.2 响应营养元素的miRNAs表达分析
近年来研究发现,miRNA在植物生长、 发育、 逆境胁迫等各种生物学过程中起重要的调控作用。植物中miRNA的鉴定和功能研究已成为生命科学领域的研究热点之一。
3.2.1 响应氮素的miRNAs表达分析 氮是植物三大营养元素之一,对植物生长发育具有重要作用。近年的研究表明miRNA参与了氮素的响应。
Meng等[17]研究表明,拟南芥中miRNA164和miRNA167与氮信号相关。本研究中,miR164表达量略微下调后上调,然后下调。通过靶基因预测表明miR164作用于NAC1基因,miR164在接菌12 h后下调,可推测靶基因NAC1表达上调,从而使侧根数量增加,促进对氮的吸收[18]。
miR167能够抑制靶基因ARF8(auxin response factor 8)的表达[19],ARF8能够参与生长素信号通路调控,促进侧根的生长[20]。本研究中,miR167表达量在接菌12 h达到最大,之后表达量下调,miR167在接菌96 h的相对表达量只有对照的0.35倍,说明此时氮素供应不足,可以推测ARF8大量表达,刺激侧根的起始和出现,促进根的形态建成,增强了对土壤中氮素的吸收和固定[21-22]。本试验室之前的研究也支持这一推测[23]。
Pant等[24]利用实时定量PCR方法研究了拟南芥营养元素响应的miRNA,发现氮素不足抑制miR169和miR398的表达。同时,在正常供氮的植株韧皮部汁液中检测到miR169,认为miR169可能是氮代谢中的长距离信号分子。本研究中,miR169在接菌12 h后相对表达量显著降低,在72 h相对表达量仅为对照的0.18倍,miR169表达水平的显著降低会导致靶基因HAP的表达,促进侧根形成和氮素的吸收。这与miR169在豆科植物根瘤发育过程中起重要作用的研究结果一致[25]。
拟南芥中miR398能够抑制COX(cytochrome coxidase)基因的表达[26],COX能够有效地促进根部细胞的呼吸作用,形成大量的ATP[27]。本研究中miR398在接菌12 h后表达量下调,在接菌72 h时显著降低,说明此时氮素供应不足,miR398的表达受到抑制。可以推测COX能够大量表达,参与一系列氧化还原反应,生成的ATP可以为植物根部主动运输过程提供充足的能量,从土壤中吸收氮素等必需的营养元素。
3.2.2 响应磷素的miRNAs表达分析 土壤有效磷缺乏是一个世界性问题,已成为许多地区作物生长的限制因素。目前大量研究对低磷胁迫诱导基因包括miRNA表达和调控在一定程度上揭示了miRNA低磷响应机制,但其详细调控机制仍不明确。
拟南芥miR399能够对低磷胁迫发生响应并保持体内磷素稳定平衡[28]。拟南芥基因组中分布有6个miR399基因,均受低磷胁迫诱导。研究表明,无机磷转运子(Pi transporter)和泛素结合酶(UBC24)[29]两个基因家族为miR399的靶基因,共同调节植物体内磷素平衡。低磷酸盐水平强烈诱导miR399表达,其靶mRNA丰度下降首先在根部出现[30]。miR399通过与UBC24 mRNA的5’-UTR结合下调其表达,同时UBC24 mRNA的5’-UTR区已被证实与植物缺磷响应有关。本研究中miR399在接菌24 h后表达量显著下调然后上调,miR399表达量增加致使靶基因UBC表达下调,可以缓解被抑制的无机磷吸收和转运,增加植物对无机磷的吸收以应对磷素缺乏。此结果与miR399参与体内磷素平衡模型相一致[30-31],从miRNA角度揭示了文献报道A.caulinodans作为根际促生菌促进可溶磷盐的吸收和转运的分子机制。
除了miR399以外,拟南芥中还有几种磷响应的miRNA, 如miR778、 miR827和miR2111。其中miR778、 miR827和miR2111在低磷环境中上调表达[24]。 水稻的根和叶中miR827受低磷胁迫强烈诱导[32],miR827的靶基因OsSPX-MFS1则表达量下调。本研究中,miR827的表达量在接菌24 h时达到最大值,推测靶基因SPX-MFS表达受到抑制,以增强小麦幼苗对磷的吸收和转运,具体机制有待进一步试验验证。
3.2.3 响应微量元素的miRNAs表达分析 miRNA不仅响应氮、 磷等大量元素,也会响应一些微量元素含量变化并调节相应生理活动。研究发现,拟南芥中缺铜会抑制Cu/Zn超氧化物歧化酶(Cu/Zn-superoxide dismutase,CSD)的表达,其在叶绿体中的作用被Fe超氧化物歧化酶(Fe-superoxide dismutase)代替,miR398在该过程中发挥重要作用[33]。本研究中,miR398在接菌12 h表达量上调至最高值,说明此时可能铜素不足,Cu/Zn-CSD的表达下调,表明通过miRNA的作用,可以下调植物体内非必需铜蛋白表达,减少铜素消耗,从而在缺铜条件下保证植物体正常生理活动必需铜素的供应。
4 结论
1)A.caulinodans可从根部侵染小麦,定殖于根的表皮、 皮层、 维管系统的细胞间隙和细胞内,并可以向上迁移到达叶片。
2)接种A.caulinodans使小麦根中响应氮素、 磷素、 微量元素的miRNAs相对表达量发生变化。miR164、 miR167和miR827相对表达量呈现先上调后下调的趋势, miR169 和miR398相对表达量也基本呈现这一趋势, miR399相对表达量呈现先下调后上调的趋势。
3) 6条miRNA预测得到的靶基因参与生长素信号转导、 无机磷转运等生理过程,推测通过miRNA的作用,A.caulinodans可促进小麦根的形态建成,增强小麦幼苗对营养元素的吸收和利用。
参考文献:
[1] 赵秉强, 张福锁, 廖宗文, 等. 我国新型肥料发展战略研究[J]. 植物营养与肥料学报, 2004, 10(5): 536-545.
Zhao B Q, Zhang F S, Liao Z Wetal. Research on development strategies of fertilizer in China[J]. Plant Nutrition and Fertilizer Science, 2004, 10(5); 536-545.
[2] 沈世华, 荆玉祥. 中国生物固氮研究现状和展望[J]. 科学通报, 2003, 48(6): 535-540.
Shen S H, Jing Y X. Present and prospect of biological nitrogen-fixing in China[J]. Chinese Science Bulletin, 2003, 48(6): 535-540.
[3] Kloepper J W, Leong J, Teintze Metal. Enhanced plant growth by siderophores produced by plant growth-promoting rhizobacteria[J]. Nature, 1980, 286(5776): 885-886.
[4] Yanni Y G, Rizk R Y, El-Fattah F K Aetal. The beneficial plant growth-promoting association ofRhizobiumleguminosarumbv. trifolii with rice roots[J]. Functional Plant Biology, 2001, 28(9): 845-870.
[5] Biswas J C, Ladha J K, Dazzo F Betal. Rhizobial inoculation influences seedling vigor and yield of rice[J]. Agronomy Journal, 2000, 92(5): 880-886.
[6] Biswas J C, Ladha J K, Dazzo F B. Rhizobia inoculation improves nutrient uptake and growth of lowland rice[J]. Soil Science Society of America Journal, 2000, 64(5): 1644—1650.
[7] Peix A, Mateos P F, Rodriguez-Barrueco Cetal. Growth promotion of common bean (PhaseolusvulgarisL.) by a strain of Burkholderia cepacia under growth chamber conditions[J]. Soil Biology and Biochemistry, 2001, 33(14): 1927-1935.
[8] Phillips D A, Joseph C M, Yang G Petal. Identification of lumichrome as a Sinorhizobium enhancer of alfalfa root respiration and shoot growth[J]. Proceedings of the National Academy of Sciences, 1999, 96(22): 12275-12280.
[9] Bartel D P. MicroRNAs: genomics, biogenesis, mechanism, and function[J]. Cell, 2004, 116(2): 281-297.
[10] 许振华, 谢传晓. 植物 microRNA 与逆境响应研究进展[J]. 遗传, 2010, 32(10): 1018-1030.
Xu Z H, Xie C X. Advances in plant microRNA and stresses response[J]. Hereditas, 2010, 32 (10): 1018-1030.
[11] 陈廷伟, Scherer S, Peter B. 固氮根瘤菌 (Azorhizoboium) 在人工诱发小麦类根瘤中的固氮作用[J]. 中国科学B辑, 1992, 22(7): 712-716.
Chen T W, Scherer S, Peter B. Nitrogen fixation of azorhizobium in artificially induced root para-nodules in wheat[J]. Science China B, 1992, 22(7): 712-716.
[12] 迟峰. 根瘤菌在植物内的迁移运动及其与植物相互作用的蛋白质组学研究[D]. 北京: 中国科学院研究生院博士学位论文, 2006.
Chi F. Migration of rhizobia in plants and proteome analysis of their interaction[D]. Beijing: PhD dissertation, Institute of Botany, Chinese Academy of Sciences, 2006.
[13] Senthilkumar M, Madhaiyan M, Sundaram S Petal. Induction of endophytic colonization in rice (OryzasativaL.) tissue culture plants by azorhizobium caulinodans[J]. Biotechnology Letters, 2008, 30(8): 1477-1487.
[14] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2?ΔΔCTmethod[J]. Methods, 2001, 25(4): 402-408.
[15] Chi F, Shen S H, Cheng H Petal. Ascending migration of endophytic rhizobia, from roots to leaves, inside rice plants and assessment of benefits to rice growth physiology[J]. Applied and Environmental Microbiology, 2005, 71(11): 7271-7278.
[16] 刘华伟, 王庆贺, 张宏, 等. 巴西固氮螺菌Yu62的EGFP标记及其在小麦体内的定殖研究[J]. 西北植物学报, 2009, 29(12): 2367-2372.
Liu H W, Wang Q H, Zhang Hetal. Colonization ofAzospirillumbrasilenseYu62 in wheat via EGFP[J]. Acta Botanica Boreali-Occidentalia Sinica, 2009, 29(12): 2367-2372.
[17] Meng Y, Ma X, Chen Detal. MicroRNA-mediated signaling involved in plant root development[J]. Biochemical and Biophysical Research Communications, 2010, 393(3): 345-349.
[18] Kim J H, Woo H R, Kim Jetal. Trifurcate feed-forward regulation of age-dependent cell death involving miR164 in Arabidopsis[J]. Science, 2009, 323(5917): 1053-1057.
[19] Wu M F, Tian Q, Reed J W. Arabidopsis microRNA167 controls patterns of ARF6 and ARF8 expression, and regulates both female and male reproduction[J]. Development, 2006, 133(21): 4211-4218.
[20] Zhou X, Wang G, Zhang W. UV-B responsive microRNA genes in arabidopsis thaliana[J]. Molecular Systems Biology, 2007, 3(1): 1-10.
[21] Gifford M L, Dean A, Gutierrez R Aetal. Cell-specific nitrogen responses mediate developmental plasticity[J]. Proceedings of the National Academy of Sciences, 2008, 105(2): 803-808.
[22] Xu Z, Zhong S, Li Xetal. Genome-wide identification of microRNAs in response to low nitrate availability in maize leaves and roots[J]. PloS one, 2011. Doi: 10.1371/journal.pone.0028009
[23] 刘华伟, 孙超, 杨呼, 等. 田菁茎瘤固氮根瘤菌对小麦种子侵染的促生作用及其在根系内的定殖[J]. 植物营养与肥料学报, 2012, 18(1): 210-217.
Liu H W, Sun C, Yang Hetal. Promotion for wheat growth and root colonization after infecting wheat seeds withAzorhizobiumcaulinodans[J]. Plant Nutrition and Fertilizer Science, 2012, 18(1): 210-217.
[24] Pant B D, Musialak-Lange M, Nuc Petal. Identification of nutrient-responsive Arabidopsis and rapeseed microRNAs by comprehensive real-time polymerase chain reaction profiling and small RNA sequencing[J]. Plant Physiology, 2009, 150(3): 1541-1555.
[25] Combier J P, Frugier F, de Billy Fetal. MtHAP2-1 is a key transcriptional regulator of symbiotic nodule development regulated by microRNA169 in Medicago truncatula[J]. Genes & development, 2006, 20(22): 3084-3088.
[26] Bonnet E, Wuyts J, Rouzé Petal. Detection of 91 potential conserved plant microRNAs in arabidopsis thaliana and Oryza sativa identifies important target genes[J]. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(31): 11511-11516.
[27] Millar A H, Atkin O K, Menz R Ietal. Analysis of respiratory chain regulation in roots of soybean seedlings[J]. Plant Physiology, 1998, 117(3): 1083-1093.
[28] Pant B D, Buhtz A, Kehr Jetal. MicroRNA399 is a long-distance signal for the regulation of plant phosphate homeostasis[J]. The Plant Journal, 2008, 53(5): 731-738.
[29] Jones-Rhoades M W, Bartel D P. Computational identification of plant microRNAs and their targets, including a stress-induced miRNA[J]. Molecular Cell, 2004, 14(6): 787-799.
[30] Chiou T J, Aung K, Lin S Ietal. Regulation of phosphate homeostasis by microRNA in arabidopsis[J]. The Plant Cell Online, 2006, 18(2): 412-421.
[31] Chiou T J. The role of microRNAs in sensing nutrient stress[J]. Plant, Cell & Environment, 2007, 30(3): 323-332.
[32] Lin S I, Santi C, Jobet Eetal. Complex regulation of two target genes encoding SPX-MFS proteins by rice miR827 in response to phosphate starvation[J]. Plant and Cell Physiology, 2010, 51(12): 2119-2131.
[33] Yamasaki H, Abdel-Ghany S E, Cohu C Metal. Regulation of copper homeostasis by micro-RNA in arabidopsis[J]. Journal of Biological Chemistry, 2007, 282(22): 16369-16378.
