双季稻田添加脲酶抑制剂NBPT氮肥的最高减量潜力研究
2014-04-08张文学梁国庆余喜初刘光荣
张文学, 孙 刚, 何 萍, 梁国庆, 余喜初, 刘光荣, 周 卫*
(1 中国农业科学院农业资源与农业区划研究所, 农业部植物营养与肥料重点开放实验室, 北京 100081; 2 江西省农业科学院土壤肥料与资源环境研究所,江西南昌 330200; 3 江西省红壤研究所, 江西南昌 331717)


经过大量的田间试验验证[4],包括在热带的淹水稻田[6,11],NBPT可以有效地提高作物产量[12-14]以及氮肥利用率[13,15],但关于脲酶抑制剂对我国稻田氮素转化影响的研究较少,本文研究尿素添加脲酶抑制剂(NBPT)对我国双季稻田的无机氮含量、 酶活性、 微生物量碳、 氮含量以及氮素回收率等的影响,确定早稻与晚稻添加脲酶抑制剂时的适宜施氮量,为稻田减少氮素损失、 提高氮肥利用率提供科学依据,为稻田施肥提供技术指导。
1 材料与方法
1.1 试验地概况

1.2 试验设计
水稻供试品种: 早稻为德农88,晚稻为汕优456; 脲酶抑制剂为NBPT; 供试肥料品种: 氮肥为尿素(含N 46%),磷肥为钙镁磷肥(含P2O512%),钾肥为氯化钾(含K2O 60%)。

在水稻分蘖期、 孕穗期分别采集各小区耕层土壤样品,测定脲酶与硝酸还原酶活性、 铵态氮与硝态氮含量、 微生物量碳、 氮含量; 用于测定酶活性、 无机氮的土样若不能立即测定需保存于-20℃,用于测定微生物量碳、 氮含量的土样则保存于4℃; 成熟期测定各小区产量以及植株氮含量。
1.3 测定方法与计算

1.3.2 土壤中铵态氮与硝态氮含量的测定 土壤中的铵态氮与硝态氮含量用1 mol/L的KCl溶液浸提,采用SmartchemTM200 discrete chemistry analyzer (West-Co Scientific Instruments, Brookfiel, CT, USA) 仪器测定。
1.3.3 微生物量碳、 氮含量测定与计算 土壤微生物量碳、 氮含量的测定采用氯仿熏蒸—K2SO4浸提法[18-21], 其含量计算如下:
BC=EC/KC
BN=EN/KN
其中,BC、 BN分别为土壤微生物量碳、 氮含量; EC、 EN分别为熏蒸和未熏蒸样品中有机碳、 全氮含量之差; KC、 KN为回收系数,KC=0.45[19-20], KN=0.54[21]。
1.3.4 植株氮素含量的测定 取植株粉碎样,用浓H2SO4-H2O2消化,用SmartchemTM200 discrete chemistry analyzer (West-Co Scientific Instruments, Brookfiel, CT, USA) 仪器测定。
1.3.5 数据处理 所有数据采用Excel 2007、 SAS 9.1软件进行统计分析,运用Excel 2007软件作图。
2 结果与分析
2.1 不同处理对水稻产量的影响
由图1可知,各处理对水稻产量的影响显著(P<0.05)。对于早、 晚稻,处理U3+UI的产量最高,且与处理U5的差异显著,说明与传统施氮(单施尿素N 180 kg/hm2)相比,施用尿素添加脲酶抑制剂NBPT时,施氮量为N 135 kg/hm2可显著提高水稻产量,早、 晚稻分别提高8.54%和12.87%; 此处理不仅增产显著,而且减少氮肥(N)用量45 kg/hm2,即节约氮肥25%。在晚稻产量中,处理U3+UI、 U4+UI显著高于处理U5+UI的,在田间观察到U5+UI处理的植株贪青晚熟,可能是其产量下降的主要原因。

图1 不同处理水稻产量 Fig.1 Yield of rice under different treatments
2.2 不同处理对水稻氮素回收率的影响


图2 水稻地上部的氮素回收率 Fig.2 Recovery of applied N in above-ground parts of rice
2.3 不同处理对土壤脲酶与硝酸还原酶活性的影响

在孕穗期,添加NBPT的处理与传统施氮处理间无显著差异,可能由于时间的推移,NBPT逐渐降解,失去了对脲酶的抑制作用,尿素也被完全分解,脲酶活性基本恢复等原因导致。

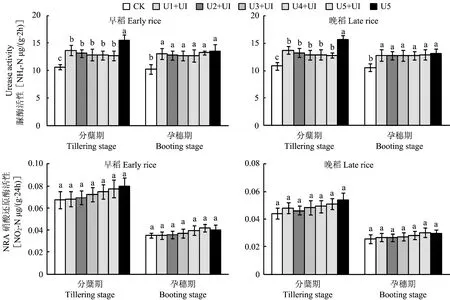
图3 水稻分蘖期和孕穗期土壤脲酶与硝酸还原酶活性 Fig.3 Activities of urease and nitrate reductase in soil at tillering and booting stages of rice
2.4 不同处理对土壤铵态氮和硝态氮含量的影响
图4结果表明,稻田土壤中的铵态氮含量明显高于硝态氮含量。在水稻分蘖期,处理U5的铵态氮含量显著高于其余处理的,早、 晚稻分别高达79.65 mg/kg和99.55 mg/kg; 与U5处理相比,施氮量相同的U5+UI处理在早、 晚稻分别降低铵态氮含量12.04%和10.41%。在孕穗期,土壤铵态氮含量急剧下降,且处理间差异显著(P<0.05),可能由于此时水稻对氮肥的大量吸收所致[22]; 添加NBPT处理的铵态氮含量随着施氮量的增加而呈递增趋势,处理U5+UI的最高; 与处理U5相比,处理U5+UI的铵态氮含量在早、 晚稻分别高出21.11%和32.25%。以上结果说明,添加NBPT显著减少了分蘖期土壤的铵态氮含量,而显著增加了孕穗期的铵态氮含量。
与土壤的铵态氮含量相比,硝态氮含量极低,不足铵态氮含量的2%,且处理间的差异始终不显著(P>0.05),反映了稻田长期淹水,土壤持续厌氧环境下硝化作用极其微弱,而且不同的施氮量以及添加NBPT对硝态氮含量均无明显影响。
2.5 不同处理对微生物量碳、 氮含量的影响
图5显示,水稻分蘖期与孕穗期的土壤微生物量碳含量、 微生物量氮含量、 微生物量碳/氮比值在各时期内处理间的差异不显著(P>0.05),说明不同施肥处理对微生物量碳、 氮含量没有显著影响,添加脲酶抑制剂对土壤生物特性没有明显影响。对同一时期的微生物量碳、 氮含量进行相关性分析发现,二者存在极显著正相关关系(P<0.01)。分别对以上三项指标在早、 晚稻两个时期的变化进行分析,结果表明,微生物量碳、 氮含量在晚稻两个时期之间的差异显著(P<0.05),而在早稻的差异不显著(P>0.05),这说明晚稻的季节变化对微生物量碳、 氮含量的影响较施肥处理的影响更大。

图4 水稻分蘖期与孕穗期土壤铵态氮与硝态氮含量 Fig.4 Contents of and in soil at tillering and booting stages of rice
2.6 土壤生物特性与水稻产量的相关性
将水稻两个生育期的土壤脲酶活性、 硝酸还原酶活性、 铵态氮含量、 硝态氮含量、 微生物量碳含量、 微生物量氮含量、 微生物量碳/氮比值7项指标对产量的影响进行逐步回归分析(n=21)。结果表明,只有铵态氮含量进入回归方程,说明土壤铵态氮含量对产量的影响显著,而其余6项指标对产量的影响不显著。 回归方程的相关参数见表1。由表1可知,对于早、 晚稻,两个时期的铵态氮含量对产量的影响均达极显著水平(P<0.01),而且,孕穗期的影响大于分蘖期的,说明氮肥对于水稻产量的提高作用显著,尤其是孕穗期的氮肥更为重要。
3 讨论与结论
土壤酶活性受到诸多因素的影响[23-24],如脲酶活性与基质浓度、 温度、 pH、 有机质含量、 微生物生物量、 总氮量等因素呈正相关关系[25-31],短期内可被脲酶抑制剂抑制(脲酶抑制剂有一定的时效性,如NBPT施入土壤后2周左右可降解为N、 P、 S等元素[9])。本研究发现,在早稻与晚稻的分蘖期,施用氮肥显著提高了土壤脲酶活性,而添加NBPT后脲酶活性并没有随着施氮量的增加而增加,且添加NBPT下各处理的脲酶活性均显著低于传统施氮处理的,说明基质的增加会提高脲酶活性,而NBPT则对脲酶活性有较强的抑制作用; 到孕穗期,可能由于脲酶抑制剂NBPT逐渐降解失去抑制效应,尿素完全水解,脲酶活性趋于平稳,施用氮肥的各处理间无显著差异。对于硝酸还原酶活性,在早稻与晚稻的两个时期,活性始终维持在极低水平,可能由于稻田长期淹水的特殊环境导致; 不同处理间没有显著差异,表明氮肥以及脲酶抑制剂对硝酸还原酶活性没有明显的影响,这与李东坡等人的报道[9,32]一致。

表1 水稻产量与两个生育期影响因子的逐步回归分析(n=21)
相同施氮量下,添加NBPT的处理(U5+UI)在分蘖期土壤铵态氮含量显著低于传统施氮处理(U5)的,而孕穗期截然相反,进一步说明添加脲酶抑制剂可有效减缓生育前期尿素的水解,减少土壤中的铵态氮含量,在后期随着脲酶抑制剂的降解,尿素完全水解,因而可为需肥高峰期的水稻提供更加充分的铵态氮。水稻孕穗期耕层土壤中的铵态氮含量显著低于分蘖期,也是因为在孕穗期水稻根系庞大,对养分的吸收强度和数量急剧增加[22],导致土壤中的铵态氮含量骤降。土壤中硝态氮含量始终较低,不足铵态氮含量的2%,且不受施氮量的影响,这与Wang[33]等人报道一致; 另外,硝态氮含量没有明显的变化,可能与稻田长期淹水以及水稻为喜铵作物有关。
本研究结果中,在水稻分蘖期和孕穗期的处理间微生物量碳、 氮含量均无显著差异,证明了添加NBPT对微生物无明显副作用[9,34]。同一时期内微生物量碳、 氮含量存在极显著正相关关系,这与Mandal等[35]的报道一致。土壤微生物量碳、 氮含量以及土壤酶活性受到多种因素的影响[29],在作物生长期,微生物生物量会因为作物的生长、 气候变化而发生短暂的季节性波动[36],本研究中,晚稻的两个生育期之间微生物量碳、 氮含量存在显著差异,孕穗期土壤微生物量碳、 氮含量显著高于分蘖期,显示了季节变化的影响[24,37],早稻则无此差异,这可能由于晚稻生长期间,温度较高,水稻生长旺盛,根系分泌物较多,土壤微生物活性较高等诸多因素导致。
通过对稻田土壤的七项指标在分蘖期和孕穗期与产量的关系进行逐步回归分析发现,只有土壤铵态氮含量对产量的影响显著,且孕穗期的影响大于分蘖期的,因此,通过添加脲酶抑制剂,有效地实现了尿素水解后移,增加了孕穗期土壤铵态氮的供应,可能是其节约氮肥与增产显著的主要原因。本研究中,对不同处理的水稻产量和氮素回收率分析结果也证明了添加脲酶抑制剂的有效性。在同样产量目标下,添加1%的脲酶抑制剂可以节省25%的尿素,今后可继续深入研究添加脲酶抑制剂的节肥潜力。
参考文献:
[1] 朱德峰, 陈惠哲, 徐一成, 张玉屏. 我国双季稻生产机械化制约因子与发展对策[J]. 中国稻米, 2013, 19(4): 1-4.
Zhu D F, Chen H Z, Xu Y C, Zhang Y P. Limiting factors and countermeasures of mechanization for double-cropping rice[J]. China Rice, 2013, 19(4): 1-4.
[2] 巨晓棠, 张福锁. 关于氮肥利用率的思考[J]. 生态环境, 2003, 12(2): 192-197.
Ju X T, Zhang F S. Thinking about nitrogen recovery rate[J]. Ecology and Environment, 2003, 12(2): 192-197.
[3] 朱兆良. 农田中氮肥的损失与对策[J]. 土壤与环境, 2000, 9 (1): 1-6.
Zhu Z L. Loss of fertilizer N from plants-soil system and the strategies and techniques for its reduction[J]. Soil and Environmental Sciences, 2000, 9 (1): 1-6.
[4] Trenkel M E. Characteristics and types of slow- and controlled-release fertilizers and nitrification and urease inhibitors[A]. Trenkel M E. Slow- and controlled-release and stabilized fertilizers: an option for enhancing nutrient use efficiency in agriculture[C]. Paris: International Fertilizer Industry Association (IFA). 2010: 56.
[5] Chien S H, Prochnow L I, Cantarella H. Recent developments of fertilizer production and use to improve nutrient efficiency and minimize environmental impacts[J]. Advances in Agronomy, 2009, 102: 267-322.
[6] Byrnes B H, Freney J R. Recent developments on the use of urease inhibitors in the tropics[A]. Springer Netherlands: Ahmad N. Nitrogen Economy in Tropical Soils[C]. Trinidad: Kluwer Academic Publishers, 1996: 251-259.
[8] Xiang S, Doyle A, Holden P Aetal. Drying and rewetting effects on C and N mineralization and microbial activity in surface and subsurface California grassland soils[J]. Soil Biology and Biochemistry, 2008, 40 (9): 2281-2289.
[9] Chaiwanakupt P, Freney J R, Keerthisinghe D Getal. Use of urease, algal inhibitors, and nitrification inhibitors to reduce nitrogen loss and increase the grain yield of flooded rice (OryzasativaL.)[J]. Biology and Fertility of Soils, 1996, 22(1-2): 89-95.
[10] 孙庆元, 张雪崧, 王艳红. 土壤脲酶抑制剂正丁基硫代磷酰三胺的作用基团研究[J]. 土壤, 2007, 39(3): 492-495.
Sun Q Y, Zhang X S, Wang Y H. Functional groups of soil urease inhibitor NBPT[J]. Soils, 2007, 39(3): 492-495.
[11] Luo Q X, Freney J R, Keerthisinshe D Getal. Inihibition of urease activity in flooded soils by phenylphosphorodiamidate and N-(n-butyl)thiophosphoricariamides[J]. Soil Biology and Biochemistry, 1994, 26(8): 1059-1065.
[12] Grant C A, Bailey L D. Effect of seed-placed urea fertilizer and N-(n-butyl) thiophosphoric triamide (NBPT) on emergence and grain yield of barley[J]. Canadian Journal of Plant Science, 1999, 91(79): 491-496.
[13] Malhi S S, Oliver E, Mayerle Getal. Improving effectiveness of seedrow-placed urea with urease inhibitor and polymer coating for durum wheat and canola[J]. Communications in Soil Science and Plant Analysis, 2003, 34(11-12): 1709-1727..
[14] Freney J R, Keerthisinghe D G, Phongpan Setal. Effect of urease, nitrification and algal inhibitors on ammonia loss and grain yield of flooded rice in Thailand[J]. Fertilizer Research, 1995, 40: 225-233.
[15] Abdallahi M M, N′Dayegamiye A. Effects of two incorporations of green manures on soil physical and biological properties and on wheat (TriticumaestivumL.) yields and N uptake[J]. Canadian Journal of Soil Science, 2000, 80(1): 81-89.
[16] Kandeler E, Gerber H. Short-term assay of soil urease activity using colorimetric determination of ammonium[J]. Biology and Fertility of Soils, 1988, 6(1): 68-72.
[17] Abdelmagid H M, Tabatabai M A. Nitrate reductase activity of soils[J]. Soil Biology and Biochemistry, 1987, 19(4): 421-427.
[18] 鲁如坤. 土壤农业化学分析法[M]. 北京: 中国农业科技出版社,2000.
Lu R K. Analytical methods of soil and agro-chemistry[M]. Beijing: China Agricultural Science and Technology Press, 2000.
[19] Wu J, Joergensen R G, Pommerening Betal. Measurement of soil microbial biomass C by fumigation-extraction automated procedure[J]. Soil Biology and Biochemistry, 1990, 22(8): 167-169.
[20] Vance E D, Brggke P C, Jenkinson D S. An extraction method for measuring soil microbial biomass C[J]. Soil Biology and Biochemistry, 1987, 19(6): 703-707.
[21] Brookes P C, Landman A, Pruden Getal. Chloroform fumigation and the release of soil nitrogen: A rapid direct extraction method to measure microbial biomass nitrogen in soil[J].Soil Biology and Biochemistry, 1985, 17(6): 837-842.
[22] 黄见良, 邹应斌, 彭少兵, 等. 水稻对氮素的吸收、 分配及其在组织中的挥发损失[J]. 植物营养与肥料学报, 2004,10(6): 579-583.
Huang J L, Zou Y B, Peng S Betal. Nitrogen uptake, distribution by rice and its losses from plant tissues[J]. Journal of Plant Nutrition and Fertilizer, 2004, 10(6): 579-583.
[23] 雍太文,杨文钰,向达兵,等. 不同种植模式对土壤氮素转化及酶活性的影响[J]. 应用生态学报, 2011, 22(12): 3227-3235.
Yong T W,Yang W Y,Xiang D Betal. Effects of different planting modes on soil nitrogen transformation and related enzyme activities[J].Chinese Journal of Applied Ecology, 2011, 22(12): 3227-3235.
[24] Geisseler D, Horwath W R. Short-term dynamics of soil carbon, microbial biomass, and soil enzyme activities as compared to longer-term effects of tillage in irrigated row crops[J]. Biology and Fertility of Soils, 2009, 46(1): 65-72.
[25] 和文祥,朱铭莪,张一平. 汞、 镉对土壤脲酶活性影响的研究Ⅰ. 尿素浓度[J]. 应用生态学报, 2002, 13(2): 191-193.
He W X, Zhu M G, Zhang Y P. Effects of mercury and cadmium on the activity of urease in soils Ⅰ. Urea concentration[J]. Chinese Journal of Applied Ecology, 2002, 13(2): 191-193.
[26] Rachhpal S, Nye P H. The effect of soil pH and high urea concentrations on urease activity in soil[J]. Journal of Soil Science, 1984, 35(4): 519-527.
[27] 郭天财, 宋晓, 马冬云, 等. 施氮量对冬小麦根际土壤酶活性的影响[J]. 应用生态学报, 2008, 19(1): 110-114.
Guo T C, Song X, Ma D Yetal. Effects of nitrogen application rate on soil enzyme activities in wheat rhizosphere[J]. Chinese Journal of Applied Ecology, 2008, 19(1): 110-114.
[28] Moyo C C, Kisseli D E., Cabrera M L. Temperature effects on soil urease activity[J]. Soil Biology and Biochemistry, 1989, 21(7): 935-938.
[29] 马晓霞, 王莲莲, 黎青慧, 等. 长期施肥对玉米生育期土壤微生物生物量碳氮及酶活性的影响[J]. 生态学报, 2012, 32(17): 5502-5511.
Ma X X, Wang L L, Li Q Hetal. Effects of long-term fertilization on soil microbial biomass carbon and nitrogen and enzyme activities during maize growing season[J]. Acta Ecologica Sinica, 2012, 32(17): 5502-5511.
[30] Zhong W H, Cai Z C, Zhang H. Effects of long-term application of inorganic fertilizers on biochemical properties of a rice-planting red soil[J]. Pedosphere, 2007, 17 (4): 419-428.
[31] Bhattacharyya P, Chakrabarti K, Chakraborty A. Microbial biomass and enzyme activities in submerged rice soil amended with municipal solid waste compost and decomposed cow manure[J]. Chemosphere, 2005, 60: 310-318.
[32] 李东坡, 梁成华, 武志杰, 等. 玉米苗期施用缓/控释氮素肥料养分释放特点与土壤生物活性研究[J]. 沈阳农业大学学报, 2006, 37(1): 48- 52.
Li D P, Liang C H, Wu Z Jetal. Characteristics of releasing nutrition and soil biological activities at maize seedling stage for using slow/controlled release nitrogen fertilizers[J]. Journal of Shenyang Agricultural University, 2006, 37(1): 48-52.
[33] Wang Y, Ke X, Wu Letal. Community composition of ammonia-oxidizing bacteria and archaea in rice field soil as affected by nitrogen fertilization[J]. Systematic and Applied Microbiology, 2009, 32(1): 27-36.
[34] Ajwa H A, Dell C J, Rice C W. Changes in enzyme activities and microbial biomass of tallgrass prairie soil as related to burning and nitrogen fertilization[J]. Soil Biology and Biochemistry, 1999, 31: 769-777.
[35] Mandal A, Patra A K, Singh Detal. Effect of long-term application of manure and fertilizer on biological and biochemical activities in soil during crop development stages[J]. Bioresource Technology, 2007, 98(18): 3585-3592.
[36] Mahmood T, Ali R, Hussain F, Tahir G R. Seasonal changes in soil microbial biomass carbon under a wheat-maize cropping system receiving urea and farmyard manure in different combinations[J]. Pakistan Journal of Botany, 2005, 37(1): 105-117.
[37] Franzluebbers A J, Hons F M, Zuberer D A. Seasonal changes in soil microbial biomass and mineralizable C and N in wheat management systems[J]. Soil Biology and Biochemistry, 1994, 26(11): 1469-1475.
