胸椎后纵韧带骨化症的研究进展
2014-04-07陈文杰王洪立姜建元
陈文杰 王洪立 姜建元
(复旦大学附属华山医院骨科,上海 200040)
胸椎后纵韧带骨化症的研究进展
陈文杰 王洪立 姜建元*
(复旦大学附属华山医院骨科,上海 200040)
后纵韧带骨化症(ossification of the posterior longitudinal ligament,OPLL)是 脊 柱 后 纵 韧 带 进 行 性 异位骨化压迫脊髓和神经根而导致其功能受损的一种疾病,是日本及其他东亚国家颈胸段脊髓病和神经根病的常见原因之一,多发于颈椎,胸椎次之[1,2]。
胸椎后纵韧带骨化症(T-OPLL)即为胸段后纵韧带异位骨化累及后方脊髓进而出现相应压迫症状的疾病,多见于中上段胸椎,且常合并黄韧带骨化造成脊髓前后压迫,加之胸段椎管狭小、脊髓血供相对较差,一旦出现神经压迫症状后保守治疗多无效,需要借助手术方法进行彻底减压。该病起病隐匿,发病机制不明,且保守疗效差、手术风险大,长期以来一直是脊柱外科领域富有挑战性的临床难题之一。近年来,随着基础研究及手术技术的不断发展与提高,T-OPLL 在发病机制及手术治疗等方面获得了一定进展。
自 1960 年 Tsukimoto 等首次报道了 OPLL 以来,对其病因及发病机制的探索便层出不穷,目前研究尚未细化至单纯针对T-OPLL的层面,因而相关报道相对少见。随着研究的不断深入,基因、代谢、应力、环境等多方面因素的影响均与OPLL的发病有关,但其具体发病机制尚不明确。
1 临床分型
为 了 更 好 地 认 识 疾 病 ,Mizuno 和 Nakagawa[3]根据发病模式将OPLL分为:①早期型,病灶局限于对应椎体的后缘呈线形分布;②片段型,病灶增厚、扩展未跨越临近椎间盘;③连续型,骨化物累及多节段;④混合型。根据骨化物的形态学表现,OPLL可更直观地分为线形、鸟嘴形、连续波形和连续柱形及混合型。Matsumoto 等[4]在一项多中心调查中对 154例 T-OPLL 患 者 进 行 统 计 ,线 型 为 5.2%,鸟 嘴 型 为29.2%,连续波型 为 29.9%,连 续 柱 型为 16.9%,混合型 为 8.8%( 图 1);就 累 及 节 段 进 行 统 计 ,Tl~4 为44.8%,T5~8为 40.3%,T9~12 为 14.9%。

图1 OPLL 根据骨化物的形态学表现,直观地分为线形(A)、鸟嘴形(B)、连续波形(C)、连续柱形(D)和混合型
2 手术方式
不同于颈椎后纵韧带骨化症,T-OPLL可长期无症状,临床上容易漏诊、误诊,但一经发现常呈进行性加重,导致严重的脊髓损伤,甚至瘫痪[5]。由于胸椎活动度较小,动态因素并不是胸椎脊髓病变中的关键。一旦出现神经压迫症状,静卧制动等保守疗法 多 无 效 ,手 术 治 疗 成 为 唯 一 的 解 决 办 法[4-8]。 目 前临床上大致有三种手术思路用于治疗 T-OPLL[5]:直接切除脊髓前方骨化物、打开后方结构间接减压或前后联合以达到解除脊髓压迫的目的。在这三种思路下催生的各种术式都能取得一定的临床疗效,但也各有利弊,对于手术方案的选择,学界并未形成统一标准[4,5,9]。
2.1 前路减压
通过前方减压手术直接暴露、切除骨化的后纵韧带,可从根本上解除对脊髓的压迫,改善脊髓病症状。对于上段胸椎(T1~3)主要采用劈开胸骨柄入路,中下段胸椎(T4~11)多采用经胸膜外或腹膜外途径的椎体次全切除术,若联合腹膜外显露可达到L3水平。
然而传统的前入路减压手术由于操作区域深、手术视野狭小,加之胸椎前众多重要的血管、神经、淋巴管等结构以及骨化韧带与硬脊膜形成的粘连[6],给术者带来了相当大的挑战。因而,尽管文献报道前入路手术可达到较好的术后恢复效果[10-12],但是包括术后神经功能恶化、脑脊液漏、硬膜囊外血肿等在内 的 术 后 并 发 症 高 达 20.0% ~42.1%[4,7,10],多 节 段 T-OPLL去除后植骨内固定影响脊柱生理曲度、创伤大、愈合时间长等缺点也限制了该术式的应用。
侧方入路也是目前临床上使用较多的胸椎前方减压手术入路,Hanai等[10]提出的经肩胛骨下侧方入路:切断背阔肌、前据肌和大圆肌,提起肩胛骨、暴露胸廓,去除第三肋进入胸腔,可以为上胸椎手术提供良好的手术视野,并认为完全切除骨化物能得到更好的疗效,但对于累及多节段的T-OPLL 存在着切除不彻底的局限。
Min 等[7]对 19 例患者进行的回顾性分析中,术前日本矫形外科协会(Japanese Orthopedic Association, JOA)评分较高的患者预后更佳。Yamazaki等[12]对 51例患者进行分组施行不同术式的比较研究中指出,尽管前路减压对术者要求较高,但在手术成功进行的前提下,基于前方直接减压的良好效果,可认为是治疗 T-OPLL 的 首选术式。而对于术前已有明显脊髓病症状、无法行走的患者,考虑到术后并发症的风险,建议改行后方减压并融合术。所以,综合手术本身的操作难度、创伤与术后较高的并发症发生率,前路手术用于少节段的中下段T-OPLL更为安全,疗效也更为确切。
2.2 后路减压
考虑到后方减压手术操作相对简单,因而在临床上得到了广泛应用。Yamazaki等[12]在一项分组比较研究中得出,单纯的椎板切除术后改善率为(41.9%)远 小 于 合 并 施 行 融 合 内 固 定 的 改 善 率(59.3%)。不建议单独使用后路减压的原因包括:①胸椎本身存在的生理性后凸,单纯后方减压幅度有限;②手术破坏了后柱结构,前方骨化物及胸椎本身在术后进一步的后凸影响;③受压脊髓对微小创伤和缺血的敏感反应,致使术后神经功能不及预期效 果[4,5,8]。
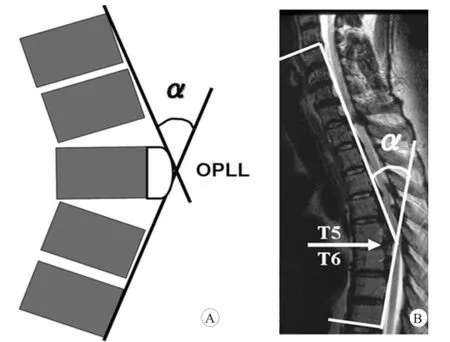
图2 骨化后凸角(α)
随着近年来内固定器械的广泛使用,以及相关研究的不断进展,后方减压手术的稳定性得到了明显提高。不少学者都将关注投向了骨化后凸角与神经功能预后的联系,骨化后凸角是指在MRI矢状面片中骨化物后凸最显著处与头端胸椎椎体背侧面上缘和尾端胸椎椎体背侧面下缘两点连线所成角的补角 ,即为 α(图 2)。Nishida 等[6]通 过 3D 技术 进行生 物力学建模得出当骨化后凸角>20°时,持续增加的应力将加剧后凸畸形与明显的压迫症状,从而导致术后神经功能的恶化。类似结论也在实际患者的影像学分析中得到证实 ,Tokuhashi等[13]认为当骨化后凸角>23°时,单纯的椎板切除已不能达到充分减压的目的,因此可将骨化后凸角视为一项 T-OPLL手术治疗方式的术前评估指标;同时结合超声影像在13例患者术中进行探测,认为得到脊髓与骨化物之间恢复硬膜囊内液性无回声区的患者应视为已获得充分减压,并且在术后无神经功能恶化发生。Yamazaki等[14]也将术中超声应用于后方减压,尽管 24 例患者术后证实仍有来自前方的骨化物接触脊髓,但是全部患者均获得了功能的恢复,使术者进一步认为术后神经功能恶化与减压节段的高活动度有关,为了恢复良好的神经功能,使用后方减压合并内固定融合术限制脊柱活动度比矫正后凸更为重要。
处于颈胸交界区的上胸椎曲度常为前凸或轻度后凸,为后方减压的脊髓提供了充分的后移空间,在减压效果同样显著的基础上,椎板成形术因其最大限度地保留了后柱结构而被推荐应用于T1~4的TOPLL;对于存在明显后凸的中下段胸椎,文献则更倾向于使用椎板切除加内固定术[4,5]。减压后脊髓后移幅度小是制约胸椎后方减压手术疗效的重要因素,临床随访的结果显示后方减压术后神经功能恢复情况在 9 个月后趋于稳定[14],故而建议若一期后方减压效果不理想者可于术后9个月至1年后考虑二次手术。
2.3 前、后路联合减压
胸椎椎管大致呈圆形,其矢状径除T12外,其余为 14~15 mm(X 线片示平均为 18 mm)。横径除 T1、2、3、11、12稍大外,T4~10基本与矢状径相同,在整个椎管中也是最小的。累及多节段且后凸明显的TOPLL或伴有黄韧带骨化的T-OPLL容易导致脊髓受前后方双重压迫,单纯前路减压手术操作过程中的磨钻、牵拉对本已处于病理状态的脊髓可能造成危险[15],而单纯后路减压效果又十分有限,此时需要考虑前、后联合入路进行更为彻底的减压[14]。Kawahara等[11]首先通过后方椎扳切除术减轻脊髓压迫,并以高速磨钻在椎体两侧打磨出一条沟槽,以此作为后续手术切除骨化物边缘的标志,于一期术后3周复查MRI,只要脊髓仍受到前方骨化物压迫即可行二期前方减压手术,在直视下将椎体次全切除,剥离骨化物后自体植骨内固定,且在术后跟踪随访中联合减压患者的改善率优于单纯后路减压。但关于二期前路手术的时机仍存在争议,Matsuyama 等[16]认为一期术后半年恢复不佳者考虑二期手术,也有学者主张一期手术完成联合减压,认为此法减压彻底,但手术难度较大、并发症发生率高。
2.4 单纯后入路环形减压
除了传统前、后联合入路实行的环形减压,学者也在不断尝试以单纯后入路达到环形减压的手术新方法。Yamazaki等[12]在一项分组比较研究中以经椎弓根的后入路为12例患者实行环形减压取得了平均62.1%的改善率,但此法难以去除较大的 T-OPLL。Takahata 等[9]回顾分析了一组后路环形减压病例,术者切除了广泛椎板、骨化物及椎体后缘,植骨后以椎弓根螺钉结合钉-棒系统向上向下各扩大两个节段行内固定术,尽管减压效果好,但此法并发症较多(40%),文献报道主要有术后神经功能恶化、硬膜囊撕裂和深部感染等[9]。术者分析指出受累节段越少的病例预后越好,而受累节段≥5个、多节段减压损伤过多血管、术后脊柱后凸、椎体间结构不稳都与预后不良相关,建议此法应用于≤4个节段的T-OPLL。
近年来,新兴的技术被引入到后路环形减压手术,Seichi等[17]利用 CT-3D 图像重建技术与可调节的外固定支具,在术中对骨化物边界进行精确定位,对于较大或粘连严重的 T-OPLL,采用“漂浮法”规避了静脉丛破裂出血及硬脊膜撕裂导致硬膜外血肿与脑脊液漏的风险,并获得了良好的减压效果。刘晓光等[18]以“涵洞塌陷法”治疗 T-OPLL,术后脊髓功能明显改善,并发症少,显示了此法的安全与有效性。Kato 等[19]报道了 3 例后入路去除椎体后所有附件、部分椎体与椎间盘,保留肋骨及肋横突关节,悬吊硬膜囊,切除骨化物的新术式。这种方法在理论上以单一切口完成了前、后联合减压,提供了较传统前方减压入路更好的手术视野与操作空间,并以后外侧植骨内固定纠正了脊柱不稳结构。该报道中1例出现术中硬脊膜撕裂但并未造成脑脊液漏,另外术中切断的两侧神经根可能导致脊髓相应节段的缺血,因而建议手术不宜切断3个节段以上的神经根。这项新方法有待更大规模病例的实践积累与检验。
3 手术并发症
综合各种手术方式,术后神经功能恶化的发生率高达11.7%,但其发生机制却尚未定论,其中单纯后路减压由于手术范围较小、神经功能恶化的发生率较低;前路或环形减压的发生率较高。对于术后立即出现的神经功能恶化,需即刻进行MRI寻找原因[9],静脉丛止血不彻底引起的硬膜外血肿或胸椎后凸纠正不当导致的脊髓压迫,一旦明确应立刻手术补救。术中剥离骨化物对脊髓的直接损伤、大范围剥离椎旁肌并去除后柱结构引起的术后椎旁肌水肿、缓慢的硬膜外血肿、修补硬脊膜时引起的局部缩窄及术后脊柱后凸畸形的影响均须在术后住院或出院随访期间出现脊髓功能损害加重时纳入考虑。尽管非压迫性的神经功能恶化的发展有一定程度的自限性,通过保守对症治疗常能使患者缓慢恢复,但术者 仍 需 关 注 其 发 展 成 为 Frankel A 型 瘫 痪 的 可 能[4]。术中的精细操作、电生理时时监控、合理纠正脊柱后凸并稳定胸椎结构等一系列措施能一定程度上减少脊髓功能恶化的发生。
另外,术中硬膜囊撕裂造成的脑脊液漏也是剥离骨化物时的常见并发症。较小的破口通过及时的压迫应能解决,在破口较大需要修补时,选用缝合或辅以垫片覆盖应注意避免发生局部缩窄或堵塞影响脑脊液循环,必要时可置引流。Cho 等[20]以一组先行硬脊膜切开后仅置胸管并控制每日引流量的T-OPLL前方减压术后脑脊液漏患者与单纯施以胸管及腰大池引流的对照组比较,虽未得出统计学差异,但前组患者获得了更高的术后恢复率,提示传统腰大池引流在 T-OPLL 术后并发脑脊液漏的应用并不一定具有促进作用,简单的胸管引流也能获得良好效果。
综上,T-OPLL的发病可能与基因、代谢、应力、环境等多方面因素有关,一经确诊应及时手术治疗以避免神经功能恢复困难甚至造成终身残疾。目前治疗手术方案很多,且都在临床上取得过一定的疗效。胸椎和胸段脊髓本身的解剖特点容易发生脊髓损伤与术后并发症,这些都需要术者根据患者的实际情况、自身的手术经验和手术器械的条件来确定具体的手术方案。前方、后方或者环形减压的减压效果在不断的病例累积后都是肯定的,无论选择哪种术式,手术安全都应放在第一位,术中操作应谨慎操作防止加重脊髓损伤。
[1]Stapleton CJ,Pham MH,Attenello FJ,et al.Ossification of the posterior longitudinal ligament:genetics and pathophysiology.Neurosurgical Focus,2011,30(3):E6.
[2]Stetler WR,La Marca F,Park P.Park,The genetics of ossification of the posterior longitudinal ligament.Neurosurgical Focus,2011,30(3):E7.
[3]Mizuno J,Nakagawa H.Ossified posterior longitudinal ligament:management strategies and outcomes.Spine J,2006,6 (6 Suppl):282S-288S.
[4]Matsumoto M,Chiba K,Toyama Y,et al.Surgical results and related factors for ossification of posterior longitudinal ligament of the thoracic spine:a multi-institutional retrospective study.Spine(Phila Pa 1976),2008,33(9):1034-1041.
[5]McClendon J Jr,Sugrue PA,Ganju A,et al.Management of ossification of the posterior longitudinal ligament of the thoracic spine.Neurosurgical Focus,2011,30(3):E16.
[6]Nishida N,Kato Y,Imajo Y,et al.Biomechanical study of the spinal cord in thoracic ossification of the posterior longitudinal ligament.J Spinal Cord Med,2011,34(5):518-522.
[7]Min JH,Jang JS,Lee SH.Clinical results of ossification of the posterior longitudinal ligament(OPLL)of the thoracic spine treated by anterior decompression.J Spinal Disord Tech,2008,21(2):116-119.
[8]Matsuyama Y,Yoshihara H,Tsuji T,et al.Surgical outcome ofossification ofthe posteriorlongitudinalligament (OPLL)of the thoracic spine implication of the type of ossification and surgical options.J Spinal Disord Tech,2005,18 (6):492-497.
[9]Takahata M,Ito M,Abumi K,et al.Clinical results and complications of Circumferential spinal cord decompression through a single posterior approach for thoracic myelopathy caused by ossification of posterior longitudinal ligament. Spine(Phila Pa 1976),2008,33(11):1199-1208.
[10]Hanai K,Ogikubo O,Miyashita T.Anterior decompression for myelopathy resulting from thoracic ossification of the posterior longitudinal ligament.Spine(Phila Pa 1976), 2002,27(10):1070-1076.
[11]Kawahara N,Tomita K,Murakami H,et al.Circumspinal decompression with dekyphosis stabilization for thoracic myelopathy due to ossification of the posterior longitudinal ligament.Spine(Phila Pa 1976),2008,33(1):39-46.
[12]Yamazaki M,Mochizuki M,Ikeda Y,et al.Clinical results of surgery for thoracic myelopathy caused by ossification of the posterior longitudinal ligament:operative indication of posterior decompression with instrumented fusion.Spine (Phila Pa 1976),2006,31(13):1452-1460.
[13]Tokuhashi Y,Matsuzaki H,Oda H,et al.Effectiveness of posterior decompression for patients with ossification of the posterior longitudinal ligament in the thoracic spine:usefulness of the ossification-kyphosis angle on MRI.Spine(Phila Pa 1976),2006,31(1):E26-30.
[14]Yamazaki M,Okawa A,Fujiyoshi T,et al.,Posterior decompression with instrumented fusion for thoracic myelopathy caused by ossification of the posterior longitudinal ligament.Eur Spine J,2010,19(5):691-698.
[15]Tsuzuki N,Hirabayashi S,Abe R,et al.Staged spinal cord decompression through posterior approach for thoracic myelopathy caused by ossification of posterior longitudinal ligament.Spine,2001,26(14):1623-1630.
[16]Matsuyama Y,Sakai Y,Katayama Y,et al.Indirect posterior decompression with corrective fusion for ossification of the posterior longitudinal ligament of the thoracic spine:is it possible to predict the surgical results?Eur Spine J,2009,18 (7):943-948.
[17]Seichi A,Takeshita K,Kawaguchi H,et al.,Image-guided surgery for thoracic ossification of the posterior longitudinal ligament.J Neurosurg Spine,2005,3(2):165-168.
[18] 刘 晓 光,刘忠军,陈仲强,等.“涵 洞 塌陷法”360°脊 髓环形减压术治疗胸椎管狭窄症.中华骨科杂志,2010.30(11): 1059-1062.
[19]Kato S,Murakami H,Demura S,et al.Novel surgical technique for ossification of posterior longitudinal ligament in the thoracic spine.J Neurosurg Spine,2012,17(6):525-529.
[20]Cho JY,Chan CK,Lee SH,et al.Management of cerebrospinal fluid leakage after anterior decompression for ossification of posterior longitudinal ligament in the thoracic spine:the utilization of a volume-controlled pseudomeningocele.J Spinal Disord Tech,2012.25(4):E93-102.
*通信作者:姜建元,E-mail:dr.jianyuan@gmail.com
