采用正交实验优化微波法提取菊花中总黄酮的工艺
2014-04-06赵明远蒲晓辉
杨 浩,赵 辉,赵明远,蒲晓辉,郭 猛,袁 琦*
(1.河南大学 药学院,河南 开封 475004;2.开封市农林局,河南 开封 475004)
采用正交实验优化微波法提取菊花中总黄酮的工艺
杨 浩1,赵 辉1,赵明远2,蒲晓辉1,郭 猛1,袁 琦1*
(1.河南大学 药学院,河南 开封 475004;2.开封市农林局,河南 开封 475004)
目的探索微波法提取菊花中总黄酮的最佳工艺。方法采用单因素实验研究微波提取菊花中总黄酮的影响因素,并通过正交实验对提取工艺进行优化。结果微波法最佳提取工艺条件为:乙醇浓度为体积分数70%,时间为100s,料液比为1∶20。结论该方法简单,适合菊花中黄酮含量提取工艺的的优化。
菊花;总黄酮;微波法;单因素试验
菊花是我国传统常用中药材,为菊科植物菊(Dendranthema morifolium Ram at.)的干燥头状花序。菊花味甘、苦,性凉,有散风清热、平肝明目、解毒、降压等功效,主治风热感冒、头痛眩晕、目赤肿痛、眼目昏花等[1]。目前杭菊、毫菊、贡菊、滁菊、祁菊、怀菊、济菊、黄菊已成为我国医药市场上的8大主要药用菊花商品来源[2]。菊花中有效成分黄酮类化合物可以治疗心血管疾病[3],且具有抗氧化[4]及抗肿瘤作用[5-6]。开封具有丰富的菊花资源,品种2300多个,种植规模已达100万株,但目前主要以观赏为主。国内外对开封菊花的药用研究报道不多,曾有文献[7-8]对其抗氧化活性、α-葡萄糖苷酶抑制活性[9]以及脂溶性成分[10-12]进行研究。我们选定开封产菊花,为开封菊花进一步开发提供资料。我们为探索菊花总黄酮提取条件,以总黄酮为考察指标,采用正交实验等方法对其提取工艺进行研究。
1 资料和方法
1.1 仪器
岛津UV-1600型紫外可见分光光度计(日本岛津公司);格兰仕微波炉;SHB-Ⅲ循环水式多用真空泵(郑州长城科贸工有限公司)。
1.2 试剂
芦丁对照品(中国药品生物制品检定所,批号:100080-200707);体积分数为95%乙醇,亚硝酸钠,硝酸铝,氢氧化钠,试剂均为分析纯;菊花从开封市园林菊花研究所菊花基地选取并采摘观赏性菊花作为实验材料。
2 方法与结果
2.1 供试品溶液的制备
将菊花的花粉碎后,精密称取1.00g菊花粉末于50mL锥形瓶中,加入一定量一定浓度的乙醇,微波处理一定时间,趁热减压抽滤,洗涤置100mL容量瓶中,加一定量一定浓度的乙醇定容至刻度。
2.2 标准溶液制备
精密称取芦丁对照品0.0150g,置于50mL容量瓶中,缓慢加体积分数为70%乙醇并使其溶解,定容至刻度,振荡摇匀,配制成0.2102g/L的标准溶液,备用。
2.3 测定波长选择
精密量取芦丁对照液2mL,置10mL容量瓶中,加50g/L NaNO2溶液0.3mL,摇匀,放置6min加100g/L Al(NO3)3溶液0.3mL,摇匀,放置6min加40g/L NaOH溶液4mL,再用体积分数为30%乙醇液稀释至刻度,摇匀,放置10min后置比色皿中,在波长400~600nm之间测定吸收谱,确定最大吸收波长为510nm。
2.4 稳定性考察
按2.3项下方法于510nm测定吸光度,然后每隔5min测定吸光度,观察其吸光度变化情况,最终确定最佳测定时间为显色后1.5~2.5h。
2.5 标准曲线的制备[13]
精密吸取芦丁对照液0.0、0.5、1.0、1.5、2.0、3.0、3.5mL分别置于10mL容量瓶中,加50g/L NaNO2溶液0.3mL,振荡摇匀,放置6min,加100g/L Al(NO3)3溶液0.3mL,振荡摇匀,放置6min,再加40g/L NaOH溶液4mL,振荡摇匀,用体积分数为30%乙醇定容至刻度,振荡摇匀,放置2h后采用紫外分光光度法置比色皿中510nm处测定吸光度,且所制得的溶液浓度范围为0~7.357×10-2(g/L),以对照品浓度(C×10-2g/L)为横坐标,吸光度为纵坐标,按浓度与吸光度相关关系求回归方程。测量结果及回归曲线见表1和图1。

表1 不同浓度芦丁标准溶液的吸光度
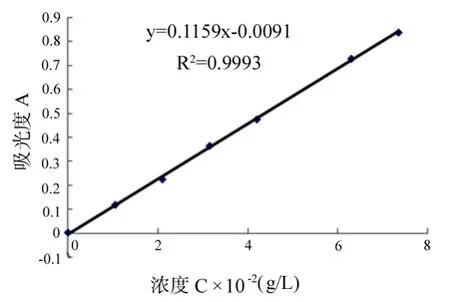
图1 芦丁标样测定点与线性回归曲线
2.6 样品测定方法[14]
精密吸取供试液1.5mL至25mL容量瓶中,按2.5项下规定测定吸光度,菊花中总黄酮提取率的计算公式:提取率/% =(总黄酮质量浓度×定容体积)/样品质量×100。
2.7 各因素适宜水平的确定
分别对乙醇浓度、料液比和提取时间进行单因素实验,确定各因素的适宜取值范围,以选择正交实验因素水平。
2.7.1 乙醇浓度对菊花中总黄酮提取率的影响
精密称取1g菊花样品5份于50mL锥形瓶中,分别加入不同浓度的乙醇溶液(0、20%、40%、60%、80%),料液比为1∶20,微波时间80s,滤过,用紫外分光光度法测定吸光度,并计算提取率,考察乙醇浓度对总黄酮提取率的影响。结果见图2和表2。
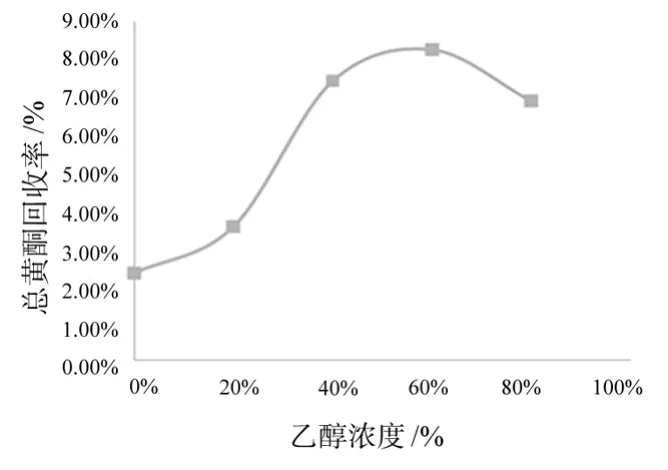
图2 乙醇浓度对提取率的影响

表2 提取浓度对总黄酮提取率的影响(n=3)
由图2可知,随着乙醇浓度增大总黄酮提取率也增多,但是当乙醇的浓度>体积分数60%时,总黄酮提取率反而下降,这可能是由于混合菊花中总黄酮在体积分数60%的乙醇水溶液中溶解性能好,体积分数60%的乙醇水溶液对原料的溶胀能力较强,而高浓度的乙醇对原料的溶胀能力较低,从而使溶剂不能与介质充分接触,致使提取量较低。
2.7.2 提取时间对菊花中总黄酮提取率的影响
精密称取1g菊花样品5份于50mL锥形瓶中,加入体积分数60%乙醇溶液20mL,分别微波处理(40、60、80、100、120s),滤过,用紫外分光光度法测定吸光度,并计算提取率,考察提取时间对总黄酮提取率的影响。结果见表3、图3。
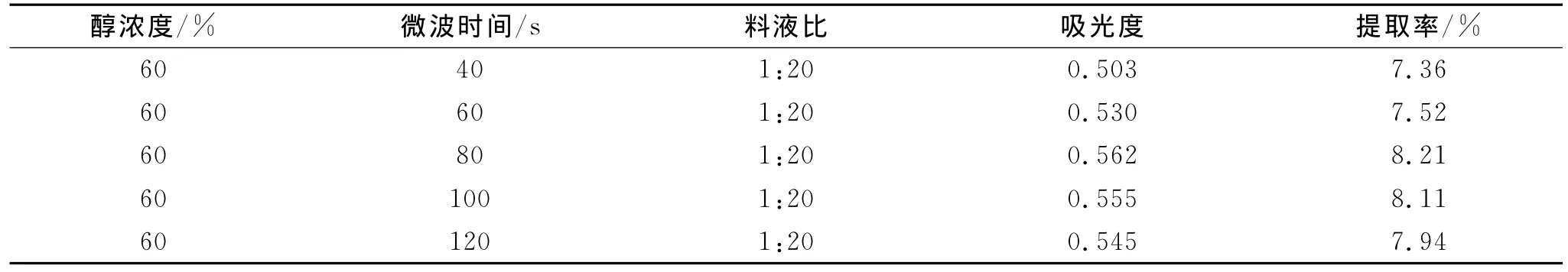
表3 提取时间对总黄酮提取率的影响(n=3)
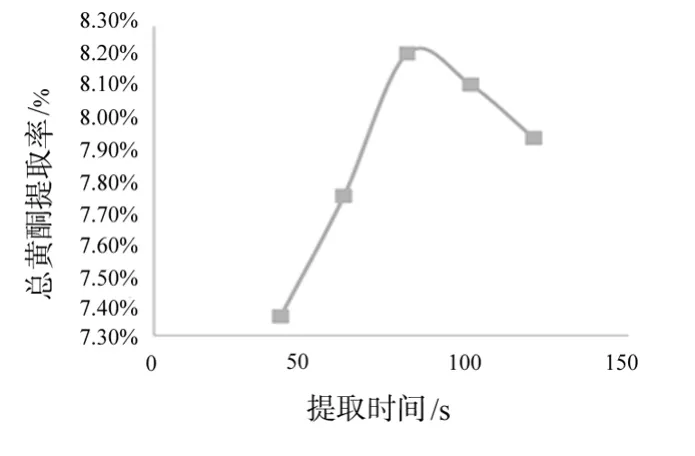
图3 提取时间对提取率的影响
由图3可以看出,总黄酮的提取率随着提取时间的增长而增高,当提取时间>80s时,提取率逐渐下降,可能是由于原料内外的总黄酮浓度逐渐达到平衡的缘故。
2.7.3 料液比对菊花中总黄酮提取率的影响 精密称取1g菊花样品5份于50mL锥形瓶中,分别加入体积分数60%乙醇溶液(10、15、20、25、30mL),微波处理80s,滤过,用紫外分光光度法测定吸光度,并计算提取率,考察药液比对总黄酮提取率的影响。结果见表4和图4

表4 料液比对总黄酮提取率的影响(n=3)
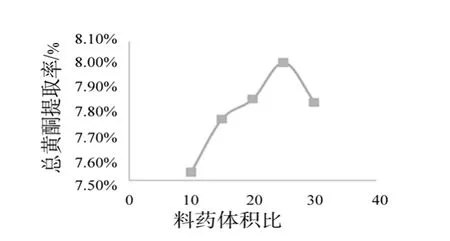
图4 料液比对提取率的影响
由图4可知,当料液比<1∶25时,总黄酮提取率随着料液比的提高而增加,当料液比增大到1∶25时,总黄酮的提取率反而下降。
2.8 微波提取工艺的优化——正交实验
在以上单因素实验的基础上,对影响菊花中总黄酮得率的因素有:乙醇浓度、料液比、提取时间进行L9(34)正交实验。结果见表5。
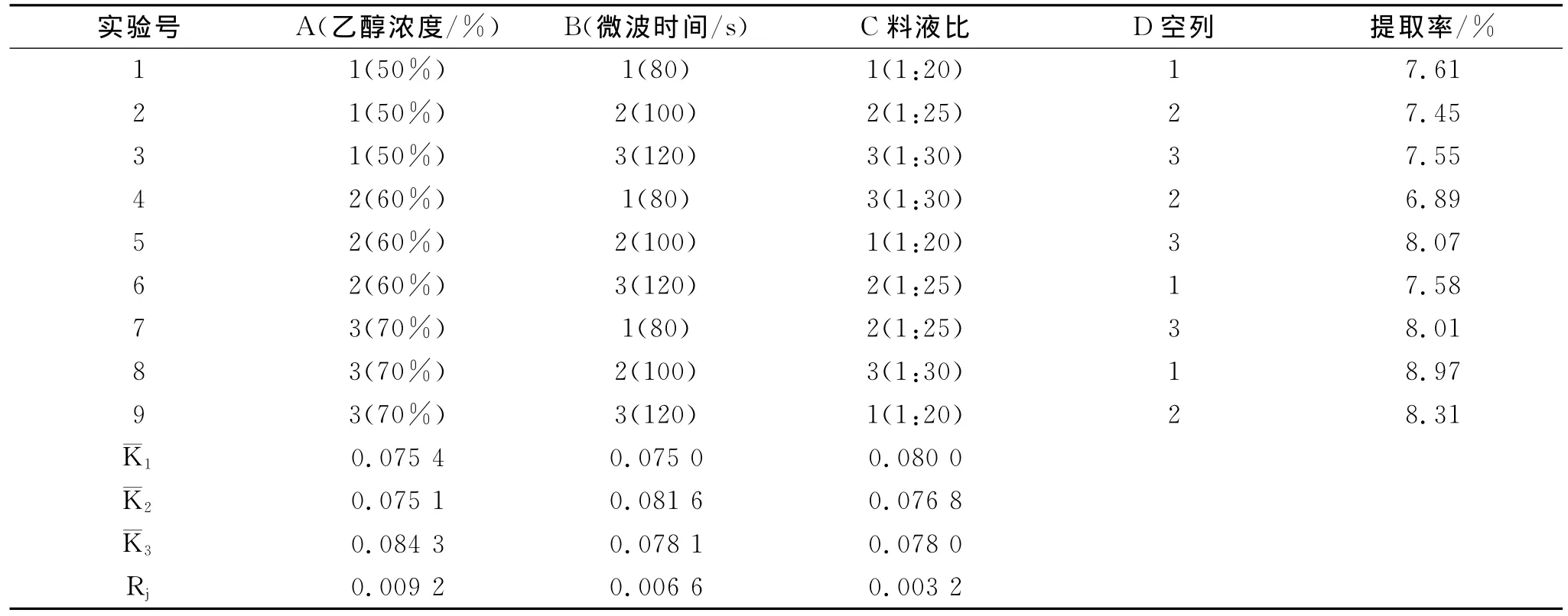
表5 不同因素作用下总黄酮提取率正交实验结果
由表5的极差分析可知,R1最大,故A因素对试验结果影响最大,其次是B和C,所以3种因素对总黄酮提取率的影响大小依次为A>B>C。再比较各个因素不同水平的综合平均值。如A因素,从而得到 A3水平最优;B因素水平中综合平均值最大的是B2,故B2水平最优;C因素中C1水平最优;因此确定菊花中黄酮提取率的最佳实验方案为A3B2C1,即乙醇浓度为70%,时间为100s,药液比为1∶20。
3 结论
微波提取的单因素实验表明:在微波功率一定的条件下,乙醇浓度体积分数60%,提取时间80s,料液比1∶25最佳。
正交优化实验表明:影响菊花黄酮提取率的主要因素为乙醇浓度,其次是提取时间、料液比。在微波功率一定的条件下,最佳提取工艺条件为乙醇浓度体积分数70%,提取时间100s,料液比1∶20。
[1]国家药典委员会.中华人民共和国药典:二部[S].北京:化学工业出版社,2005:218.
[2]江苏新医学院.中药大辞典:下册[M].上海:上海科技出版社,1986:4127.
[3]刘瑜新,张丽,康文艺.开封产紫白菊花脂溶性成分研究[J].药物研究,2009,18(8):24-25.
[4]梁山.论述菊花的养生康复作用[J].天津中医学院学报,1996,30(2):38-39.
[5]张尔贤,方黎,张捷,等.菊花提取物的抗氧化活性研究[J].食品科学,2000,21(7):6-8.
[6]Yasukaw a K en,Akihisa Toshihiro.Inhibitory effect of di-and trihy-droxy tirterpenes from the flowers of composition 12-O-tetradacanoylphorbol-13-acetate- induced in-flammation in mice[J].BiolPharm Bull,1996,19(10):1329-1331.
[7]Yasukaw a K,A kihisa T,Oinuma H,et al.Inhibitory effect of taraxastane-type triterpenes on tumor promotion by 12-O-tetradecanoyl phorbol-13-acetate in two-stage carcinogenesis in mouse skin[J].Oncology,1996,53(4):341-344.
[8]刘瑜新,常星,康文艺.两种开封产黄色菊花的体外抗氧化活性[J].食品工业科技,2009,30(12):85-87.
[9]张东娣,康文艺,刘瑜新,等.开封产3种白色菊花提取物的抗氧化活性[J].精细化工,2009,26(5):465-467.
[10]康文艺,张东娣,刘瑜新,等.七种菊花对α-葡萄糖苷酶的抑制活性[J].精细化工,2009,26(4):352-354.
[11]宋艳丽,张丽,刘瑜新,等.开封产两个菊花品种的脂溶性成分的GC-MS分析[J].天然产物研究与开发,2009,21(5):813-816.
[12]刘瑜新,宋艳丽,康文艺,等.开封产两个变种紫菊花的脂溶性成分研究[J].中成药,2009,31 (9):1408-1412.
[13]侯冬岩,回瑞华,刘晓媛,等.万寿菊花、叶、茎中黄酮的含量及抗氧化性能的分析[J].鞍山师范学院学报,2008,10(4):15-18
[14]郭勤,王登良,张大春.花茶窨制技术研究进展[J].茶业通报,2002,24(3):31-33.
[责任编辑 李武营]
Extraction technology optimization of Total Flavonoids from Chrysanthemum by microwave method
YANG Hao1,ZHAO Hui 1,Zhaomingyuan2,PU Xiaohui 1,GUO Meng1,YUAN Qi 1*(1.Pharmaceutical College of Henan University,Kaifeng,Henan475004,China;2.Kaifeng Bureau of Agriculture and Forestry,Kaifeng,Henan 475004,China)
ObjectiveExtraction technology of total flavonoid from chrysanthemum by microwave method was optimized to explore the optimized extraction technology.MethodsResults the optimized extraction technology of extraction:Ethanol concentration:70%;time:100s;solid liquid ratio:1∶20.ConclusionThe method was simple and accurate.Suitable for chrysanthemum flavonoid content extraction process optimization.
chrysanthemum;flavonoids;microwave method;factor experiment
R944.9
A
1672-7606(2014)02-0113-04
2013-12-26
NSFC-河南人才培养联合基金(U1304826)
杨浩(1961-),男,河南郏县人,实验师,从事中药分析工作。
*通讯作者:袁琦(1974-),女,河南 开封 人,硕士生导师,副教授,从事药物分析的教学与科研工作。
