电针对帕金森大鼠行为学和中脑黑质TH的影响
2014-04-04李霞李静王永凤董保霞张美英刘矿平吴培秀杨继军
李霞 李静 王永凤 董保霞 张美英 刘矿平 吴培秀 杨继军
帕金森(PD)是常见的中老年神经系统变性疾病,临床以静止性震颤、运动迟缓、肌强直和姿势步态异常为主要特征[1]。主要病理改变为中脑黑质DA能神经元逐渐变性死亡,纹状体 DA含量下降[2]。PD在我国65岁以上人群患病率为2.05%。随着人类平均寿命的延长和社会老龄化的到来,PD发病率呈明显上升趋势,成为影响人类身体健康和生活质量的重要疾病。
1 材料与方法
1.1 实验动物 选用清洁级4个月龄Wistar雄性大鼠,体重(200±20)g,由河北医科大学动物实验中心提供(合格证号:201103042)。动物喂养使用河北医科大学动物实验中心提供的大鼠基础饲料。在河北医科大学中医学院实验中心提供的清洁级动物实验房饲养,室温20~24℃,自然采光,通风良好。
1.2 实验针具及药物 华佗牌无菌不锈钢毫针,φ 0.30 mm ×13 mm;韩氏 (HANS)电针仪,型号LH202H,北京华卫产业开发公司;多巴丝肼片(美多芭),上海罗氏制药有限公司,批号H10930198,实验时采用0.9%氯化钠溶液配制成所需浓度的混悬液。
1.3 实验试剂与仪器 鱼藤酮(RoteNone),石家庄植物农药研究所,批号:SZYC20100113R,实验时采用二甲基亚砜配制成所需浓度的溶液;二甲基亚砜(DMSO),天津市凯通化学试剂有限公司,批号:Q/HG3144-99;免疫组化染色试剂盒,北京中杉金桥生物技术有限公司;HM-200型电子分析天平,日本AND;600型电热恒温水箱,天津;DW-40L262立式低温冷藏箱,青岛海尔医用低温科技有限公司;2035型LEICA切片机,德国;Citadel-2000包埋机英国姗顿公司;HMIAS-2000显微图像分析系统,武汉同济医科大学。
1.4 方法
1.4.1 分组:78只Wistar大鼠均自然光照,自由饮水进食,正常饲养1周后,根据参考文献[3]造模,随机选取58只作为模型组大鼠,采用颈、背部皮下注射鱼藤酮溶液 0.8 mg·kg-1·d-1(溶剂为二甲基亚砜,浓度为2 mg/ml)28 d制备PD大鼠模型;其余20只作为正常组注射等体积的溶剂。造模结束后,通过网格实验、悬挂实验和开阔实验对比模型组和正常组大鼠的行为学变化,模型组和正常组各随机选取10只剖杀,观察组织形态和神经生化变化,以判定造模成功与否。造模成功后将模型组大鼠随机分为模型组、西药组和电针组。
1.4.2 治疗方法:造模成功后,西药组大鼠每天给予美多芭混悬液灌胃 1.67 mg·kg-1·d-1(溶剂为0.9%氯化钠溶液,浓度为25 mg/ml);电针组大鼠每日按顺序给予治疗,将大鼠固定在自制束鼠器上,参照全国针灸学会实验针灸研究会制定的《实验动物针灸穴位图谱》,选百会、三阴交、太冲穴,三穴均用φ0.30 mm×13 mm毫针刺入,接韩氏电针仪,电针正极接一侧三阴交,负极接同侧太冲,双侧相同,采用疏密波,频率疏波 2 Hz、密波 80 Hz,强度 2.0 mA,10 min/次每天,西药组和电针组均7 d为1个疗程,共治疗2个疗程,疗程间休息1 d;除西药组外,其余各组均灌服等体积的0.9%氯化钠溶液;除电针组外,其余各组均采用同一体位固定10 min·次-1·d-1。治疗均由同一操作者操作。
1.4.3 取材:治疗结束后,观察大鼠包括悬挂实验、网格实验及开阔实验在内的行为学变化后,将大鼠脱臼处死取脑,左脑参照Paxinos和Watson鼠脑立体定位图谱,切取包含黑质的脑组织(前囟后5.0~5.2 mm处),放入备好的4%多聚甲醛的磷酸缓冲液中,固定1周以上。
1.4.4 行为学检测:悬挂实验:根据参考文献[4],将大鼠两前爪悬挂于距离地面1 m水平固定的绳子(直径2 mm,长100 cm)上,记录大鼠落地前的时间,3 s内大鼠跌落或仅一爪抓住绳子均属失败。根据参考文献评分:0~4 s评0分;5~9 s评1分;10~14 s评2分;15~19 s评3分;20~24 s评4分;25~29 s评5分;超过30 s评6分。每隔5 min测1次,共测3次。
1.4.5 网格实验:根据参考文献[5,6],选择与水平面垂直的独立金属网格(面积80 cm×50 cm,网格大小1 cm×1 cm)作为实验装置,将大鼠正立置于金属网格中央,使大鼠位置与地面垂直,各趾爪均抓住金属网格。用秒表记录大鼠由静止状态直至其任意一爪移动时所花的时间,即为大鼠移动潜伏期。每隔5 min测1次,共测3次。
1.4.6 开阔实验:根据参考文献[7],将大鼠放置在大鼠笼内,观察大鼠自主活动情况(持续150 s),计测大鼠两前肢离地累积的持续时间为大鼠直立时间;令大鼠四肢着地,头与身体均保持静止,计测其蹲于某一位置所积累时间,为大鼠静止性蹲坐时间。
1.4.7 中脑黑质TH免疫组化染色检查:将在4%多聚甲醛的磷酸缓冲液中固定1周以上的中脑黑质组织,经脱水、透明、石蜡包埋,切取6 μm厚的冠状切片,先行HE染色,光镜下观察中脑黑质组织形态学变化。再用S-P法行TH免疫组织化学染色,镜下观察TH阳性表达细胞。
1.5 统计学分析计量资料以表示,采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 4组大鼠行为学观察
2.1.1 悬挂实验:治疗前模型组、西药组和电针组评分值均低于正常组,差异有统计学意义(P<0.01);模型组、西药组和电针组之间比较差异无统计学意义(P>0.05)。治疗后模型组评分值低于正常组(P<0.01);电针组评分值均高于模型组(P<0.01);西药组评分值与模型组相比,差异无统计学意义(P>0.05);电针组评分值与西药组相比,差异无统计学意义(P>0.05)。见表1。
表1 4组大鼠悬挂实验评分比较分,±s
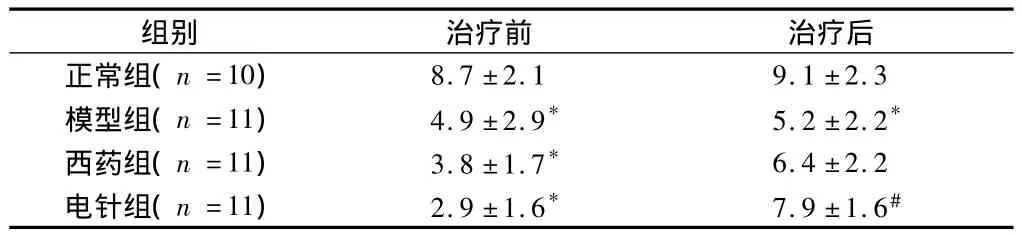
表1 4组大鼠悬挂实验评分比较分,±s
注:与正常组比较,*P <0.01;与模型组比较,#P <0.01
组别 治疗前 治疗后正常组(n=10)8.7 ±2.1 9.1 ±2.3模型组(n=11) 4.9 ±2.9* 5.2 ±2.2*西药组(n=11) 3.8 ±1.7* 6.4 ±2.2电针组(n=11) 2.9 ±1.6* 7.9 ±1.6#
2.1.2 网格实验:治疗前模型组、西药组和电针组大鼠移动潜伏期均高于正常组,差异有统计学意义(P<0.05);模型组、西药组和电针组之间比较差异无统计学意义(P>0.05)。治疗后模型组大鼠移动潜伏期大于正常组,差异有统计学意义(P<0.01);电针组低于模型组,差异有统计学意义(P<0.05);西药组与模型组相比,差异无统计学意义(P>0.05);电针组与西药组相比,差异无统计学意义(P>0.05)。见表2。
表2 4组大鼠网格实验潜伏期比较分,±s

表2 4组大鼠网格实验潜伏期比较分,±s
注:与正常组比较,*P <0.01;与模型组比较,#P <0.01
组别 治疗前 治疗后正常组(n=10)5.1 ±2.7 4.6 ±2.7模型组(n=11) 9.6 ±3.6* 9.7 ±3.7*西药组(n=11) 11.4 ±3.0* 7.7 ±3.4电针组(n=11) 8.9 ±2.7* 5.6 ±3.1#
2.1.3 开阔实验:治疗前模型组、西药组和电针组大鼠静止性蹲坐时间均高于正常组,站立时间均低于正常组,差异有统计学意义(P<0.01);模型组、西药组和电针组之间比较差异无统计学意义(P>0.05)。治疗后电针组和西药组大鼠静止性蹲坐时间均低于模型组,站立时间均高于模型组,差异均有统计学意义(P<0.01);电针组大鼠静止性蹲坐时间与西药组相比,差异无统计学意义(P>0.05),站立时间低于西药组,差异有统计学意义(P<0.01)。见表3、4。
表3 4组大鼠开阔实验-静止性蹲坐时间比较分,±s

表3 4组大鼠开阔实验-静止性蹲坐时间比较分,±s
注:与正常组比较,*P <0.01;与模型组比较,#P <0.01
组别 治疗前 治疗后正常组(n=10)21±22 30±23模型组(n=11) 97±36* 109±21西药组(n=11) 88±16* 37±22#电针组(n=11) 88±17* 51±9#
表4 4组大鼠开阔实验-站立时间比较分,±s

表4 4组大鼠开阔实验-站立时间比较分,±s
注:与正常组比较,*P <0.01;与模型组比较,#P <0.01;与西药组比较,△P <0.01
组别 治疗前 治疗后正常组(n=10)97±31 94±20模型组(n=11) 40±34* 23±16西药组(n=11) 34±20* 101±13#电针组(n=11) 24±26* 80±10#△
2.2 治疗后4组大鼠中脑黑质HE染色镜下观察
光镜下:正常组DA能神经元形态完整,细胞排列相对整齐;核呈圆形或锥形,大而清晰,核仁明显;神经纤维排列整齐,结构紧密。模型组神经元部分轻度肿胀,体积增大,细胞间隙增宽;细胞核形态不一,体积增大,偏居一侧,核仁不明显,神经纤维排列紊乱,结构疏松。电针组与模型组相比中脑黑质DA能神经元改善明显,神经元肿胀减少减轻,体积变小,细胞间隙变窄;细胞形态较规则,体积较正常,核仁较明显,神经纤维排列较整齐,结构较密集,西药组改善差于电针组,优于模型组。电针组、西药组均差于正常组。见图1~4。

图1 正常组(HE×100)

图2 模型组(HE×100)

图3 西药组(HE×100)
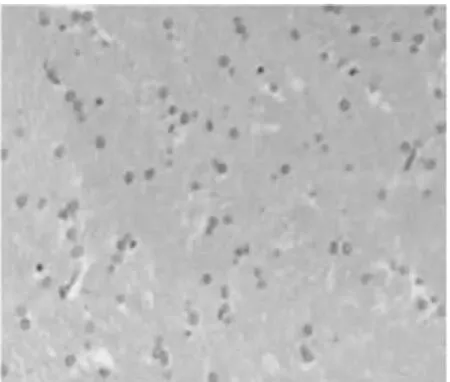
图4 电针组(HE×100)
2.3 治疗后4组大鼠中脑黑质TH免疫组化染色观察 正常组TH免疫反应阳性神经元呈棕褐色,密集分布,数量较多,胞体较大,神经元突起明显。模型组TH免疫反应阳性神经元数目明显减少,神经元胞体轮廓及突起不清晰。电针组与模型组相比TH改善明显,阳性神经元数目增多,神经元胞体轮廓及突起较清,西药组改善差于电针组,优于模型组。见图5~8。

图5 正常组(TH×400)

图6 模型组(TH×400)

图7 西药组(TH×400)

图8 电针组(TH×400)
3 讨论
PD的治疗中,L-DOPa替代疗法和各种外科手术能够在一定程度上改善患者症状,但不能阻止黑质DA能神经元的持续丢失,更不能恢复黑质DA能神经元数目;神经营养因子的使用,可以保护残存DA能神经元的功能;神经干细胞移植和基因治疗的研究,可以保护黑质DA能神经元免于死亡和恢复黑质DA能神经元数量,彻底逆转PD的病理状态,可能对PD的彻底治愈有所突破,期待有更好进展。近年,有关针刺治疗PD的实验研究和临床报道越来越多,有报道针灸能引起PD大鼠黑质和纹状体区神经干细胞发生显著增殖现象,且观察到在增殖的神经干细胞中有一部分转化为神经元[8],证实了针灸治疗PD的有效性。
DA是DA能神经元合成和释放的主要功能性神经递质,DA的合成过程以酪氨酸为底物,经过TH羟化,多巴脱羧酶脱羧而成。因而TH是酪氨酸转化成DA的关键限速酶,提高TH酶蛋白含量,促进L-DOPA生成,增加DA含量及释放量是治疗PD的策略之一。
本实验结果说明电针百会、太冲、三阴交穴可增加黑质TH阳性神经元的数量和纹状体DA的含量,对DA能神经元具有一定的保护作用。实验结果进一步证明电针PD大鼠的百会、太冲、三阴交穴,一方面通过针刺太冲、百会发挥熄风止颤的作用,改善PD大鼠的行为学变化,减轻PD大鼠的肌肉震颤、全身抖动、四肢僵直等症状,另一方面通过针刺百会、三阴交达到滋补肝肾,填精益髓目的,使脑髓得以充养,与实验结果中PD大鼠TH增加相吻合,从PD发病机制的角度证实了PD的发病与肾虚髓空的关系,为临床应用补肾养肝填髓,熄风通络止颤之法治疗PD提供了有力的实验依据。
1 李大年,焉传祝,迟兆富,等主编.现代神经内科学.第1版.济南:山东科学技术出版社,2004.488.
2 陈生弟,乐卫东,陈先文,等主编.帕金森病.第1版.北京:人民卫生出版社,2006.30.
3 陈忻,张楠,赵晖,等.鱼藤酮致帕金森病大鼠行为学与黑质病理损伤的关系.中国神经精神疾病杂志,2008,34:232-234.
4 Kuribara H,Higuchi Y,Tadokoro S.Effects of central depressants on rotarod and traction performances in mice.Jpn J Pharmacol,1977,27:117-126.
5 何德富,张贝,王键,等.鱼藤酮和哒螨灵慢性暴露对大鼠的神经毒性作用.中国老年学杂志,2005,25:1099-1101.
6 Betarbet R,Sherer TB,MacKenzie G,et al.Chronic systemic pesticide exposure reproduces features of Parkinson's disease.Nat Neurosci,2000,3:1301-1306.
7 Maingay M,Romero-Ramos M,Carta M,et al.Ventral tegmental area dopamine neurons are resistant to human mutant alpha-synuelein overexpression.Neurobiol Dis,2006,23:522-532.
8 王彦春,马骏,王华.“双固一通”法对帕金森病模型大鼠神经干细胞增殖及分化的影响.中国针灸,2006,26:277-282.
