双氢青蒿素对C2株蓝氏贾第鞭毛虫Alpha-7.3 giardin基因mRNA表达水平的影响
2014-04-02李巍伟赵丽娜刘阿倩林志强田喜凤
余 源,陈 阳,葛 爽,王 洋,李巍伟,赵丽娜,刘阿倩,林志强,高 雪,田喜凤
蓝氏贾第鞭毛虫(Giardialamblia,简称贾第虫) 寄生于人和多种哺乳动物的小肠内,引起以腹泻为主要症状的蓝氏贾第鞭毛虫病(giardiasis, 简称贾第虫病)[1]。贾第虫地理分布广泛,有多种动物宿主,因此可通过粪便、被污染的水源、食物进行传播。本病已被列为全世界危害人类健康的10种主要寄生虫病之一。在发达国家和发展中国家均有广泛流行[2-3]。以往国内对其危害性未能引起足够的重视,实验研究起步较晚,在70年代以前一直处于空白状态,至80年代始开展了具有实质性的研究。随着国内学者对其认识的不断深入,研究也不断丰富了起来[4-5]。贾第虫双核、具有鞭毛,其腹部的吸盘是吸附小肠的主要结构,主要成分是细胞骨架蛋白。Crossley和Holberton[6-7]首次提出贾第素是贾第虫细胞骨架的特有成分。贾第素分为4大类, 即α、β、γ和δ贾第素[8-10]。pathuri等[11]发现所有α-贾第素都可能是进化过程中膜联蛋白的代表,并且很可能具有保守的关键结构域,而行使相似的功能。研究表明,细胞骨架蛋白与贾第虫吸附宿主肠上皮并导致腹泻密切相关。因此,对蓝氏贾第鞭毛虫α-贾第素的研究有一定的临床应用前景。本研究采用含有双氢青蒿素的改良TYI-S-33培养基培养C2株蓝氏贾第鞭毛虫,实时荧光定量RT-PCR检测双氢青蒿素对C2株蓝氏贾第鞭毛虫Alpha -7.3 giardin基因mRNA表达水平的影响,为蓝氏贾第鞭毛虫的防治提供了有价值的参考资料。
1 材料与方法
1.1材料 双氢青蒿素粉剂(原药批号010904)为北京丰台科技园生物技术公司藤海宁女士惠赠;C2株贾第虫由本实验室保存;组织/细胞基因组RNA提取试剂盒购自Invitrogen;引物由生工生物工程(上海)公司合成;dNTP, SYBR® Premix Ex TaqTMReal-Time PCR试剂盒购自TaKaRa公司;M-LMV 逆转录酶,RNase inhibitor,Random Primers购自Promega公司;焦碳酸二乙酯(DEPC)购自上海生工生物技术有限公司。
1.2方法
1.2.1虫体的复苏培养 蓝氏贾第鞭毛虫C2株, 由首都医科大学寄生虫学教研室提供,本室用液氮冷冻保种,将液氮内冻存的C2株贾第虫复苏,置含改良TYI-S-33培养基的4 mL硼酸硅培养管内,于37 ℃培养。48~72 h后,虫体即呈对数生长期。选取虫体生长旺盛的培养管,置4 ℃冰浴,15 min后取出,在双手掌间多次滚搓培养管,使贴壁生长的虫体完全自管壁脱落。用血球计数板计数虫数,再用培养基将虫液浓度调为6×106~10×106个滋养体/mL[12],传代培养。
1.2.2药物试验及虫体总RNA提取 待虫体生长至对数期,选取虫体贴满瓶壁的培养管,培养基内分别加入100 μg/mL 、200 μg/mL双氢青蒿素[13];对照组培养基内不加药,37 ℃分别培养2 h、4 h、8 h、12 h后,收集虫体,用血球计数板计数虫数,用培养基将虫液浓度调至1×107个滋养体/mL; 取1 mL 虫液,用PBS(pH7.4)清洗3次,4 000 r/min离心10 min,弃上清,留沉淀。
加入1 mL Trizol(Invitrogen)裂解虫体,迅速吸入无RNase的1.5 mL eppendorf离心管中,按照Invitrogen Trizol RNA提取说明书提取总RNA,通过紫外分光光度法鉴定总RNA的纯度,1%琼脂糖凝胶中电泳鉴定提取质量。
1.2.3cDNA的合成 以各组提取的总RNA为模板,进行反转录。建立20 μL反转录体系:总RNA 8 μL,Random Primers(100 ng/μL) 1 μL,10 mmol/L dNTP 1 μL,RNase inhibitor 1 μL,M-MLV 1 μL,5×反应缓冲液4 μL,DEPC处理水补至20 μL;反转录条件:70 ℃变性5 min,42 ℃反转录60 min,即得cDNA,-80 ℃保存备用。
1.2.4引物设计 分别设计Alpha -7.3 giardin及GAPDH(内参基因)引物,引物设计参考GenBank报道的蓝氏贾第鞭毛虫Alpha -7.3 giardin (XM_001708403.1)和GAPDH (XM_001704991.1)基因序列,采用Primer Premier 5软件设计特异性引物,引物由生工生物工程(上海)公司合成(表1)。

表1 Alpha -7.3 giardin和GAPDH引物序列
1.2.5Real-Time PCR 采用Corbett实时荧光定量PCR仪,以贾第虫磷酸甘油醛脱氢酶基因(GAPDH)为内参基因,cDNA为模板,分别以Alpha-7.3 giardinS/Alpha-7.3 giardinA; GAPDHS/GAPDHA为引物进行实时定量PCR反应,每个样品均做2个重复反应。反应体系:cDNA 1 μL,2×SYBR MIX 10 μL,Prime S 1 μL,Prime A 1 μL,DEPC H2O 7 μL,反应条件:95 ℃变性15 s,60 ℃复性15 s,72 ℃延伸15 s,并对结果进行Delta Delta CT分析。
2 结 果
2.1总RNA提取结果 利用Invitrogen TRIzol提取双氢青蒿素培养的不同组蓝氏贾第鞭毛虫总RNA,各组OD260/OD280值均在1.8~2.0范围内,总RNA提取质量符合实验要求。
2.2Real-Time PCR检测结果 采用双氢青蒿素浓度为100 μg/mL、200 μg/mL的改良TYI-S-33培养基分别培养C2株蓝氏贾第鞭毛虫2 h、4 h、8 h、12 h后,以不含药物组为对照,实时荧光定量RT-PCR检测双氢青蒿素对C2株蓝氏贾第鞭毛虫Alpha-7.3 giardin基因mRNA的表达量(图1-4),Delta Delta CT法分析Alpha-7.3 giardin基因mRNA的相对表达量(表2),双氢青蒿素浓度为100 μg/mL,分别培养2 h、4 h、8 h、12 h后,Alpha-7.3 giardin基因mRNA相对表达量为0.95,0.91,0.60,0.03;双氢青蒿素浓度为200 μg/mL,分别培养2 h、4 h、8 h、12 h后,Alpha-7.3 giardin基因mRNA相对表达量为0.56,0.46,0.23,0.06;实验结果表明双氢青蒿素对C2株蓝氏贾第鞭毛虫Alpha-7.3 giardin基因mRNA的表达具有明显的抑制作用,抑制效果与药物浓度和作用时间相关,提示双氢青蒿素对蓝氏贾第鞭毛虫骨架蛋白具有损伤作用。

图1 Alpha-7.3 giardin mRNA 实时RT-PCR扩增曲线

图2 Alpha-7.3 giardin mRNA 实时RT-PCR熔解曲线

图3 GAPDH mRNA 实时RT-PCR扩增曲线

图4 GAPDH mRNA 实时RT-PCR熔解曲线
3 讨 论
定量PCR是在PCR定性技术基础上发展起来的核酸定量技术。实时荧光定量PCR 技术( real-time fluorescent quantitative PCR, FQ-PCR) 于1996年由美国Applied Biosystems公司推出,它是一种在PCR反应体系中加入荧光基团,利用荧光信号积累实时监测整个PCR进程[14-15],该技术不仅实现了对DNA模板的定量, 而且具有灵敏度高、特异性和可靠性更强、能实现多重反应、自动化程度高、无污染性、具实时性和准确性等特点, 目前已广泛应用于分子生物学研究和医学研究等领域。荧光实时定量RT-PCR技术能够实时检测记录PCR扩增产物的增加,克服了终点法定量PCR产物的不足,使准确定量RNA成为现实[16-17]。荧光实时RT-PCR 定量基因表达常采用两类方法,即绝对定量和相对定量。绝对定量法需要构建载体,制作标准曲线;相对定量通常以表达恒定的看家基因作为参照,来获得目的基因相对于参照基因的表达指数。实验组与正常对照组目的基因表达指数的比值就代表目的基因的相对表达量,反映实验组基因表达的变化情况[18]。
本研究采用含有不同浓度双氢青蒿素的改良TYI-S-33培养基分别以不同时间培养C2株蓝氏贾第鞭毛虫,以贾第虫磷酸甘油醛脱氢酶基因(GAPDH)作为内参基因,实时荧光定量RT-PCR检测双氢青蒿素对C2株蓝氏贾第鞭毛虫Alpha -7.3 giardin基因mRNA表达水平的影响。研究结果表明,经含有双氢青蒿素的培养基培养贾第虫后,蓝氏贾第鞭毛虫Alpha -7.3 giardin基因mRNA的表达具有明显的抑制作用,抑制效果与药物浓度和作用时间相关,揭示了双氢青蒿素对蓝氏贾第鞭毛虫骨架蛋白具有损伤作用,这一结果与蓝氏贾第鞭毛虫骨架蛋白双向电泳质谱结果相吻合[19]。由于蓝氏贾第鞭毛虫腹部的吸盘是吸附小肠的主要结构,其主要成分是细胞骨架蛋白,因此双氢青蒿素对蓝氏贾第鞭毛虫具有明显的防治效果,本研究为以蓝氏贾第鞭毛虫细胞骨架成分作为新药物开发的靶分子的进一步研究提供了有价值的参考资料。
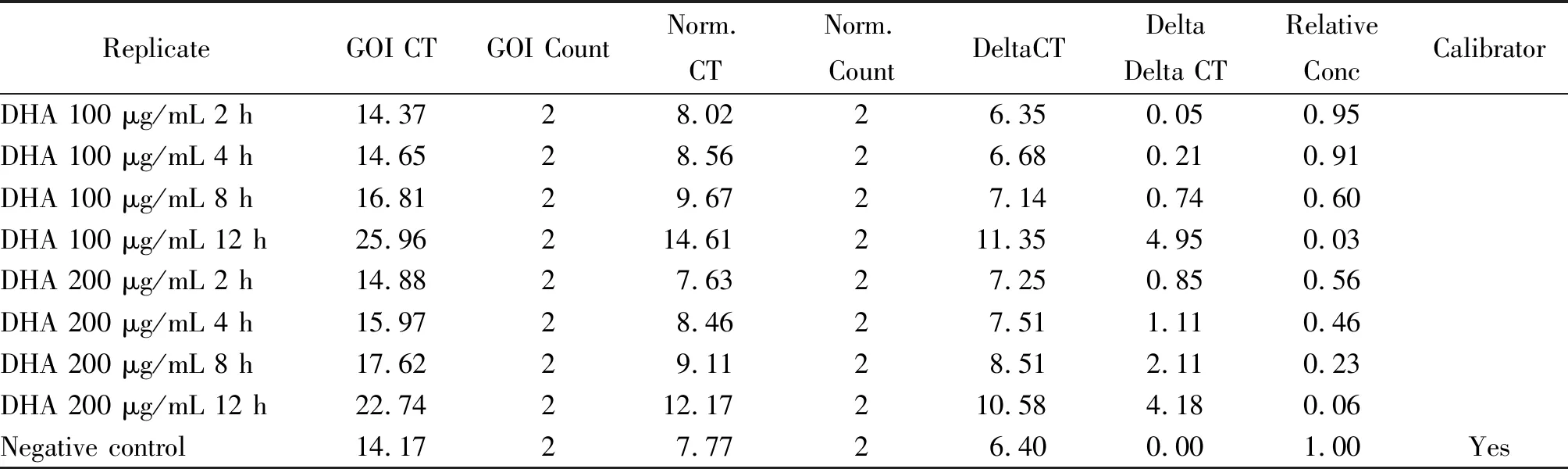
表2 DHA作用后Alpha -7.3 giardin基因mRNA表达量分析结果
参考文献:
[1]Adam RD. Biology ofGiardialamblia[J]. Clin Microbiol Rev, 2001, 14(3): 447-475.
[2]Lu SQ. Domestic research ofGiardialamblia[J]. Acta Parasitologica Et Medica Entomologica Sinica, 1999, 6(4): 193-200. (in Chinese)
卢思奇.国内蓝氏贾第鞭毛虫研究[J].寄生虫与医学昆虫报,1999,6(4):193-200.
[3]Sandhu H, Mahajan RC, Ganguly NK. Flow cytometric assessment of the effect of drugs onGiardialambliatrophozoitesinvitro[J]. Mol Cell Biochem, 2004, 265: 151-160.
[4]Gardner TB, Hill DR. Treatment of giardiasis[J]. Clin Microbiol Rev, 2001, 14(1): 114-128. DOI: 10.1128/CMR.14.1.114-128.2001
[5]Tian XF, Lu SQ. Cytoskeleton ofGiardialamblia[J]. World Chin J Digestol, 2005, 13(12): 1434-1436. (in Chinese)
田喜凤,卢思奇.蓝氏贾第鞭毛虫的细胞骨架[J].世界华人消化杂志, 2005, 13(12): 1434-1436.
[6]Crossley R, Holberton DV. Characterization of proteins from the cytoskeleton ofGiardialamblia[J]. J Cell Sci, 1983, 59: 81-103.
[7]Holberton DV, Ward AP. Isolation of the cytoskeleton from Giardia. Tubulin and a low-molecular-weight protein associated with microribbon structures[J]. J Cell Sci, 1981, 47: 139-166.
[8]Kim J, Goo SY, Chung HJ, et al. Interaction of beta giardin with the Bop1 protein inGiardialamblia[J]. Parasitol Res, 2006, 98(2): 138-144. DOI: 10.1007/s00436-005-0040-8
[9]Nohria A, Alonso RA, Peattie DA. Identification and characterization of gamma-giardin and the gamma-giardin gene fromGiardialamblia[J]. Mol Biochem Parasitol, 1992, 56: 27-37. DOI: 10.1016/0166-6851(92)90151-9
[10]Jenkins MC, O’Brien CN, Murphy C, et al. Antibodies to the ventral disc protein delta-giardin preventinvitrobinding ofGiardialambliatrophozoites[J]. J Parasitol, 2009, 95(4): 895-899. DOI: 10.1645/GE-1851R.1
[11]Pathuri P, Nguyen ET, Luecke H, et al. Expression, purification, crystallization and preliminary X-ray diffract ion analysis of alpha-11 giardin fromGiardialamblia[J]. Acta Crystallogr Sect F Struct Biol Cryst Commun, 2006, 62(11): 1108-1112. DOI: 10.1107/S1744309106039650
[12]He B, Liu GW, Cao L, et al.Invitroidentification of the cytoskeleton proteins ofGiardialambliausing a MS technique[J]. J Pathog Biol, 2010, 5(12): 898-900. (in Chinese)
何冰, 刘广伟, 曹蕾,等.质谱技术鉴定体外蓝氏贾第鞭毛虫的细胞骨架蛋白[J].中国病原生物学杂志,2010,5(12):898-900.
[13]Tian XF, Lu SQ, Liu YM, et al. Effect of dihydroartemisinin on ultra structure ofGiardiaLambliainvitro[J]. Chin J Parasitol Parasit Dis, 2005, 23(5): 292-295. (in Chinese)
田喜凤,卢思奇,刘业民, 等.双氢青蒿素对体外蓝氏贾第鞭毛虫的损伤[J].中国寄生虫学与寄生虫病杂志, 2005, 23(5):292-295.
[14]Ouyang SY, Yang D, Ouyang HS, et al. Real-time fluorescent quantitative PCR and application[J]. Chem Life, 2004, 24(1): 74-76. (in Chinese)
欧阳松应, 杨冬, 欧阳红生, 等.实时荧光定量PCR技术及其应用[J].生命的化学, 2004, 24(1): 74-76.
[15]Zhao JH, Bao JF. The principle and application research progress of real-time fluorescent quantitative PCR[J]. Chin J Histochem Cytochem, 2007, 16(4): 492-497. (in Chinese)
赵焕英, 包金风.实时荧光定量PCR技术的原理及其应用研究进展[J].中国组织化学与细胞化学杂志,2007,16(4):492-497.
[16]Bustin SA. Absolute quantification of mRNA using real-time reverse transcription polymerase chain reaction assays[J]. J Mol Endocrinol, 2000, 25(2): 169-193. DOI: 10.1677/jme.0.0250169
[17]Giulietti A, Overbergh L, Valckx D, et al. An overview of real-time quantitative PCR: applications to quantify cytokine gene expression[J]. Methods, 2001, 25(4): 386-401. DOI: 10.1006/meth.2001.1261
[18]Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2 (-Delta Delta C (T)) method[J]. Methods, 2001, 25(4): 402-408. DOI: 10.1006/meth.2001.1262
[19]Yu Y, Chen Y, Yang ZH, et al. Effects of dihydroartemisinin on protein ofGiardialambliatrophozoites[J]. Chin J Zoonoses, 2010, 26(11): 995-997. (in Chinese)
余源, 陈阳, 杨志宏, 等.双氢青蒿素对蓝氏贾第鞭毛虫滋养体蛋白质的损伤[J]. 中国人兽共患病学报, 2010, 26 (11):995-997.
