ICOS转基因小鼠感染日本血吸虫后HSCs活化效应及对肝纤维化的影响
2014-04-02董兰兰王言言夏超明
梁 松,王 波,许 静,董兰兰,王言言,赵 波,夏超明
血吸虫病是以虫卵诱发宿主肉芽肿反应及继发纤维化为特征的免疫病理性疾病。血吸虫病肝纤维化是一个机体纤维合成和基质降解失衡的动态变化过程,可导致门静脉高压、肝硬化、腹水等并发症[1-2]。HSCs的活化已被认为是肝纤维化发展过程中的重要环节,其活化、增殖以致发生表型和功能的改变,转化为肌成纤维细胞,并大量合成以Ⅰ型、Ⅲ型胶原为主的细胞外基质(extracellular matrix,ECM),超过了机体的降解能力,使ECM在肝内过量沉积导致纤维化形成[3-4]。课题组前期研究已表明,ICOSL/ICOS信号介导的Th2极化与感染日本血吸虫导致的肝纤维化有关[5-6]。在此基础上,本实验通过观察ICOS-Tg小鼠原代HSCs活化及其对肝纤维化形成的影响,进一步探讨ICOSL/ICOS信号在血吸虫病肝纤维化中的作用机制。
1 材料与方法
1.1材料
1.1.1实验动物 由扬州大学比较医学中心提供遗产背景品系为FVB/NJ的ICOS-Tg小鼠,所有实验小鼠均置于苏州大学实验动物中心SPF实验动物大楼中饲养,采用自动温度控制(22±1)℃,自动光控(12 h明/12 h暗),自由进食及饮用洁净水。日本血吸虫尾蚴阳性钉螺购自江苏省血吸虫病防治研究所。
1.1.2试剂 Collagenase Type Ⅰ(Gibco)、Pronase E(Roche)、DNase Ⅰ(Sigma)、Optiprep细胞分离液(Axis-shield)、RPMI-1640培养基和低糖DMEM培养基(Hyclone)、胎牛血清(Gibco)、Triton X-100(Amresco)、Hepes和EGTA(Solarbio)、GFAP抗体和SABC-CY3(武汉博士德)、Trizol(Invitrogen)、DEPC水(上海生工生物)、PrimeScriptTMRT reagent Kit和SYBR Premix Ex TaqTM(TaKaRa)、TGF-β1,Ⅰ、Ⅲ型胶原、α-SMA mRNA和内参基因β-actin mRNA(华大基因)等。
1.1.3主要仪器 津腾容剂过滤器和津腾隔膜真空泵GM-0.33A(天津津腾实验设备有限公司);BT-100型蠕动(恒流)泵YZ9901(上海青浦沪西仪器厂);恒温混匀仪TZL-200(苏州帕西瓦尔实验设备有限公司);Olympus CX31显微镜(日本Olympus);Olympus C-7070照相机(日本Olympus);Eppendorf PCR扩增仪(德国Eppendorf公司);Step One Plus Real-Time PCR Systerm (美国ABI);活细胞工作站(德国Leica);倒置相差显微镜(日本Olympus);Nanodrop 2000超微量分光光度计(美国Thermo)。
1.1.4主要试剂 灌注液Ⅰ:氯化钠8.0 g,氯化钾0.402 g,二水磷酸二氢钠0.093 6 g,十二水磷酸氢二钠0.286 5 g,HEPES 2.383 g, EGTA 0.190 g,碳酸氢钠0.352 8 g,葡萄糖0.901 g,pH7.2~7.4。灌注液Ⅱ:0.04% CollagenaseⅠ,加 RPMI-1640至100 mL,pH7.2~7.4。振荡消化液: 0.08% CollagenaseⅠ,0.08% Pronase E, 5U/mL DNaseⅠ,加RPMI-1640至100 mL,pH7.2~7.4。所有溶液均需0.22 μm过滤除菌,并且在37℃培养箱中预热后使用。
1.2方法
1.2.1实验动物模型的建立 将钉螺置于洁净的去氯水中,25 ℃,光照下逸出日本血吸虫尾蚴,每只小鼠经腹部皮肤感染15±1条尾蚴,实验小鼠均在SPF级动物房饲养。
1.2.2HSCs的分离 腹腔注射水合氯醛麻醉小鼠,待小鼠麻醉后,将其浸泡于75%酒精15 s,将其固定于解剖台上,打开腹腔,暴露肝门静脉,从门静脉插管,灌注灌注液Ⅰ,同时剪短下腔静脉,待肝脏变成土黄色后,更换灌注液Ⅱ进行灌注5~7 min,将肝脏游离至事先加入5 mL RPMI-1640培养基的平皿中;继续灌注,直至肝脏呈糜烂状后停止灌注,撕除肝包膜,尽量撕碎肝组织,去除结缔组织,将肝组织倒入装有20 mL振荡消化液的50 mL离心管中,37 ℃振荡消化20~30 min;终止消化,200目尼龙筛网过滤,收集细胞悬液,400 r/min×6 min,取上清;2 000 r/min×6 min,弃上清,5 mL RPMI-1640洗涤两次,之后加入1.5 mL RPMI-1640重新悬浮细胞,待用;于50 mL离心管中分别缓慢加入4 mL 16%梯度分离液、4mL 12%梯度分离液,最后小心加入上述细胞悬液;离心,4 000 r/min×20 min;吸取目的层细胞,加入RPMI-1640离心洗涤2次后重悬计数。
1.2.3HSCs的培养 RPMI-1640重悬细胞后,然后以1×106个细胞接种于25 cm2透气培养瓶中,含15%低糖DMEM完全培养基,37 ℃,5%CO2培养箱培养。24 h后第1次换液,以后每48 h换培养液1次。
1.2.4分离细胞的鉴定
1.2.4.1台盼蓝计数 将适量洗涤好的细胞悬液用台盼蓝染色后,置于显微镜下观察计数,计算细胞的成活率。
1.2.4.2小鼠原代HSCs自发荧光检测 将分离出的新鲜小鼠HSCs置于培养皿中,应用倒置荧光显微镜相差模式观察其细胞形态,并在波长为328nm的紫外激发光下观察细胞蓝绿色自发荧光。
1.2.4.3神经胶质原纤维酸性蛋白(GFAP)免疫细胞化学实验 将培养5 d的HSCs用兔抗小鼠GFAP(Glial fibrillary acidic protein )一抗、生物素化羊抗兔IgG二抗和SABC-Cy3进行免疫荧光染色,检测GFAP表达,计算细胞的纯度。
1.2.4.4原代HSCs总RNA抽提及cDNA的合成 将小鼠不同病期原代HSCs以1×106个/mL的密度接种于6孔细胞培养板中,15%低糖DMEM完全培养基,37 ℃,5%CO2培养箱培养7 d后收集细胞。细胞总RNA的抽提:参照MIQE法则确保实时荧光定量PCR检测结果的准确[7]。将原代培养7 d HSCs培养瓶中的培养基倒净,用预冷的PBS 5 mL洗涤3 min,2次,加入1 mL预冷的TRIzol试剂,室温静置10 min,充分吹打至无明显细胞团块,使细胞充分裂解;将细胞裂解液转入灭菌的无Rnase的带盖1.5 mL Ep管中,室温静置15 min;加入200 μL的氯仿,剧烈振荡30 s后,室温静置5~10 min。4 ℃、12 000 r/min离心15 min,使Ep管中液体分为3层,上层为含RNA水相,中间为DNA,下层为含蛋白质的有机相,转移上层水相至另一个新的灭菌无Rnase的带盖1.5 mL Ep管中,加入等体积的异丙醇,上下颠倒充分混匀,室温静置10 min。4 ℃、12 000 r/min离心15 min。弃上清,沉淀中加入1mL -20 ℃预冷的75%酒精(DEPC水配制)洗涤除盐,振荡30 s,4℃、7 000 r/min离心5 min,2次。小心弃上清,再离心数秒,用灭菌无Rnase的枪头吸去多余液体,空气干燥10 min,用20 μL DEPC水溶解RNA沉淀。所有RNA样品在Nanodrop 2000超微量分光光度计下测定其OD260/OD280的比值,范围在1.8~2.0,以保证待测RNA浓度、纯度及完整性。
每组取RNA 1μL进行逆转录反应合成cDNA,按PrimeScriptTMRT reagent Kit试剂盒说明书操作步骤进行,制备足够的cDNA用作荧光定量PCR的模板。反应体系20:5×PrimeScript Buffer(for Real Time) 4 μL;PrimeScript RT Enzyme Mix Ⅰ1 μL;Oligo dT Primer(50 μm) 1μL;Random 6 mers(100 μm) 1 μL;RNA模板2 μL;RNase Free dH2O 11 μL;总体积20 μL。反转录后cDNA在Nanodrop 2000超微量分光光度计下测定其OD260/OD280的比值,然后每个样本浓度稀释成300 ng/μL作为定量模板,-80 ℃储存。
1.2.4.5实时荧光定量PCR(Real-time Quantitative PCR, qRT-PCR) qRT-PCR法采用SYBR染料在ABI Step One Plus Real-Time PCR Systerm上进行。PCR反应体系20 μL;体系内含cDNA模板2 μL,SYBR Premis Ex Taq(Tli RNaseH Plus)(2×)10 μL,上、下游引物各0.4 μL,ROX Reference Dye(50×)0.4 μL,dH2O 6.8 μL, 95 ℃,10 min;40个循环(95 ℃,15 s;60℃,1 min)。为了建立PCR产物的溶解曲线,扩增反应结束后,95 ℃,15 s;60 ℃,1 min;95 ℃,15 s 。每个样本重复测定3次。实验所用的引物序列见表1。

表1 实时荧光定量PCR检测基因和内参基因的引物
1.2.6标准曲线制作 将任意一感染周期原代HSCs的cDNA,进行5倍梯度稀释,设定cDNA浓度300 ng/μL时为1,分别稀释为1×5-1,1×5-2,1×5-3,1×5-4,1×5-5,1×5-6这几个梯度浓度的cDNA样本,每个浓度梯度设置三个复孔,qRT-PCR测定各基因的Ct值,绘制得到标准曲线。各基因的标准曲线方程见表2。

表2 基因标准曲线方程

2 结 果
2.1ICOS-Tg小鼠HSCs分离、鉴定及培养
2.1.1ICOS-Tg小鼠HSCs分离与鉴定 见1-A,为活细胞工作站下观察HSCs形态(×400)。根据HSCs具有自发荧光的特性,倒置荧光显微镜在波长为328 nm的紫外激发光下观察HSCs并拍照(图1-B),台盼蓝拒染法鉴定HSCs成活率在95%以上。小鼠原代HSCs培养至第5 d,进行HSCs特异性表达蛋白GFAP免疫荧光细胞化学染色,结果表明:HSCs细胞浆中呈现红色荧光(图1-D),鉴定其分离纯度为90%以上(显微镜下随机取10个视野,计算所有GFAP阳性的细胞占所有细胞的比例,然后取平均值)。
2.1.2ICOS-Tg小鼠HSCs培养 如图2,为倒置显微镜下分别于培养1 d、3 d、7 d后观察新鲜分离的HSCs形态(光镜×400)。刚分离的HSCs呈圆形,1 d后大多数细胞贴壁,呈圆形或椭圆形(图2-A);3 d后细胞体积增大,细胞开始伸展伸出伪足呈星形,并且细胞开始增殖(图2-B);7 d后细胞继续伸展并增殖,绝大部分细胞呈星形,并且达到50%聚集(图2-C)。
2.2ICOS-Tg小鼠感染日本血吸虫不同病期与HSCs活化相关基因α-SMA的表达 感染日本血吸虫后,小鼠原代HSCs中α-SMA基因的表达水平自感染后4 w开始上升(0.706±0.012,gene/β-actin),感染后6 w(0.954±0.010,gene/β-actin)、9 w(1.078±0.009,gene/β-actin)仍处于逐渐升高趋势。ICOS-Tg小鼠HSCs中α-SMA基因的表达水平在感染后6 w(0.954±0.010vs0.843±0.011, gene/β-actin,▼P<0.01)、9 w(1.078±0.009vs0.947±0.011, gene/β-actin,▼P<0.01)显著高于同时期野生型小鼠HSCs中的水平, 见图3。
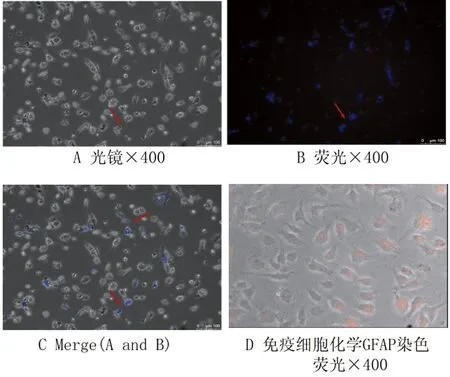
图1肝星状细胞(HSCs)的纯度和活率鉴定
Fig.1Identificationoffreshlyisolatedhepaticstellatecells(HSCs)
A: Virtually all cells examined under light microscopy;
B: Immediately after cell isolation, exhibited characteristic autofluorescence under ultraviolet excitation at 328-nm wavelength;
C: Merge A and B;
D: Immunocytochemical staining demonstrates expression of GFAP, which was a specific marker of HSC not expressed in other liver cell types
Original magnification×400
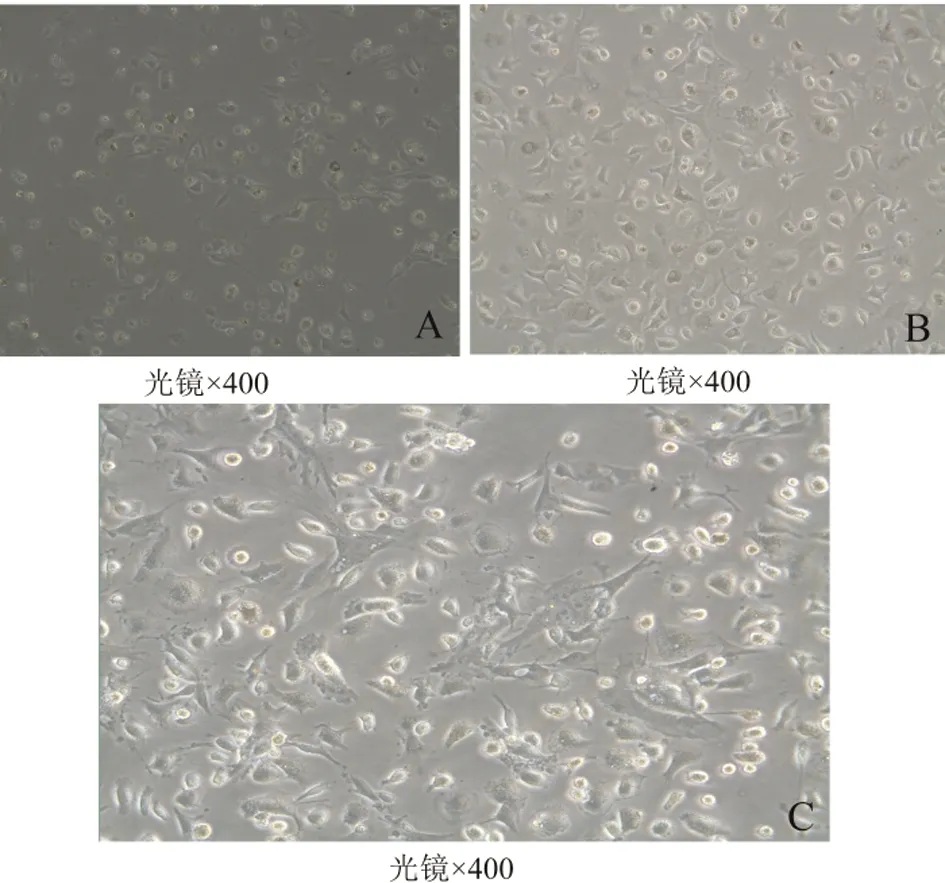
图2培养的原代肝星状细胞(HSCs)于倒置显微镜下观察(×400)
Fig.2PrimaryHSCsculturedonplasticfor1day(A),3days(B)or7days(C)
At each time point, cells were examined under phase contrast photomicrograph (Original magnification, ×400).
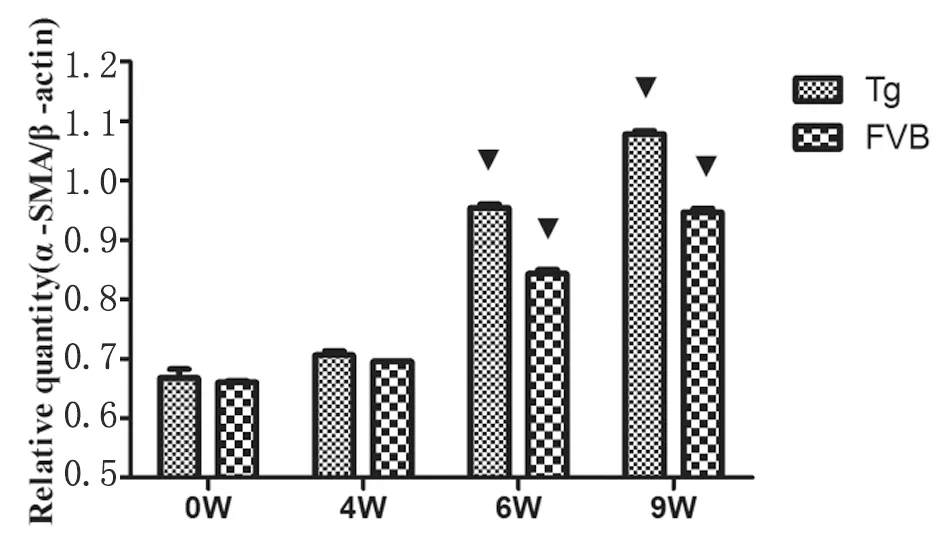
图3ICOS-Tg小鼠感染不同病期HSCs中α-SMA基因的表达水平
(注:ICOS-Tg vs FVB/NJ,▼P<0.01。)
Fig.3Expressionofα-SMAgeneonHSCsofICOS-Tgmiceindifferentinfectionstages
ICOS-Tg vs FVB/NJ,▼P<0.01.
2.3ICOS-Tg小鼠感染日本血吸虫不同病期HSCs中与肝纤维化相关基因的表达
2.3.1ICOS-Tg小鼠感染不同病期HSCs中TGF-β1基因的表达 日本血吸虫感染后,随着病程的迁移,小鼠原代HSCs中TGF-β1基因的表达自感染后4 w、6 w、9 w呈逐渐升高趋势(0.760±0.067~1.138±0.101,gene/β-actin)。ICOS-Tg小鼠原代HSCs中TGF-β1基因表达水平(0.724±0.009~1.138±0.101vs0.709±0.019~0.919±0.019, gene/β-actin)均高于同时期野生型小鼠的水平,且在感染后6 w(0.940±0.011vs0.795±0.008, gene/β-actin,▼P<0.01)、9 w(1.138±0.101vs0.919±0.019, gene/β-actin,●P<0.05)显著升高,见图4。

图4ICOS-Tg小鼠感染不同病期HSCs中TGF-β1基因的表达水平
(注:ICOS-Tg vs FVB/NJ,●P<0.05,▼P<0.01。)
Fig.4ExpressionofTGF-β1geneonHSCsofICOS-Tgmiceindifferentinfectionstages
ICOS-Tg vs FVB/NJ,●P<0.05,▼P<0.01.
2.3.2ICOS-Tg小鼠感染不同病期HSCs中Collagen-Ⅰ基因的表达 日本血吸虫感染后,随着病程的迁移,小鼠原代HSCs中Collagen-Ⅰ基因的表达自感染后4 w、6 w、9 w呈逐渐升高趋势(0.621±0.106~1.093±0.027,gene/β-actin)。ICOS-Tg小鼠原代HSCs中Collagen-Ⅰ基因表达水平(0.593±0.005~1.093±0.027 vs 0.551±0.007~0.832±0.013, gene/β-actin)均高于同时期野生型小鼠的水平,且在感染后6 w(0.931±0.018vs0.731±0.003, gene/β-actin,▼P<0.01)、9 w(1.093±0.027vs0.832±0.013, gene/β-actin,▼P<0.01)显著升高, 见图5。
2.3.3ICOS-Tg小鼠感染不同病期HSCs中Collagen-Ⅲ基因的表达 日本血吸虫感染后,随着病程的迁移,小鼠原代HSCs中Collagen-Ⅲ基因的表达自感染后4 w、6 w、9 w呈逐渐升高趋势(0.312±0.004~0.576±0.002,gene/β-actin)。ICOS-Tg小鼠原代HSCs中Collagen-Ⅲ基因表达水平自感染后6 w(0.444±0.008vs0.347±0.003, gene/β-actin,▼P<0.01)、9 w(0.576±0.002vs0.446±0.013, gene/β-actin,▼P<0.01)显著高于同时期野生型小鼠的水平, 见图6。
3 讨 论
血吸虫导致的主要免疫病理病变是肝脏虫卵肉ICOS-Tg vs FVB/NJ,▼P<0.01.
芽肿和肝纤维化[3,8]。急性期患者伴有发热,腹泻,血液中嗜酸性粒细胞增多等症状;慢性期患者以肝、脾肿大为主;晚期则以肝纤维化为主,可发展成为门静脉高压症,巨脾和肝硬化。血吸虫感染宿主后,所引发的免疫应答反应既有Th1型应答又有Th2型应答,但在感染的不同阶段会引起宿主Th1/Th2亚群的免疫偏移,即由Th1型应答向Th2型应答转变[9]。在血吸虫感染早期,此时宿主体内的免疫应答以Th1型应答为主,Th1型应答有利于杀伤侵入宿主体内的血吸虫童虫,并对组织内虫卵肉芽肿的形成和发展具有抑制作用;而在血吸虫产卵后,虫卵抗原引起Th1型细胞凋亡,因此,Th2型免疫应答逐渐占据了优势,宿主的免疫应答逐渐由Th1型向Th2型极化偏移[10]。已有研究表明在血吸虫感染小鼠慢性病变过程中共刺激分子ICOS高表达与宿主Th2极化密切相关[11-12,5]。目前研究认为,HSCs不仅是肝脏炎症反应的靶细胞,同时也是关键的效应细胞,并且HSCs在肝脏的免疫调节和免疫抑制中起到重要作用,HSCs可由特异性的T淋巴细胞亚群激活,同时HSCs还表现出抗原递呈细胞刺激淋巴细胞增生与激活T细胞反应[13]。CD4+CD25+调节性T细胞(Treg)促进HSCs活化增殖并促进其分泌HA[14]。提示Th亚群的极化可介导HSCs活化效应,影响纤维化的形成。

图5ICOS-Tg小鼠感染不同病期HSCs中Collagen-Ⅰ基因的表达水平
(注:ICOS-Tg vs FVB/NJ,▼P<0.01。)
Fig.5Expressionofcollagen-ⅠgeneonHSCsofICOS-Tgmiceindifferentinfectionstages
ICOS-Tg vs FVB/NJ,▼P<0.01.

图6ICOS-Tg小鼠感染不同病期HSCs中Collagen-Ⅲ基因的表达水平
(注:ICOS-Tg vs FVB/NJ,▼P<0.01。)
Fig.6Expressionofcollagen-ⅢgeneonHSCsofICOS-Tgmiceindifferentinfectionstages
本研究结果发现,日本血吸虫感染小鼠HSCs中α-SMA基因表达水平自感染后4 w开始上升,感染后6 w、9 w仍处于上升趋势且表达维持在较高水平。 有研究表明,运用基因芯片技术检测日本血吸虫感染小鼠HSCs的活化标记α-SMA在感染后3 w时就显著升高,且持续高表达,说明HSCs在虫卵沉积前即已开始活化[15]。类似研究证明,肝HSCs中α-SMA在感染后4周即表达开始上调[16]。HSCs的活化、增殖是肝纤维化的关键环节。α-SMA为HSCs活化的特征性标志其表达水平可一定程度反映HSCs的活化程度。本研究结果显示,ICOS-Tg小鼠原代肝HSCs中与其活化相关的α-SMA基因的表达水平在感染后6w、9w显著高于同时期野生型小鼠原代HSCs中水平(P<0.01),提示上调共刺激信号ICOSL/ICOS促进肝HSCs的活化。
转化生长因子β在脊椎动物体内存在3种亚型:TGF-β1、TGF-β2、TGF-β3。其中TGF-β1是最强的致纤维化因子,在纤维化的起始和持续发展阶段均发挥关键作用[17]。体内和体外实验研究发现,TGF-β1对肝纤维化发展的中心环节—肝星状细胞(HSCs)的活化起着关键的调节作用[18]。在HSCs活化过程中,TGF-β1触发多个信号通路,包括:Smad通路[18],ERK1/2通路[19]和p38 MAPK通路[20],也有研究表明,TGF-β1通过β-catenin途径下调PPAR-γ的表达,从而增加胶原和TIMPS的表达,最终促进肝纤维化发生[21]。本研究运用qRT-PCR法检测感染日本血吸虫小鼠原代肝HSCs中Th2型细胞因子TGF-β1表达水平表明,随着病程的迁移,ICOS-Tg小鼠原代HSCs中TGF-β1表达水平在感染后6 w、9 w显著高于同时期野生型小鼠原代HSCs中水平(P<0.01~0.05),同时,检测ICOS-Tg小鼠原代HSCs中Collagen-Ⅰ、Collagen-Ⅲ基因表达水平在感染后6 w、9 w也显著高于同时期野生型小鼠原代HSCs的水平(P<0.01)。提示上调ICOSL/ICOS信号可增强HSCs中TGF-β1基因的表达,促进HSCs的活化及纤维化相关因子的上调表达,导致纤维化形成。
本研究应用ICOS-Tg小鼠血吸虫病模型,初步证明,ICOSL/ICOS信号可上调HSCs活化效应介导肝纤维化的形成,为深入阐明日本血吸虫感染宿主纤维化形成的机制,寻找下调或抑制血吸虫病肝纤维化发生、发展的有效途径提供科学依据。
参考文献:
[1]Domling A, Khoury K. Praziquantel and schistosomiasis[J]. ChemMedChem, 2010, 5(9): 1420-1434. DOI: 10.1002/cmdc.201000202
[2]Liu Z, van Grunsven LA, Van Rossen E, et al. Blebbistatin inhibits contraction and accelerates migration in mouse hepatic stellate cells[J]. British J Pharmacol, 2010, 159(2): 304-315. DOI: 10.1111/j.1476-5381.2009.00477.x
[3]Burke ML, Jones MK, Gobert GN, et al. Immunopathogenesis of human schistosomiasis[J]. Parasit Immunol, 2009, 31(4): 163-176. DOI: 10.1111/j.1365-3024.2009.01098.x
[4]Anthony B, Mathieson W, de Castro-Borges W, et al.Schistosomamansoni: egg-induced downregulation of hepatic stellate cell activation and fibrogenesis[J]. Exper Parasitol, 2010, 124(4): 409-420. DOI: 10.1016/j.exppara.2009.12.009
[5]Wang Y, Wang B, Liang S, et al. Immune response and immunopathology in ICOSL knockout mice infected withSchistosomajaponicum[J]. Chin J Zoonoses, 2012, 28(8): 769-775.
王瑜, 王波, 梁松, 等. ICOSL 敲基因小鼠日本血吸虫病模型的免疫应答及其免疫病理(英文)[J]. 中国人兽共患病学报, 2012, 28(8) : 769-775.
[6]Wang R, Cai R, Wang B, et al. Effect of immune response mediated by ICOS signaling pathway on hepatic fibrosis in mice infected withSchistosomajaponicum[J]. Chin J Parasit Dis, 2013, 31(005): 329-336. (in Chinese)
王瑜, 蔡茹, 王波, 等. 可诱导共刺激分子信号介导的免疫应答对血吸虫性肝纤维化形成的影响[J]. 中国寄生虫学与寄生虫病杂志, 2013, 31(005): 329-336.
[7]Bustin SA, Benes V, Garson JA, et al. The MIQE guidelines: minimum information for publication of quantitative real-time PCR experiments[J]. Clin Chem, 2009, 55(4): 611-622. DOI: 10.1373/clinchem.2008.112797
[8]Tao FF, Yang YF, Wang H, et al. Th1-type epitopes-based cocktail PDDV attenuates hepatic fibrosis in C57BL/6 mice with chronicSchistosomajaponicuminfection[J]. Vaccine, 2009, 27(31): 4110-4117.DOI: 10.1016/j.vaccine.2009.04.073
[9]Xu X, Wen X, Chi Y, et al. Activation-induced T helper cell death contributes to Th1/Th2 polarization following murineSchistosomajaponicuminfection[J]. J Biomed Biothechnol, 2010, 2010: 202397. DOI: 10.1155/2010/202397
[10]Lundy SK, Boros DL. Fas ligand-expressing B-1a lymphocytes mediate CD4+-T-cell apoptosis during schistosomal infection: induction by interleukin 4 (IL-4) and IL-10[J]. Infect Immun, 2002, 70(2): 812-819.
[11]Wang Y, Cai R, Wang B, et al. Effects ofSchistosomajaponicuminfection on the CD28/CD86 signaling pathway and Th1/Th2 polarization in ICOS transgenic mice[J]. J China Med Univ, 2013, 42(6): 494. (in Chinese)
王瑜, 蔡茹, 王波, 等. ICOS 转基因小鼠感染日本血吸虫对 CD28/CD86 表达及 Th1/Th2 极化的影响[J]. 中国医科大学学报, 2013, 42(6): 494.
[12]Li Y, Zhang HQ, Gong W, et al. Effect and expression of costimulatory molecules on regulating Th1/Th2 polarization on mice infected withSchistosomajaponicum[J]. Chin J Zoonoses, 2010, 26(9): 799-804. (in Chinese)
李颖, 张惠琴, 龚维, 等. 日本血吸虫感染小鼠CD4+T淋巴细胞协同刺激分子表达谱及其在介导Th1/Th2极化中的作用[J]. 中国人兽共患病学报, 2010, 26(9): 799-804.
[13]Winau F, Hegasy G, Weiskirchen R, et al. Ito cells are liver-resident antigen-presenting cells for activating T cell responses[J]. Immunity, 2007, 26(1): 117-129.
[14]Lu XJ, Chen YP, Yang T, et al. The influence of regulatory T cells in hepatic stellate cell proliferation and HA secretion[J]. J Clin Hepathol, 2012, 28(1): 39-43. (in Chinese)
陆小蒟, 陈永平, 阳韬, 等. 调节性 T 细胞对肝星状细胞增殖及透明质酸分泌的影响[J]. 临床肝胆病杂志, 2012,28(1):39-43.
[15]Luo J. Characteristics of the gene expression profiles of hepatic stellate cells in mice infected withSchistosomajaponicumand functions of vascular endothelial growth factor in liver fibrosis of schistosomiasis[D]. Nanjing: Nanjing Medical University, 2011. (in Chinese)
罗洁. 日本血吸虫感染小鼠肝星状细胞的基因表达谱特征及血管内皮生长因子旁分泌作用对肝星状细胞的影响[D]. 南京医科大学, 2011.
[16]Yang YH, Cai WM, Jin GL, et al. Studies on the relationship between granuloma and hepatic fibrosis in the infection ofSchistosomajaponicum[J]. Chin J Schist Ctrl, 1999, 11(6): 321-323. (in Chinese)
杨艳宏, 蔡卫民, 金国梁,等. 日本血吸虫虫卵肉芽肿与肝纤维化关系的研究[J]. 中国血吸虫病防治杂志, 1999, 11(6): 321-323.
[17]Herbst H, Wege T, Milani S, et al. Tissue inhibitor of metalloproteinase-1 and-2 RNA expression in rat and human liver fibrosis[J]. Am J Pathol, 1997, 150(5): 1647. DOI:10.1053/jhep.2000.20521
[18]Inagaki Y, Okazaki I. Emerging insights into transforming growth factor β Smad signal in hepatic fibrogenesis[J]. Gut, 2007, 56(2): 284-292. DOI: 10.1136/gut.2005.088690
[19]Liu Y, Wen XM, Lui Elh, et al. Therapeutic targeting of the PDGF and TGF-β-signaling pathways in hepatic stellate cells by PTK787/ZK22258[J]. Lab Investigat, 2009, 89(10): 1152-1160. DOI: 10.1038/labinvest.2009.77
[20]Ohyama T, Sato K, Kishimoto K, et al. Azelnidipine is a calcium blocker that attenuates liver fibrosis and may increase antioxidant defence[J]. British J Pharmacol, 2012, 165(4b): 1173-1187. DOI: 10.1111/j.1476-5381.2011.01599.x
[21]Qian J, Niu M, Zhai X, et al. β-Catenin pathway is required for TGF-β1 inhibition of PPARγ expression in cultured hepatic stellate cells[J]. Pharmacol Res, 2012, 66(3): 219-225. DOI: 10.1016/j.phrs.2012.06.003
