肺孢子菌感染或定植与呼吸系统疾病的相关性探讨
2014-04-02谭丽思马素丽国九英安春丽
张 楠,谭丽思,秦 铮,马素丽,国九英,樊 华,安春丽
肺孢子菌(Pneumosystis)是一种机会性感染真菌,由其导致的肺孢子菌肺炎(Pneumosystisjiroveciipneumonia, PJP,过去称卡氏肺孢子虫肺炎Pneumosystispneumonia,PCP)是AIDS、器官移植受者、抗肿瘤放、化疗等各类继发或原发性免疫机能低下人群最常见的机会感染性疾病[1-2]。对免疫机能低下人群的生命和生存质量构成严重威胁。国外学者还发现肺孢子菌的感染或定殖(colonization)与慢性阻塞性肺疾病(Chronic obstructive pulmonary disease, COPD)、肺囊性纤维变以及间质性肺炎等多种严重的呼吸系统疾病的发生密切相关。因此,如何监测肺孢子菌的感染或定殖被认为是当前的一项重要研究课题[3-5]。已有诸如PCR等多种基因检测方法被研究用于肺孢子菌定殖的检测研究中。其中,巢式PCR和Real time PCR等被认为是检测肺孢子菌基因的较好手段。但是,前者需要两次PCR过程,大大增加了反应时间。后者虽然具有快速、灵敏和容易标准化等优点,但是其复杂的操作程序和昂贵的试剂和设备限制了其临床应用[6]。环介导等温扩增(loop-mediated isothermal amplification, LAMP)是2000年由日本学者创建的一种新的基因检测方法。因其具有高效、敏感、特异和简捷等优点而备受青睐,目前已被用于多种感染性疾病的基因诊断[7]。本研究依据GeneBank发布的肺孢子菌基因序列,设计了3对特异性引物,构建了检测肺孢子菌16S rRNA基因的LAMP反应体系。在对感染动物模型检测,证明其敏感性强、特异性好的基础上,对临床肺疾病患者进行了肺孢子菌基因检测,研究分析呼吸系统疾病与肺孢子菌定殖或感染的相关性。
1 材料与方法
1.1材料
1.1.1样本收集 自中国医科大学附属第一医院收集临床疑似病例,如艾滋病、肾移植、癌症等基础疾病合并肺感染者以及COPD、间质性肺疾病等慢性呼吸系统疾病急性发作期患者的痰液共98例样本。患者有发热、咳嗽、呼吸困难等临床症状,胸片或CT显示:肺纹理增多、增粗、条索样阴影或磨玻璃状阴影等肺间质改变。其中男56例,女42例,年龄22~91岁,平均年龄62岁。收集痰标本时,嘱患者留取清晨清洁口腔后用力咳出的深部痰液,连续收集24 h,置无菌痰盒中备检。
本研究遵循的程序符合伦理学标准并得到人体试验委员会的批准,取得受试对象的知情同意。
1.1.2仪器与试剂 仪器:恒温水浴锅,ABI7500Real Time PCR仪。试剂:Tris 平衡酚和氯仿分别为中国医学科学院生物工程医学研究所和北京化工厂产品,蛋白酶K、dNTP、MgSO4、DNA相对分子质量标志物(DL2000)、PMD18-T Vector试剂盒购自上海宝生物有限公司,Betaine购自Sigma生物公司、Bst DNA聚合酶购自NEB生物公司,SYBR GREENⅠ显色液,SYBR GREENⅠ,琼脂糖购自上海生物技术有限公司,琼脂糖凝胶回收DNA试剂盒(普通离心柱型)和小提质粒试剂盒购自天根生化科技(北京)有限公司。
1.2方法
1.2.1LAMP检测
1.2.1.1引物设计与合成 从GeneBank获得肺孢子菌核内核糖体小亚基16s rRNA的基因序列(X12708),并与耶氏肺孢子菌(AB266392)、小鼠肺孢子菌(AY532651)、酵母菌属(Z75578)和念株菌属(E15168)等的16s rRNA在DNA man软件上进行比对,选取保守性好的一段基因。利用在线软件(primer explorer V4 http://primerexplorer.jp/elamp4.0.0/index.html)设计的16s rRNA特异性LAMP引物,见表1。

表1 LAMP 引物及其碱基序列
1.2.1.2临床痰液标本DNA的提取 向痰液中加入4倍体积的1 mol/L氢氧化钠, 混合振荡液化30 min。12 000 r/min离心5 min, 弃上清,沉淀用T10E10缓冲液洗3次, 12 000 r/min离心5 min, 取沉淀,向离心管中加入40 μL双蒸水并与沉淀充分混匀,100 ℃煮沸15 min,然后至于冰上10 min。最后,将离心管12 000 r/min离心10 min,收集上清液备用。
1.2.1.3LAMP反应体系及条件 F3、B3 5 pmol/L,BIP、FIP 40 pmol/L,LoopB、LoopF 20 pmol/L,5 mol/L Betaine 2 μL,dNTP 0.2 mmol/L,10xBuffer 2.5 μL,8 U/μL Bst DNA聚合酶(NEB公司),SYBR GREENⅠ0.5μL,模板2 μL,加双蒸水至 25 μL;63°水浴60 min或者使用ABI7500Q-PCR仪进行扩增。
1.2.1.4LAMP产物的检测 水浴后取5 μL PCR扩增产物1.5%琼脂糖凝胶电泳,电压为120 mV,时间为40 min。电泳后在UVP紫外凝胶成像分析仪中观察结果并记录。在反应管中入SYBR GREENⅠ显色液观察颜色变化结果,或者使用ABI 7500仪器 60 min,观察荧光信号收集曲线。
1.2.2特异性检验 分别取100 ng的肺孢子菌、白色念珠菌、热带假丝念珠菌、近平滑念珠菌、光滑念珠菌、支原体FH株、溶血性链球菌以及金黄色葡萄球菌MRSA株基因组DNA作为LAMP扩增的模板(菌株DNA由中国医科大学病原生物学教研室提供)。按照上述反应体系进行LAMP扩增,并加入SYBR GREENⅠ荧光显色液,观察颜色反应。
1.2.3敏感性检验 从感染大鼠模型提取肺孢子菌基因组DNA,构建重组质粒PMD18-T-16s rRNA,将重组质粒PMD18-T-16s rRNA,稀释出一系列的拷贝量(1012,1011,1010,109,108,107,106,105,104,103,102,50,10),以稀释的质粒DNA作为模版,分别应用上述反应体系,进行普通LAMP 、普通PCR反应。并观察LAMP反应产物荧光信号收集量,同时用1.5%琼脂糖凝胶电泳观察PCR扩增产物。
1.3统计学分析 使用SPSS 17.0统计软件对数据进行处理,临床标本采用多样本率的χ2检验。P小于0.05为差异有关统计学意义。
2 结 果
2.1特异性 特异性检测结果如图1所示,绿色荧光为阳性反应,棕黄色为阴性反应。
2.2敏感性 LAMP检测肺孢子菌基因最低检出拷贝数为50 copies/mL,见图2a,普通PCR最低检出率为104copies/mL,见图3b。

图1LAMP检测肺孢子菌特异性结果
1:肺孢子菌,2:白色念珠菌,3:热带假丝念珠菌,4:近平滑念珠菌,5:光滑念珠,6:支原体FH株,7:溶血性链球菌,8:金黄色葡萄球菌MRSA株。
Fig.1SpecificityoftheLAMPassaysforthedetectionofPneumocystis
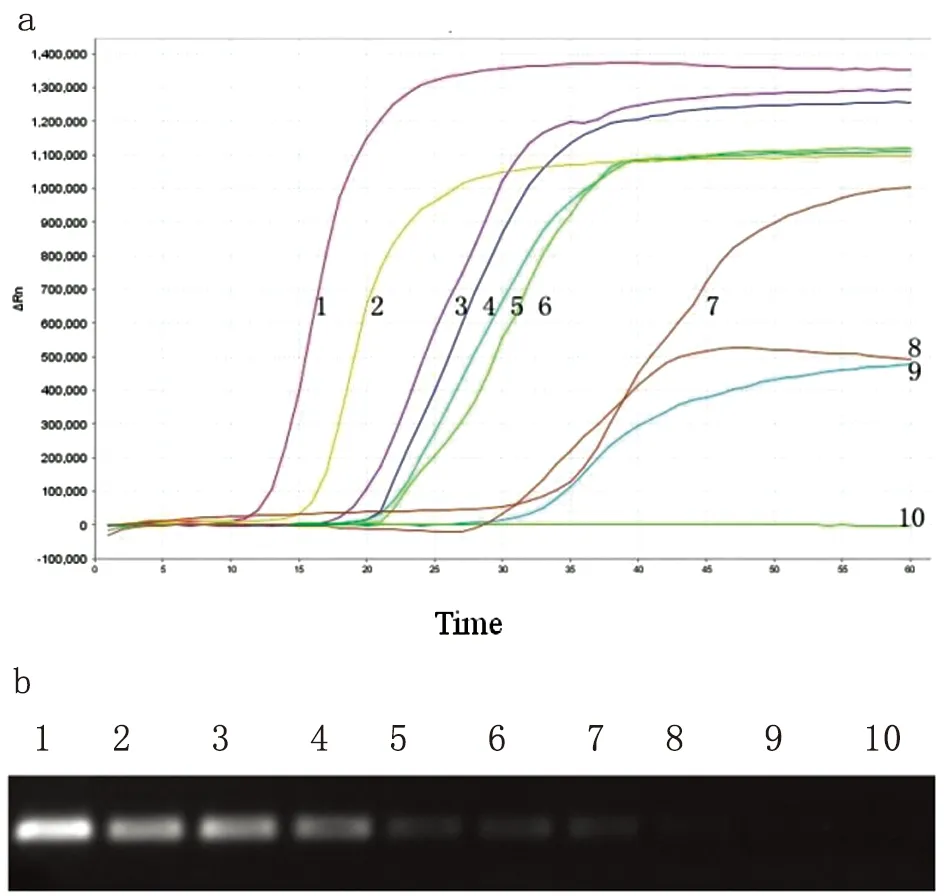
图2比较LAMP和PCR方法检测肺孢子菌的敏感性
Fig.2A 1: 109copies/mL; 2: 108copies/mL; 3: 107copies/mL; 4: 106copies/mL; 5: 105copies/mL; 6: 104copies/mL; 7: 103copies/mL; 8: 102copies/mL; 9: 50 copies/mL; 10: 10 copies/mL; X轴: 时间; Y轴: 荧光收集量。
Fig.2ComparativesensitivityoftheLAMPandPCRassaysforthedetectionofPneumocystis
Fig.2A 1: 109copies/mL; 2: 108copies/mL; 3: 107copies/mL; 4: 106copies/mL; 5: 105copies/mL; 6: 104copies/mL; 7: 103copies/mL; 8: 102copies/mL; 9: 50 copies/mL; 10: 10 copies/mL; X-axis: time; Y-axis: fluorescence collection
Fig.2B 1: 1012copies/mL; 2: 1011copies/mL; 3: 1010copies/mL; 4: 109copies/mL; 5: 108copies/mL; 6: 107copies/mL; 7: 106copies/mL; 8: 105copies/mL; 9: 104copies/mL; 10: 103copies/mL.
2.3临床标本检测结果 应用LAMP和普通PCR检测方法分别检测98例临床疑似病例痰液标本。LAMP方法检测结果通过荧光信号收集(图3)、显色反应(图4)、以及电泳方法(图5)判定。经LAMP方法检测的阳性样本62例,PCR方法检测阳性样本为22例,阳性率分别为63.27%、22.45%。其中PCR检测出阳性的标本,LAMP方法检测也均为阳性。检测结果通过对16s rRNA测序确定为肺孢子菌基因。

图3LAMP检测临床样本荧光信号结果
1:阳性对照,2:临床样本,3:阴性对照,X轴:时间,Y轴:荧光收集量
Fig.3FluorescenceoftheLAMPassayforthedetectionofclinicalsamples
1: positive control; 2: sample; 3: negative control; X-axis: time; Y-axis: fluorescence collection.
结果显示,98例临床患者中,合并感染患者有63例,感染的细菌种类分析以及检测结果分别见(表2、3)。

图4LAMP检测临床样本荧光显色结果
1:阳性对照,2:临床样本,3:阴性对照
Fig.4ChromomericreactionoftheLAMPassayforthedetectionofclinicalsamples
1: positive control, 2: sample, 3: negative control.
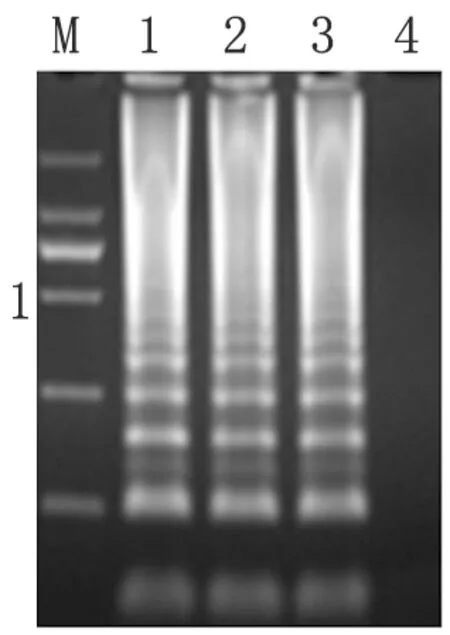
图5LAMP检测临床样本电泳结果
M:Marker DL2000,1:阳性对照,2、3:临床样本,4:阴性对照
Fig.5ElectrophoresisoftheLAMPassayforthedetectionofclinicalsamples
M: Marker DL2000; 1: positive control, 2, 3: sample, 4: negative control.

表2 合并感染患者与非合并感染者肺孢子菌基因检出率
*:与合并感染患者相比,χ2检验,χ2=6.902,p>0.05
Note: *Compared with patients infected, χ2= 6.902,P>0.05.
收集临床的样本中,慢性肺部慢性疾病患者59例,其中慢性支气管炎患者1例,COPD患者47例,哮喘1例,支气管扩张4例。47例COPD患者中有32例患者处于稳定期,15例处于急性加重期,非COPD患者有51例。
在检测的98例样本中CT和肺部X光显示肺部影像学有改变的51例,其中小斑片影及磨玻璃密度影的24例,网状索条影的9例,肺间质病变10例,肺纹理增强23例。LAMP检测结果见表5。
CD4+T淋巴细胞计数和肺孢子菌基因检出率结果(表6),对CD4+T淋巴细胞计数<410(个/μL)和CD4+T淋巴细胞计数>410(个/μL)两组病人肺孢子菌基因检出率进行χ2检验,χ2=4.044,P=0.044<0.05有统计学意义。
用LAMP技术,分别对1,3-β-D-葡聚糖血含量升高和1,3-β-D-葡聚糖血含量正常的患者进行肺孢子菌基因对比检测,结果如表7所示。
3 讨 论
伴随着艾滋病、器官移植受者、抗肿瘤放、化疗等各类继发或原发性免疫机能低下人群的日趋增多,PJP/PCP在临床上逐步成为“常见病”。而有关肺孢子菌定殖与一些重要的呼吸系统疾病的相关性的发现更加引起医学界广泛重视。本研究建立了检测肺孢子菌定殖的LAMP 方法,通过构建的质粒,在同等条件下分别用LAMP和PCR方法对质粒模版进行扩增,对比其敏感性,结果表明LAMP检测肺孢子菌的敏感性比PCR高出100倍以上。而且,LAMP反应仅需要通过水浴锅等恒温设备保温1h就可以针对目的片段完成109~1010拷贝数的扩增。检测时间比 PCR 缩短了2 h,具有明显缩短时间的优势。LAMP检测对DNA的纯度要求不高,因此不需要耗时的DNA纯化步骤,针对临床样本,仅需要收集疑似病例24 h深部痰液,通过煮沸方法提取基因组DNA就可以完成检测,样本获得相对容易,患者耐受性好。更重要的是实验结果可以直接肉眼观察,不需要经验丰富的研究人员进行分析。根据荧光显色液在反应管中的颜色变化便可以读出结果,减少开盖次数从而避免污染,保证检测的可靠性。

表3 合并感染病原体的种类与肺孢子菌基因检出率
χ2检验,χ2=7.808,p> 0.05
Note:χ2= 7.808,P> 0.05.

表4 COPD患者肺孢子菌基因检出率
*:与非COPD患者相比,χ2检验,χ2=5.549,p>0.05;**:与COPD 稳定期相比χ2检验,χ2=7.198,p>0.05;
***:COPD 急性期与非COPD相比χ2检验,χ2=3.175,p>0.05
Note: *Compared with non-COPD, χ2=5.549,P> 0.05;**Compared with stable COPD, χ2=7.198,P>0.05;
***COPD acute phase compared with non-COPD, χ2=3 .175,P> 0.05.

表5 肺孢子菌基因检测与肺影像学分析
*:与肺部无影响学改变者相比,χ2检验,χ2=3.944,P<0.05
Note: *Compared with no change in lung,χ2= 3.944,P<0.05.

表6 CD4+ T淋巴细胞数与肺孢子菌基因检出率
*:与CD4+T淋巴细胞计数>410(个/μL)患者相比P<0.05
Note: *Compared with CD4+T lymphocyte counts> 410 (a/μL) patients,P<0.05.

表7 1,3-β-D-葡聚糖含量与肺孢子菌基因检出率
*:与1,3-β-D-葡聚糖血含量正常者相比,P>0.05
Note: *Compared with glucan 1,3-β-D-normal amount,P> 0.05.
本研究中,合并感染患者有63例,非合并感染35例。合并感染和非合并感染两组患者肺孢子菌基因检出率分别为60.3%和75.0%。合并感染者肺孢子菌基因阳性率明显低于非合并感染者,其原因可能是合并其他细菌感染抑制了肺孢子菌的定殖或感染。对比合并不同菌种感染与肺孢子菌基因检出率的高低,结果没有发现具有统计学意义的差别,认为肺孢子菌感染与合并感染菌种无关。
收集临床的样本中,慢性肺部慢性疾病患者59例,其中COPD患者47例。 47例COPD患者中有31例处于稳定期,15例处于急性加重期。肺孢子菌检测结果表明急性期与稳定期无明显差异,与前人[8,9]报道的COPD患者肺孢子菌检出率较高并与COPD严重程度相关的结果不一致。分析原因如下,收集的这些临床样本中除了有慢性肺部慢性疾病患者,还有间质性肺炎、严重肺部感染、恶性肿瘤、肾移植术后、系统性红斑狼疮等患者,这些患者都属于PCP的高危人群,一定程度上属于人为的控制样本质量。最近一篇研究报道COPD患者痰标本肺孢子菌检出率为55%[11],本研究中PDCO的PCP检出率为53.19%,与报道中基本一致。
近些年来,临床上常用肺部影像学改变、血液中CD4+T细胞数量[10-13]等指标辅助诊断或预测PCP。本研究在国内首次采用改良的LAMP方法检测呼吸道标本中肺孢子菌基因,对比观察上述两个指标。在检测的98例样本中CT和肺部X光显示肺部有影像学改变的有51例,其中小斑片影及磨玻璃密度影改变的24例,网状索条影改变的9例,肺间质病变10例,肺纹理增强23例。LAMP检测结果,肺部影像学有改变者肺孢子菌基因检出率为72.5%,肺部影像学无改变者的检出率为53.2%,χ2检验表明两者差异显著。这一结果符合相关报道[11]称肺孢子菌作为机会性感染病原体侵入患者肺部主要停留在肺泡间质及肺泡腔内引起肺泡性炎肺间质炎以及小叶间隔增厚,在影像学上表现为磨玻璃样改变及网状影的影像学改变的解释。
作为机会感染性疾病,PCP发生与CD4+T淋巴细胞数密切相关。因此,临床上将CD4+T淋巴细胞数用作预测免疫功能低下者是否合并PCP的重要指标[12-13]。当CD4+T淋巴细胞计数<200(个/μL)时患PCP可能性几乎为100%。目前,临床把CD4+T淋巴细胞计数正常值界定为410~1 590(个/μL)。本文根据这一界线对比LAMP对CD4+T淋巴细胞计数<410(个/μL)和CD4+T淋巴细胞计数>410(个/μL)两组人群肺孢子菌基因检出率。结果表明CD4+T淋巴细胞数降低患者检出率80.0%;CD4+T 淋巴细胞数正常者的检出率为60.27%,两者差异具有统计学意义。进一步说明CD4+T淋巴细胞数与PCP的相关性。
1,3-β-D-葡聚糖真菌细胞壁的一种表面糖蛋白,增高可作为真菌感染的指标[14]。临床规定1,3-β-D-葡聚糖正常值范围是<10 pg/mL。根据此标准,本研究对比了1,3-β-D-葡聚糖血升高和正常者肺孢子菌基因的检出率。结果显示两组病人的肺孢子菌基因检出率并无显著差异。这一结果可以解释为1,3-β-D-葡聚糖血升高患者可能有其他真菌感染,并非是肺孢子菌感染所致。
参考文献:
[1]Tamai K, Tachikawa R, Tomii K, et al. Prognostic value of bronchoalveolar lavage in patients with non-HIVPneumocystispneumonia[J]. Intern Med, 2014, 53(11): 1113-1117. DOI: 10.1007/BF01712447
[2]Gochi M, Takayanagi N, Ishiguro T, et al. Deterioration of the immune response induced by sulfamethoxazole-trimethoprim in a rheumatoid arthritis patient withPneumocystisjiroveciipneumonia[J]. Intern Med, 2014, 53(11): 1137-1141. DOI: 10.2169/internalmedicine.53.1505
[3]Babic-Erceg A, Vilibic-Cavlek T, Erceg M,et al. Prevalence ofPneumocystisjiroveciipneumonia (2010-2013): The first Croatian report[J]. Acta Microbiol Immunol Hung, 2014, 61(2): 181-188. DOI: 10.1556/AMicr.61.2014.2.8
[4]Lowe DM, Rangaka MX, Gordon F, et al.Pneumocystisjiroveciipneumonia in tropical and low and middle income countries: a systematic review and meta-regression[J]. PLoS One, 2013, 8(8): e69969. DOI: 10.1371/journal.pone.0069969
[5]Wang XL, Wei W, An CL. Retrospective study ofPneumocystispneumonia over half a century in mainland China[J]. J Med Microbiol, 2011, 60(Pt 5): 631-638. DOI: 10.1099/jmm.0.026302-0
[6]Gago S, Esteban C, Valero C, et al. A multiplex real-time PCR assay for identification ofPneumocystisjirovecii,Histoplasmacapsulatum, andCryptococcusneoformans/Cryptococcusgattiiin samples from AIDS patients with opportunistic pneumonia[J]. J Clin Microbiol, 2014, 52(4): 1168-1176. DOI: 10.1128/JCM.02895-13
[7]Dhama K, Karthik K, Chakraborty S, et al. Loop-mediated isothermal amplification of DNA (LAMP): a new diagnostic tool lights the world of diagnosis of animal and human pathogens: a review[J]. Pak J Biol Sci, 2014, 17(2): 151-166. DOI: 10.1002/rmv.593
[8]Fitzpatrick ME, Tedrow JR, Morris A, et al.Pneumocystisjiroveciicolonization is associated with enhanced Th1 inflammatory gene expression in lungs of humans with chronic obstructive pulmonary disease[J]. Microbiol Immunol, 2014, 58(3): 202-211. DOI: 10.1111/1348-0421.12135
[9]Calderon EJ, Rivero L, Respaldiza N, et al. Systemic inflammation in patients with chronic obstructive pulmonary disease who are colonized withPneumocystisjiroveci[J]. Clin Infect Dis, 2007, 45(2): e17-19. DOI: 10.1086/518989
[10]Kanne JP, Yandow DR, Meyer CA.Pneumocystisjirovecipneumonia: high-resolution CT findings in patients with and without HIV infection[J]. AJR Am J Roentgenol, 2012, 198(6): W555-561. DOI: 10.2214/AJR.11.7329
[11]Swain SD, Siemsen DW, Pullen RR, et al. CD4+ T cells and IFN-γ are required for the development ofPneumocystis-associated pulmonary hypertension[J]. Am J Pathol, 2014, 184(2): 483-493. DOI: 10.1016/j.ajpath.2013.10.027
[12]Marchiori E, Zanetti G, Escuissato DL, et al. Reversed halo sign: high-resolution CT scan findings in 79 patients[J]. Chest, 2012, 141(5): 1260-1266. DOI: 10.1378/chest.11-1050
[13]Riebold D, Enoh DO, Kinge TN, et al.Pneumocystisjiroveciicolonisation in HIV-positive and HIV-negative subjects in Cameroon[J]. Trop Med Int Health, 2014, 19(6): 643-655. DOI: 10.1111/tmi.12299
[14]Onishi A, Sugiyama D, Kogata Y, et al. Diagnostic accuracy of serum 1,3-β-D-Glucan forPneumocystisjirovecipneumonia, invasive candidiasis, and invasive aspergillosis: systematic review and meta-analysis[J]. J Clin Microbiol, 2012, 50(1): 7-15. DOI: 10.1128/JCM.05267-11
