旋毛虫ES抗原对DC2.4细胞TLR4、NF-κB和AP-1 mRNA表达的影响
2014-04-02韩彩霞李晓云路义鑫宋铭忻
刘 畅,韩彩霞,李 巍,李晓云,路义鑫,王 泽,唐 颖,宋铭忻
旋毛虫病(trichinellosis)是一种重要食源性人畜共患线虫病[1]。旋毛虫的排泄分泌抗原(excretory-secretory antigen, ES)在其对宿主的入侵和持续感染中起着关键的作用[2],而持续感染机制包括逃避和耐受宿主免疫系统的攻击[3]。ES抗原通过与免疫活性细胞持续相互作用,不断刺激、调控免疫系统来适应宿主环境,其中树突状细胞(dendritic cells, DCs)扮演着重要的角色[4]。
病原体∕病原体产物可能与DCs通过模式识别受体(pathogen recognition receptors, PRRs)家族中Toll 样受体(toll-like receptors, TLRs)相互作用,刺激DCs释放不同信号和细胞因子,启动获得性免疫应答[5]。近年来,有少量研究涉及到ES抗原诱导巨噬细胞[6-7]和DCs[8-9]等来调控获得性免疫,这种调控作用取决于DCs处于促炎性还是免疫耐受状态。ES抗原刺激未成熟的骨髓源性树突状细胞(bone marrow-derived dendritic cells, BMDCs)后使其获得半成熟状态[9],而经LPS预刺激再接受ES抗原刺激的DCs 通过与TLR4(LPS配体)的结合获得免疫耐受[8],这与LPS的反复刺激诱导DCs免疫耐受[10]相似。
鉴于免疫耐受受抗原性质,PRRs和环境中细胞因子和信号分子机制的影响[10-11],ES抗原反复刺激或者经ES抗原预刺激后接受LPS/ES抗原的刺激是否也可以获得相似的免疫效果不得而知,本实验从mRNA水平通过研究ES抗原和LPS的联合作用对DC2.4细胞表面受体TLR4、髓样分化蛋白88(MyD88)依赖信号通路的转录因子NF-κB和AP-1基因表达的影响,为进一步探究旋毛虫诱导免疫细胞免疫耐受状态的分子机制奠定基础。
1 材料与方法
1.1细胞株、旋毛虫虫种及抗原制备 DC2.4细胞系购自上海霖研生物技术有限公司。黑龙江猪旋毛虫,由东北农业大动物医学学院兽医寄生虫学教研室保种。旋毛虫的肌幼虫ES抗原制备依照胃蛋白酶消化法进行[12],内毒素水平经测试低于0.2 EU/mL,满足实验要求。
1.2主要试剂和器材 LPS为Sigma公司产品。RPMI1640培养基为美国Hyclone公司产品。特级胎牛血清(FBS),100 000 IU/mL青霉素/链霉素为天津灏洋生物公司产品。rTaq聚合酶、PMD18-T载体,Trizol,SYBR Premix ExTaqII为大连宝生物工程有限公司产品。E.coil DH5α为全式金公司产品。Forma Scientific型超净台为上海博逊实业有限公司产品。PCR仪为德国Eppendorf公司产品。DHP-9082型恒温培养箱为上海一恒科技有限公司产品。岛津UV-120-02型紫外分光光度计为日本岛津公司产品。7500Fast型荧光定量PCR仪为ABI公司产品。
1.3细胞培养及处理 DC2.4用1640培养基(包含10%胎牛血清,2 mmol/L L-谷胱氨酸,100 U/mL青霉素,100 μg /mL双链霉素),在37 ℃,5% CO2恒温箱中培养。
ES抗原按浓度梯度(0,5,10,15,20,25 μg/ml),时间梯度(0,4,8,12,16,20,24 h)刺激DC2.4(浓度为106个/mL),设置阳性对照组(LPS组)。实验组设置如下:空白对照组(PBS组);LPS组;ES抗原组;LPS预刺激12 h后更换新鲜1640培养基,再分别添加LPS和ES抗原再次刺激12 h (ES抗原+LPS/ES抗原组);ES抗原预刺激12 h后更换新鲜1 640培养基,分别添加LPS和ES抗原再次刺激12 h(LPS+ LPS/ES抗原组)。以上刺激物LPS、ES抗原浓度分别为100 ng/mL、10 μg/mL,每组设置重复孔。终止细胞培养,离心,细胞沉淀用PBS洗涤,Trizol法提取总RNA,反转录合成cDNA,-20 ℃保存备用。
1.4荧光定量PCR方法建立
1.4.1荧光定量和标准品扩增引物PCR引物设计
根据GenBank登陆的小鼠Gapdh( NM_008084.2),TLR4 (NM_021297.2),NF-κB( AY521462.1),AP-1 (NM_010591.2)基因序列,应用Primer Premier 5.0和oligo 6.0设计和分析引物,BLAST验证引物特异性。Gapdh基因荧光定量上游引物5′-GTGAAGGTCGGTGTGAACGG-3′,下游引物 5′-TCCTGGAAGATGGTGATGGG-3′,扩增长度为227 bp;标准品扩增上游引物5′-CCAGCCTCGTCCCGTAGACA-3′,下游引物5′-ATACTCAGCACCGGCCTCACCC-3′,扩增长度为298 bp。TLR4 基因荧光定量上游引物5′-AGTCCCTGATGACATTCCTTCTT-3′,下游引物5′-AAGTTTGAGAGGTGGTGTAAGCC-3′,扩增长度为180 bp;标准品扩增上游引物5′-CACTGTTCTTCTCCTGCCTGA-3′,下游引物5′-TTCCCTGAAAGGCTTGGTCT-3′,扩增长度为633 bp。NF-κB 基因荧光定量上游引物5′-AGCCTCCAGCCCCGTGA-3′,下游引物5′-CAATAGGTCCTTCCTGCCCATA-3′,扩增长度为221 bp ;标准品扩增上游引物5′-CCACCTATGATGGGACTAC-3′, 下游引物5′-GATTCTCCAGCACCTTTG-3′,扩增长度为887 bp。AP-1基因荧光定量上游引物 5′-GTGCCAACTCATGCTAACGC-3′,下游引物5′-GGTCGCAACCCAGTCCATC-3′,扩增长度为181 bp;标准品扩增上游引物5′-GCATCCACGGCCAACAT-3′,下游引物5′-CCTTCCCACTCCAGCACA-3′,扩增长度为288 bp。所有引物均由上海英骏生物工程有限公司合成。
1.4.2标准品质粒的构建 以步骤1.5所得cDNA为模板,用标准品扩增引物通过PCR的方法扩增小鼠Gapdh,TLR4,NF-κB和AP-1基因片段。目的片段产物纯化,PMD18-T载体连接,E.coil DH5α转化,质粒提取,PCR鉴定,利用紫外分光光度仪测量质粒浓度,再根据质粒拷贝数换算公式计算质粒拷贝数,用ddH2O进行10倍倍比稀释(100~104共5个梯度),-20 ℃保存备用。
1.4.3荧光定量PCR反应条件的优化 通过SYBR Green染料法,分别对Gapdh,TLR4,NF-κB和AP-1荧光定量PCR反应过程中的退火温度及反应时间进行优化,反应条件为:95 ℃预变性10 s,95 ℃变性3 s,56 ℃~62 ℃退火20 s~30 s,反应40个循环。
1.4.4标准曲线的建立 以起始模板质粒标准品浓度(lg)为X轴,获得的Ct值为Y轴制作标准曲线,通过溶解曲线情况分析引物特异性,并计算扩增效率。
1.5TLR4,NF-κB和AP-1基因 mRNA表达水平检测 根据步骤1.4建立的荧光定量检测体系,对各组样品中的相关基因mRNA表达水平按照优化后的反应体系进行定量检测,得到检测样品的Ct值。根据建立好的标准曲线代入Ct值得到样品浓度值,△△Ct法计算相关基因mRNA表达水平。

2 结 果
2.1荧光定量PCR 检测TLR4,NF-κB和AP-1 mRNA表达水平方法建立
2.1.1标准品目的片段扩增与构建 标准品目的片段(Gapdh,TLR4,NF-κB和AP-1)经连接转化后,菌液由北京华大基因公司进行测序,结果用DNAMAN序列比对分析,将与GeneBank报道序列100%一致的菌液进行质粒提取,PCR扩增,琼脂糖凝胶电泳结果显示各目的条带与预期大小相符(图1)。紫外分光光度计检测质粒浓度。
2.1.2Gapdh,TLR4,NF-κB和AP-1 mRNA荧光定量PCR检测方法的建立 经过优化,确定荧光定量PCR的反应条件为:95 ℃预变性10 s,95 ℃变性3 s,退火温度60 ℃,退火时间30 s,反应40个循环。结果Gapdh,TLR4,NF-κB和AP-1融解曲线峰值单一(图略),说明引物特异性良好。以ABI 7500Fast荧光定量PCR仪进行数据分析,以起始模板质粒标准品浓度(lg)为X轴,Ct值为Y轴制作标准曲线,相关系数(R2)都在0.99~1之间,扩增效率都在0.8~1.2之间,符合△△Ct相对定量分析方法的标准,可以用△△Ct法进行表达差异分析。
2.2ES抗原诱导DC2.4 TLR4 mRNA 表达的剂量效应 图2显示,空白对照组有少量TLR4 mRNA表达,随着ES抗原浓度增加(0~15 μg /mL),TLR4 mRNA表达量逐渐升高,浓度继续增加TLR4 mRNA表达量有减少的趋势。ES抗原浓度在5~15 μg /mL范围内,TLR4 mRNA表达量无统计学意义(P<0.05);20、25μg /mL与15μg /mL相较,TLR4 mRNA表达量差异显著。
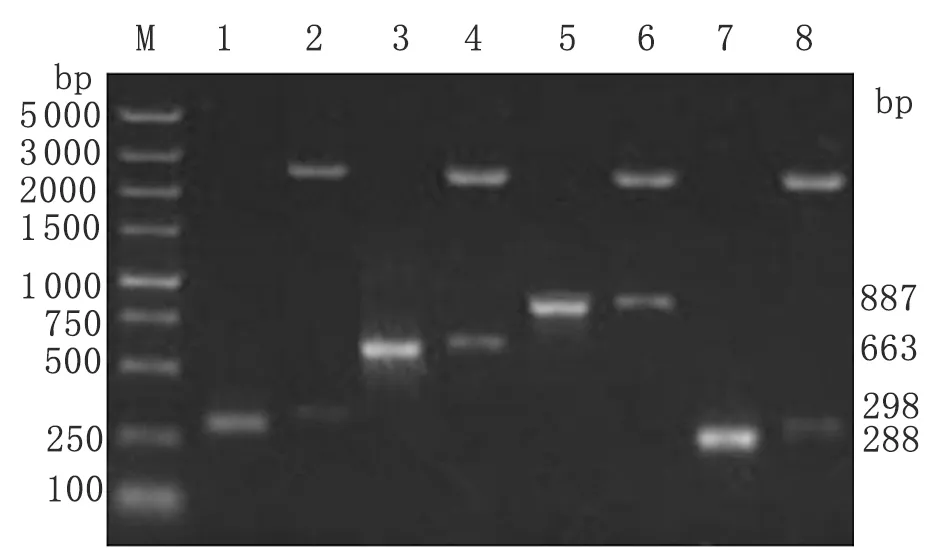
图1GAPDH,TLR4,NF-κB和AP-1重组质粒的PCR及酶切鉴定
M:DNA分子质量标准 ;1,3,5,7:GAPDH,TLR4,NF-κB和AP-1 PCR扩增产物;2,4,6,8:GAPDH,TLR4,NF-κB和AP-1双酶切鉴定
Fig.1PCRandrestrictionenzymedigestionanalysisoftherecombinantplasmid
M: DL5000 DNA maker; 1,3,5,7: Product of PCR for GAPDH, TLR4, NF-κB and AP-1; 2,4,6,8: Product from GAPDH, TLR4, NF-κB and AP-1 digested by recombinant plasmid.

图2ES抗原诱导DC2.4TLR4mRNA表达的剂量效应
*与空白对照组相较,差异有统计学意义(P<0.05,n=3);
**与空白对照组相较,差异有统计学意义(P<0.01,n=3)
Fig.2EffectofESantigenontheexpressionofTLR4inDC2.4stimulatedfordifferentdosages
N=3 independent experiments. *P<0.05 and **P<0.01 versus the control group.
2.3ES抗原诱导DC2.4 TLR4 mRNA 表达的时间效应 图3显示,用终浓度10 μg /mL的ES抗原作用DC2.4,随时间增加TLR4 mRNA表达量逐渐升高。作用12 h后,与空白对照组对比,TLR4 mRNA表达量无统计学意义(P<0.01)。随时间继续增加,TLR4 mRNA表达量减少,作用20 h组与作用12 h组对比,有统计学意义(P<0.05)。

图3ES抗原诱导DC2.4TLR4mRNA表达的时间效应
*与空白对照组相较,差异有统计学意义(P<0.05,n=3);
**与空白对照组相较,差异有统计学意义(P<0.01,n=3)
Fig.3EffectofESantigenontheexpressionofTLR4inDC2.4stimulatedfordifferentdosages
N = 3 independent experiments. *P<0.05 and **P<0.01 versus the control group
2.4ES抗原和LPS联合诱导DC2.4 TLR4、NF-κB和AP-1 mRNA表达变化 图4显示,阳性对照组和ES抗原组分别与空白对照组对比,TLR4、NF-κB和AP-1 mRNA表达量增加,有统计学意义(P<0.01);分别经过LPS和ES抗原预作用后再经过ES抗原和LPS作用,TLR4、NF-κB和AP-1 mRNA表达量分别较相应的阳性对照组均较少,有统计学意义(P<0.01)。
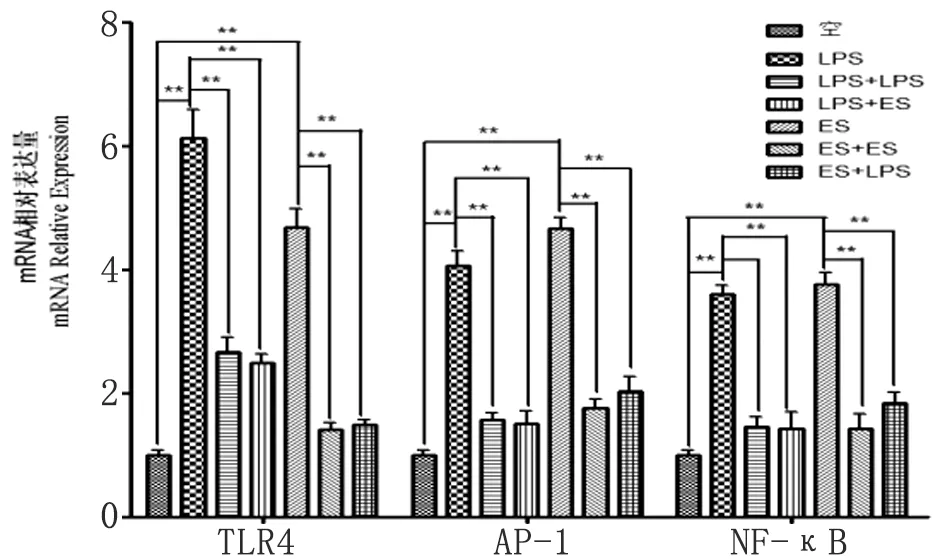
图4ES抗原和LPS联合诱导DC2.4TLR4、NF-κB和AP-1mRNA表达
*与空白对照组相较,差异有统计学意义(P<0.05,n=3);
**与空白对照组相较,差异有统计学意义(P<0.01,n=3)
Fig.4EffectofESantigenandLPSontheexpressionofTLR4,NF-κBandAP-1inDC2.4
N=3 independent experiments. *P<0.05 and **P<0.01 versus the control group.
3 讨 论
寄生虫可以通过分泌物诱导免疫细胞活化从而发挥免疫耐受效应,以利于虫体在宿主体内的长期存活[13]。例如,某些蠕虫分泌物通过识别DCs 上的 TLRs,如曼氏血吸虫产生的乳酸菌 N-fucopentaose III和棘唇线虫(Acanthocheilonema viteae)分泌物ES-62通过识别TLR4诱导Th2 反应[14-15],血吸虫特异性磷脂酰丝氨酸脂质通过识别TLR2诱导IL-10产生Treg[16],实现对机体免疫调节网络的调节。树突状细胞(DCs)是架接天然免疫和获得性免疫的桥梁,是体内功能最强的抗原提呈细胞。DC2.4是来源于C57BL/6小鼠骨髓不成熟树突状细胞系,常用作肿瘤、免疫和器官移植方面的研究模型[17],因而本研究选择DC2.4做体外研究。荧光定量PCR因其具有的操作简单,迅速快捷,结果灵敏度高,特异性强等特点,被广泛应用于临床诊断、基因检测等前沿临床和科研领域。
Aranzamendi[8]等报道,旋毛虫ES抗原通过与DCs 上的TLR4结合诱导DCs成熟。本研究首次发现ES抗原对DCs刺激后TLR4 mRNA表达水平在一定范围内具有剂量和时间依赖性,随着浓度的升高和时间的增加对TLR4则有抑制趋势的结果。ES抗原取浓度为10 μg /mL,时间为12 h时作用于DC2.4 TLR4表达水平较空白组显著,以此作为后续研究的ES抗原作用最佳剂量和时间。
除TLR3外,所有的TLRs均能启动髓样分化蛋白88(MyD88)依赖信号通路,通过两种途径分别活化转录因子NF-κB和AP-1,最终促进IL-6、IL-10、IL-12和TNF-α等炎性细胞因子的分泌[18-19]。本研究首次模拟体内ES抗原和LPS的相互复杂作用对宿主免疫系统的影响,实验发现转录因子NF-κB和AP-1与TLR4的mRNA表达水平变化成正比,证实旋毛虫ES抗原可与TLR4配体LPS一样从基因水平上启动MyD88信号通路。分别与ES抗原和LPS单独刺激组相较,ES抗原+ ES抗原组和LPS+ LPS组TLR4、 NF-κB和AP-1的mRNA表达水平降低;ES抗原组+ LPS与ES+ ES抗原组,LPS+ ES抗原组与LPS+ LPS组两两对比,发现ES抗原或LPS预刺激后再经ES抗原或LPS刺激,TLR4、NF-κB和AP-1的mRNA表达水平较ES抗原和LPS单独刺激组降低,表明ES抗原持续刺激或者与LPS交叉刺激,可能诱导树突状细胞产生类似于LPS持续刺激诱导树突状细胞获得免疫耐受的效果。
参考文献:
[1]Gottstein B, Pozio E, Nockler K. Epidemiology, diagnosis, treatment, and control of trichinellosis[J]. Clin Microbiol Rev, 2009, 22(1): 127-145. DOI: 10.1128/CMR.00026-08
[2]Nagano I, Wu Z, Takahashi Y. Functional genes and proteins ofTrichinellaspp[J]. Parasitol Res, 2009, 104(2): 197-207. DOI: 10.1007/s00436-008-1248-1
[3]Bruschi F. The immune response to the parasitic nematodeTrichinellaand the ways to escape it. From experimental studies to implications for human infection[J]. Curr Drug Targets-Immune, Endocrine Metabolic Disorders, 2002, 2(3): 269-280. DOI: 10.2174/1568008023340523
[4]Banchereau J, Briere F, Caux C, et al. Immunobiology of dendritic cells[J]. Ann Rev Immunol, 2000, 18(1): 767-811. DOI: 10.1146/annurev.immunol.18.1.767
[5]Van Vliet SJ, Den Dunnen J, Gringhuis SI, et al. Innate signaling and regulation of dendritic cell immunity[J]. Curr Opin Immunol, 2007, 19(4): 435-440. DOI: 10.1016/j.coi.2007.05.006
[6]Bai X, Wu X, Wang X, et al. Regulation of cytokine expression in murine macrophages stimulated by excretory/secretory products fromTrichinellaspiralisinvitro[J]. Mol Cell Biochem, 2011, 360(1/2): 79-88. DOI: 10.1007/s11010-011-1046-4
[7]Yu Y, Xu J, Lv XF, et al. Effect ofTrichinellaspiralisexcretory-secretory antigen on expression of TLR2/TLR4 mRNA in mouse macrophage[J]. Chin Vet Sci, 2012, 42(6): 562-565. (in Chinese)
禹洋, 徐佳, 吕兴锋, 等. 旋毛虫ES抗原对小鼠巨噬细胞TLR2/4mRNA表达的影响[J]. 中国兽医科学, 2012,42(6): 562-565.
[8]Aranzamendi C, Fransen F, Langelaar M, et al.Trichinellaspiralis-secreted products modulate DC functionality and expand regulatory T cellsinvitro[J]. Parasite Immunol, 2012, 34(4): 210-223. DOI: 10.1111/j.1365-3024.2012.01353.x
[9]Gruden-Movsesijan A, Ilic N, Colic M, et al. The impact ofTrichinellaspiralisexcretory-secretory products on dendritic cells[J]. Comp Immunol Microbiol Infect Dis, 2011, 34(5): 429-439. DOI: 10.1016/j.cimid.2011.08.004
[10]Lutz MB, Schuler G. Immature, semi-mature and fully mature dendritic cells: which signals induce tolerance or immunity?[J]. Trends Immunol, 2002, 23(9): 445-449. DOI: 10.1016/S1471-4906(02)02281-0
[11]Sher A, Pearce E, Kaye P. Shaping the immune response to parasites: role of dendritic cells[J]. Curr Opin Immunol, 2003, 15(4): 421-429. DOI: 10.1016/S0952-7915(03)00072-4
[12]Gamble H.Trichinellaspiralis: Immunization of mice using monoclonal antibody affinity-isolated antigens[J]. Exp Parasitol, 1985, 59(3): 398-404. DOI: 10.1016/0014-4894(85)90095-5
[13]Taylor MD, Van Der Werf N, Maizels RM. T cells in helminth infection: the regulators and the regulated[J]. Trends Immunol, 2012, 33(4): 181-189. DOI: 10.1016/j.it.2012.01.001
[14]Perona-Wright G, Jenkins SJ, Macdonald AS. Dendritic cell activation and function in response toSchistosomamansoni[J]. Int J Parasitol, 2006, 36(6): 711-721. DOI: 10.1016/j.ijpara.2006.02.003
[15]Dowling DJ, Noone CM, Adams PN, et al. Ascaris lumbricoides pseudocoelomic body fluid induces a partially activated dendritic cell phenotype with Th2 promoting abilityinvivo[J]. Int J Parasitol, 2011, 41(2): 255-261. DOI: 10.1016/j.ijpara.2010.09.007
[16]Van Der Kleij D, Latz E, Brouwers JF, et al. A novel host-parasite lipid cross-talk Schistosomal lyso-phosphatidylserine activates toll-like receptor 2 and affects immune polarization[J]. J Biological Chem, 2002, 277(50): 48122-48129. DOI: 10.1074/jbc.M206941200
[17]Shen Z, Reznikoff G, Dranoff G, et al. Cloned dendritic cells can present exogenous antigens on both MHC class I and class II molecules[J]. J Immunol, 1997, 158(6): 2723-2730.
[18]Chi H, Barry SP, Roth RJ, et al. Dynamic regulation of pro-and anti-inflammatory cytokines by MAPK phosphatase 1 (MKP-1) in innate immune responses[J]. Proc Natl Acad Sci U S A, 2006, 103(7): 2274-2279. DOI: 10.1073/pnas.0510965103
[19]Kawai T, Takeuchi O, Fujita T, et al. Lipopolysaccharide stimulates the MyD88-independent pathway and results in activation of IFN-regulatory factor 3 and the expression of a subset of lipopolysaccharide-inducible genes[J]. J Immunol, 2001, 167(10): 5887-5894. DOI: 10.4049/jimmunol.167.10.5887
