氯沙坦对糖尿病大鼠肾组织降钙素基因相关肽和内皮素-1表达的影响
2014-03-30何伟李英胡志娟马云娜高占红
何伟 李英 胡志娟 马云娜 高占红
糖尿病肾病(diabetic nephropathy,DN)发病机制复杂,主因是肾血流动力学及非血流动力学两大因素综合作用的结果,涉及到肾素-血管紧张素、降钙素基因相关肽(calcitonin-gene-related peptide,CGRP)、内皮素-1(endothelin,ET-1)等多种血管活性肽类物质的相互作用。本研究应用糖尿病大鼠模型,观察CGRP和ET-1在糖尿病大鼠肾组织的表达情况以及氯沙坦对两种肽类物质的影响。
1 材料与方法
1.1 糖尿病大鼠模型的建立和分组 选取体重120~150 g健康雄性Wister大鼠(河北医科大学实验动物中心供给)42只,随机分成对照组、糖尿病组及氯沙坦组,每组14只。糖尿病组和氯沙坦组大鼠腹腔一次性注射链尿佐菌素(溶于0.1 mmol/L枸橼酸缓冲液,pH值4.5)65 mg/kg,72 h后取尾静脉血,测血糖 >16.65 mmol/L(美国强生One TouchⅡ血糖仪测定),表明造模成功;正常对照组大鼠以等量枸橼酸缓冲液一次性腹腔注射。氯沙坦组大鼠给予氯沙坦30 mg·kg-1·d-1灌胃,对照组和糖尿病组大鼠给予等量0.9%氯化钠溶液灌胃。实验期间大鼠自由进食、进水,不使用胰岛素及其他降糖药,每天测体重1次。于实验第8周处死3组动物,处死前1 d采用代谢笼留取24 h尿液,测24 h尿蛋白定量;处死当天股动脉取血,分离血清测血糖、尿素氮、肌酐;取双肾去包膜称重。取部分肾组织置于4%多聚甲醛固定,用于免疫组织化学检测;部分肾组织提取总RNA。
1.2 光镜观察及图像分析 肾组织石蜡切片,HE染色,光镜观察。每张切片随机选取20个肾小球,用自动图像分析仪计算其平均截面积(average sectional acreage,AG),并根据公式1.38/1.1(AG)3/2计算平均体积(average volume,VG)。
1.3 免疫组织化学染色 采用SABC法:石蜡切片经二甲苯及乙醇脱蜡,滴加3%过氧化氢孵育5 min,以灭活内源性过氧化物酶;蒸馏水冲洗3次,每次2 min,0.01 mol/L PBS浸泡5 min,10 mmol/L的枸橼酸钠微波抗原修复10 min;自然冷却后,加10%正常山羊血清封闭液室温封闭10 min;倾去封闭液后滴加1∶100稀释的一抗(兔抗小鼠CGRP和ET-1抗体),4℃过夜(以PBS代替一抗作为阴性对照);0.01 mol/L PBS清洗5 min 3次,滴加辣根过氧化物酶标记的二抗工作液(山羊抗兔IgG),37℃孵育20 min;0.01 mol/L PBS洗3次,每次5 min;滴加辣根过氧化物酶标记的链酶卵白素(1∶200稀释),37℃孵育20 min;0.01 mol/L PBS洗3次,每次5 min。滴加DAB试剂显色,显微镜下控制显色时间,以组织中出现棕黄色颗粒为阳性染色。自来水冲洗终止反应,苏木精复染,常规脱水、透明、封片。在400倍光镜下分肾小球、皮质肾小管-间质、外髓肾小管-间质、内髓肾小管-间质各选10个视野,利用病理图像分析系统测定阳性着色面积比×平均灰度,并求均值。
1.4 RT-PCR分析检测肾组织CGRP与ET-1mRNA表达 采用TRIzol试剂(异硫氰酸胍-酸性酚一步法)提纯各组肾组织总RNA,加入反转录体系于42℃进行3 h,将CGRP和ET-1的引物加入PCR反应体系,进行30~40次PCR循环。CGRP上游引物5’CGTGATCTTCTCTCTGCTGT3’,下游引物5’TTGACCCAGATGATGTCCAG3’;ET-1上游引物5’GACTCTTGCTCCTGTACCAG3’,下游引物5’CTCCCTGACTTTCATCTGAC3’。将PCR产物在2%琼脂糖凝胶中进行电泳,置于凝胶图像分析系统(Bio-Rad公司,美国)进行吸光度扫描。
1.5 统计学分析 应用SPSS 11.0统计软件,计量资料以±s表示,采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 实验8周时3组大鼠一般情况及肾功能指标与对照组比较糖尿病组肾重/体重、血糖、24 h尿蛋白定量(TP/24 h)、肌酐(SCr)、尿素氮(BUN)明显增高(P<0.01)。氯沙坦组肾重/体重、血糖、TP/24 h、SCr、BUN明显低于糖尿病组而高于对照组(P<0.05)。见表1。
表1 3组大鼠实验8周后血糖、肾重/体重、TP/24、Scr和BUN比较n=14,±s
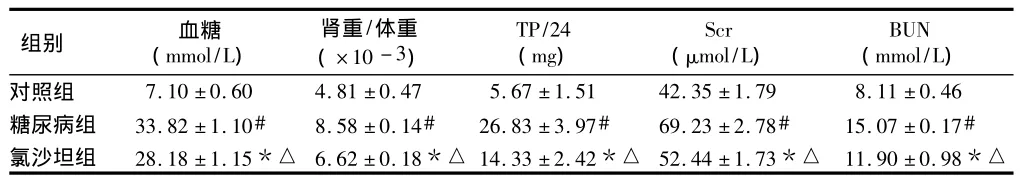
表1 3组大鼠实验8周后血糖、肾重/体重、TP/24、Scr和BUN比较n=14,±s
注:与对照组比较,*P<0.05,#P<0.01;与糖尿病组比较,△P<0.05
组别 血糖(mmol/L)肾重/体重(×10-3)TP/24(mg)Scr(μmol/L)BUN(mmol/L)对照组7.10±0.604.81±0.475.67±1.5142.35±1.798.11±0.46糖尿病组33.82±1.10#8.58±0.14#26.83±3.97#69.23±2.78#15.07±0.17#氯沙坦组28.18±1.15*△6.62±0.18*△14.33±2.42*△52.44±1.73*△11.90±0.98*△
2.2 肾组织形态学改变 对照组大鼠肾小球未见异常;糖尿病组大鼠可见92%肾小球系膜细胞增生,基质弥散性增高,AG和VG增大(P<0.01);氯沙坦组AG和VG较糖尿病组下降,较正常组增大(P<0.05)。见表2。
表2 3组大鼠实验8周后肾小球AG和VG检测结果比较n=14,±s

表2 3组大鼠实验8周后肾小球AG和VG检测结果比较n=14,±s
注:与对照组比较,*P<0.05,#P<0.01;与糖尿病组比较,△P<0.05
组别AG(A/μm2×104)VG(V/μm3×106)0.95±0.091.19±0.15糖尿病组1.30±0.19#2.11±0.20#氯沙坦组1.11±0.12*△1.59±0.14对照组*△
2.3 免疫组化结果CGRP与ET-1在3组大鼠肾组织中均有表达,CGRP主要分布在肾小球固有细胞、肾小管上皮细胞及鲍曼氏囊中,ET-1主要分布于肾小球固有细胞、系膜细胞及肾小管上皮细胞中。免疫组化病理图像分析结果示:与对照组相比糖尿病组肾组织中CGRP表达明显降低,ET-1表达明显升高(P<0.01);氯沙坦组较糖尿病组肾组织CGRP表达明显升高,ET-1表达明显降低(P<0.05)。见表3,图1、2。
表3 3组大鼠实验8周后CGRP与ET-1免疫组化染色均数比较n=14,±s

表3 3组大鼠实验8周后CGRP与ET-1免疫组化染色均数比较n=14,±s
注:与对照组比较,*P<0.05,#P<0.01;与糖尿病组比较,△P<0.05
CGRPET-1对照组组别2.85±0.190.46±0.15糖尿病组0.89±0.12#2.17±0.19#氯沙坦组1.76±0.14*△1.29±0.18*△
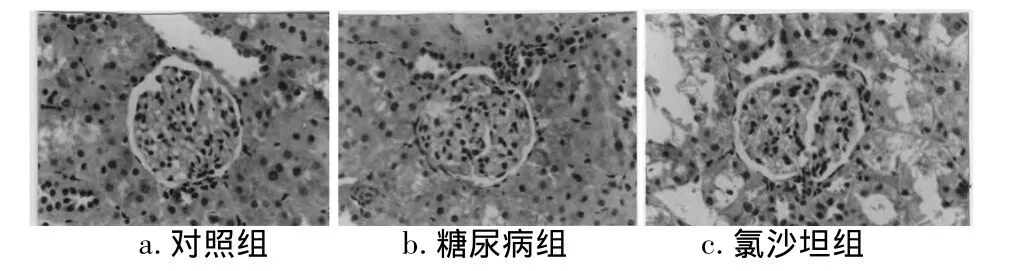
图1 CGRP在3组肾组织中的表达(免疫组化×400)
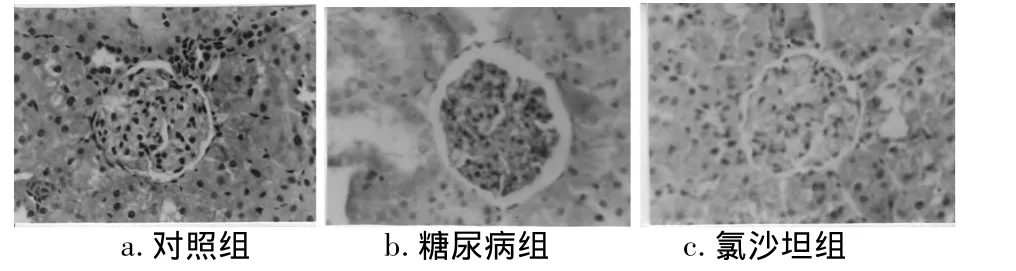
图2 ET-1在3组肾组织中的表达(免疫组化×400)
2.4 RT-PCR结果RT-PCR密度梯度扫描结果:与对照组相比糖尿病组肾组织中CGRP的mRNA表达明显降低,ET-1的mRNA表达明显升高;氯沙坦组较糖尿病组肾组织CGRP的mRNA表达明显升高,ET-1的mRNA表达明显降低。见图3。
3 讨论
CGRP是由37个氨基酸组成的活性多肽,是体内最强的舒血管物质之一;ET-1是由21个氨基酸组成的酸性多肽,是目前所知体内作用最强的缩血管活性多肽之一。研究表明,CGRP是ET-1有效的内源性拮抗剂,它通过下调ET-1受体的密度而拮抗ET-1的生物学效应,CGRP可以抑制致炎细胞因子,如TNF-β、IL-1和IL-2的产生,双向调节IL-6的产生(小剂量增加,大剂量抑制),增加NO和前列腺素的产生,抑制ET-1的合成[1,2];而ET-1通过对血管的收缩作用,引起组织缺血、缺氧,造成高乳酸环境,可直接刺激CGRP的神经兴奋,引起CGRP的释放增加,二者处于相对平衡状态[3]。
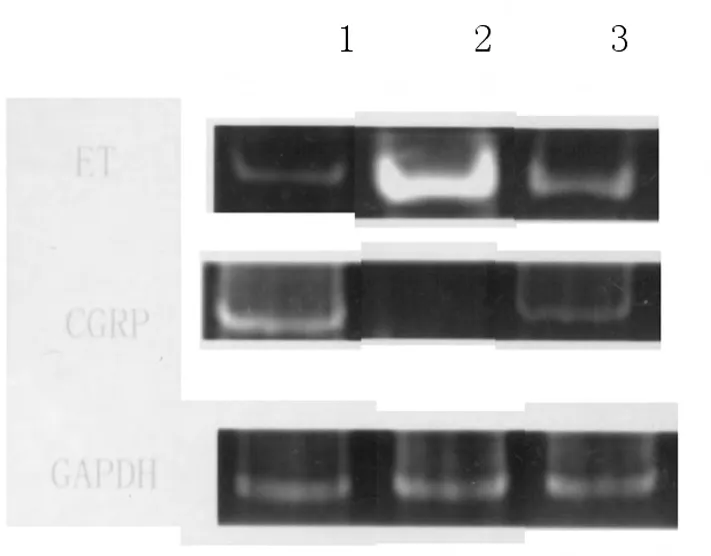
图3 3组大鼠肾组织中CGRP与ET-1mRNA的表达比较
本实验结果显示糖尿病组较对照组肾重/体重、血糖、TP/24 h、SCr、BUN明显增高,肾小球AG和VG增大,表明糖尿病组出现肾脏功能和形态的改变,检测CGRP表达减少,其mRNA表达下调,而ET-1表达升高,其mRNA表达上调,表明CGRP与ET-1的失衡在糖尿病肾病发病中存在一定作用。文献报道,糖尿病患者血浆ET增加,可使血管内皮细胞受损,内皮细胞损伤可导致组织缺、缺血,CGRP免疫反应纤维减少,使CGRP释放减少[3,4];并且一氧化氮合酶(nitricoxide synthase,NOS)减少,不能介导CGRP释放增多,引起CGRP,减少[5]。高血糖状态损伤血管内皮细胞引起ET-1的大量释放;缺氧、血管内皮细胞损伤,高胰岛素血症,高三酰甘油血症等因素可促进ET-1合成及释放增多。在糖尿病肾病中,随CGRP下降,ET升高,使血管的舒张作用及内皮的保护作用减弱,诱导血管收缩,微循环障碍,造成出、入球小动脉收缩加重,特别是出球小动脉,引起肾小球内高灌注、高滤过、高压的三高状态,从而出现蛋白尿;随病情进展,转化生长因子-β(transforming growth factor-β,TGF-β)上调,促进血管平滑肌细胞、系膜细胞的增殖,肾小球体积增大,继而肾小球硬化,降低肾小球的滤过率,造成肾功能受损。
糖尿病的发生、发展中,肾脏局部RAS系统活性增强,应用氯沙坦有明确治疗作用。本实验显示氯沙坦治疗组较糖尿病组比较肾功能指标明显减轻,肾小球肥大减轻;并且CGRP表达增加,其mRNA表达上调,而ET-1表达减少,其mRNA表达下调,表明氯沙坦的肾脏保护机制与CGRP与ET-1的拮抗作用有一定关系。氯沙坦有效地拮抗血管紧张素Ⅱ作用,降低TGF-β的分泌,阻断ET的生理功能,促进CGRP的合成,从而缓解CGRP与ET-1的失衡,降低血压,改善肾脏的血流动力学,减轻肾小球毛细血管收缩,使毛细血管压降低,改善肾小球高滤过状态,从而减少尿蛋白;缓解CGRP与ET-1的失衡,可增强细胞保护,抑制血管平滑肌细胞增殖,从而延缓肾小球硬化和肾功能恶化[6,7],起到对糖尿病肾病的保护作用。
1 Padilla Be,Cottrell GS,Roosterman D,et al.Endothelin-converting enzyme-1 regulates endosomal sorting of calcitonin receptor-like receptor and beta-arrestins.J Cell Biol,2007,179:981-997.
2 Hashitani H,Lang RJ,Mitsui R,et al.Distinct effects of CGRP on typical and atypical smooth muscle cells involved in generating spontaneous contractions in the mouse renal pelvis.Br J Pharmacol,2009,158:2030-2045.
3 Luo F,Ji N,Zhang S,et al.Changes of endothelin and calcitonin gene-related peptide concentrations in plasma during propofol anesthesia.J Newrosurg Anesthesiol,2009,21:47-50.
4 Wynne BM,Chiao CW,Webb RC.Vascular smooth muscle cell signaling Mechanisms for contraction to AngiotensinⅡand Endothlin-1.J Am Soc Hypertens,2009,3:84-95.
5 Haworth RS,Cuello F,Avkiran M.Regulation by phosphodiesterase isoforms of protein kinase A-mediated attenuation of myocardial protein kinase D activation.Basic Res Cardiol,2011,106:51-63.
6 Edvinsson L.Calcitonin gene-related peptide and migraine.Increases understanding of physiopathology can lead to new drug therapy.Lakartidningen,2010 Dec 15-21:3208-3211.
7 Hofman C,Rosenthal T,Winaver J,et al.Renal and systemic effects of endothelin-1 in diabetic-hypertensive rats.Clin Exp Hypertens,2011,33:444-454.
