靶向Akt1基因RNA干扰对胸主动脉平滑肌细胞增殖的影响
2014-03-30刘苏健范波丁明超王意忠王斌
刘苏健 范波 丁明超 王意忠 王斌
近年来,动脉硬化及其闭塞性血管疾病的发生率迅速升高,自体静脉移植是治疗外周血管疾病的有效手段。然而移植血管中膜平滑肌细胞(vascular smooth muscle cell,VSMC)向内膜迁移、过度增殖和细胞外基质大量合成是导致血管移植术后移植静脉内膜增厚、管腔狭窄的重要原因[1]。如何防治血管内膜增生一直是困扰血管外科医师的临床难题。RNA干扰(RNA interference,RNAi)是在转录后水平使得靶基因mRNA降解,从而使得目的基因表达减少或沉默[2]。本研究针对PI3K-Akt-mTOR信号通路中关键信号因子Akt亚型Akt1进行RNA干扰,通过分子生物学技术观察其抑制平滑肌细胞增殖的效果。
1 材料与方法
1.1 实验试剂与仪器 质粒pGenesil-1和感受态大肠杆菌DH-5α购自武汉晶赛生物技术有限公司,Lipofectamine2000购自美国Invitrogen公司,DMEM培养基(Dulbcco's Modified Eagle Medium)和新生牛血清购自美国Gibco公司,限制性核酸内切酶BamHⅠ、HindⅢ、SalⅠ、PstⅠ和T4 DNA连接酶购自New England Biolabs公司,质粒小提试剂盒购自北京中杉金桥生物技术有限公司,Annexin V-PE购自Bender Medsystems公司。
1.2 方法
1.2.1 基因序列:利用Invitrogen网站(www.invitrogen.com)提供的设计工具设计目的靶基因兔Akt1 mRNA序列,依照shRNA设计原则,设计并合成4条shRNA片段,退火形成双链后进行酶切和测序,经预实验后挑选出2条有效地Akt1 shRNA真核表达载体,一条为5’-GGGACUAGACCAUAAUCCATA-3’,另外一条为5’-CCTGGCUGACUUGAAUAUGTT-3’,阴性对照(错配质粒shRNA)序列为5’-UUAGACCUCTGGUUCGUACTT-3’,确保选择的shRNA与其他基因序列至少存在3个以上的碱基不同[3]。
1.2.2 合成shRNA序列DNA单链并测序:每条靶序列设计并合成所编码shRNA的DNA前向和反向序列单链,经退火形成双链后成与相应的黏性末端连接;再次退火连接、载体pGenesil-1质粒线性化处理及回收、稀释退火片段,用质粒小提试剂盒提取质粒。经测序鉴定无误后命名为Akt1-shRNA-1和Akt1-shRNA-2。
1.2.3 分组及转染:该课题设置空白对照组(A组)、阴性对照组(B组),Akt1-shRNA-1(C组),Akt1-shRNA-2(D组)。原代培养的第3代日本大耳白兔胸主动脉平滑肌细胞于转染前1 d接种于6孔板中,用2 ml含10%无抗新生牛血清的培养基定量;置于37℃、5%CO2孵育箱中培养。转染时,按Lipofectamine2000操作步骤仔细操作,将DNA与Lipofectamine2000溶于无血清无抗的DMEM培养基中,将两者吹打后混匀;室温下孵育15~20 min,将混匀的转染试剂用移液器加入到6孔板中,48 h观察转染效率。
1.2.4 FCM检测细胞凋亡:将原第3代兔胸主动脉细胞接种于6孔板中,细胞爬满玻璃片后Lipofectamine2000脂质体法转染细胞:加入结合缓冲液分别两次悬浮平滑肌细胞,将细胞悬液移入5 ml流式管中,加入5 μl Annexin V-PE和10 μl 7-AAD,室温孵育15 min后加缓冲液至500 μl;流式细胞仪分析,凋亡细胞所占总细胞比例即为凋亡率,实验重复三次,分别于转染后24、48、72、96 h处理细胞。
1.2.5 TUNEL检测平滑肌细胞凋亡程度:将细胞接种于6孔板中,置孵育箱中培养,使细胞密度达到90%~100%。Lipofectamine2000脂质体法转染平滑肌细胞,培养6 h后给予换液,按TUNEL试剂盒操作步骤进行操作,分别加入50 μl TUNEL液和50 μl转化剂-POD,在湿盒中孵育30 min。PBS冲洗3次,加入200 μl DAB底物溶液,室温孵育10 min,PBS冲洗3次后封片,在光镜下分析结果。
1.3 统计学分析 应用SPSS 13.0统计软件,计量资料以±s表示,采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 兔平滑肌细胞原代培养 原代培养5~7 d后给予更换DMEM培养液,可见少量平滑肌细胞从组织块边缘游出(图1);10~13 d可见组织块边缘有明显的平滑肌细胞聚集,细胞呈带状、长梭状(图2);采用α-SM-actin对兔原代培养平滑肌细胞进行细胞学鉴定,见图3。

图1 原代培养5 d的平滑肌细胞,可见组织块边缘有小的平滑肌细胞游出
图2 培养12 d的平滑肌细胞,呈现特征性“峰”“谷”生长

图3 α-SM-actin染色,阳性呈棕黄色(TUNEL×400)
2.2 兔平滑肌细胞转染效率 质粒转染第3代平滑肌细胞于48 h后在荧光显微镜下观察,两人分别同时计数相同视野下绿色荧光细胞与光学显微镜下细胞总数,重复三次后取其平均值。见图4。

图4 平滑肌细胞转染48 h荧光照片,转染细胞呈绿色,48 h转染率为17.8%(TUNEL×200)
2.3 流式细胞仪计算细胞凋亡数目 实验结果表明24 h Akt1-shRNA-1和Akt1-shRNA-2组细胞凋亡率分别为15.97%和12.47%,在48 h凋亡率分别达到19.72%和15.43%,抑制增殖效果达到最高峰,转染组与对照组相比有统计学差异(P<0.05),之后抑制增殖效果趋于平缓;A组与B组相比凋亡细胞数目差异无统计学意义(P>0.05)。见图5、6。
2.4 TUNEL法检测细胞凋亡数目Lipofectamine2000脂质体法转染第3代兔胸主动脉平滑肌细胞,转染后48 h用多聚甲醛固定平滑肌细胞,TUNEL法检测细胞凋亡,转染组与对照组相比细胞凋亡明显增多(P<0.05)。TUNEL结果显示C组和D组均促进凋亡的发生,以C组较为明显。见图7、8。

图5 各时间点流式细胞术检测细胞凋亡直方图,A为空白对照组、B为阴性对照组,C为Akt1-shRNA-1,D为Akt1-shRNA-2。*为与A组和B组相比P<0.05,各时间点A组与B组相比无统计学意义(P>0.05)

图6 流式细胞术检测48 h细胞凋亡示意图
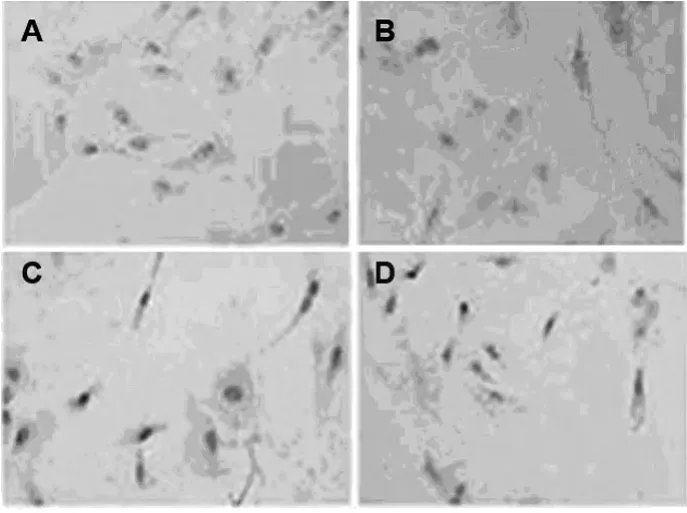
图7 兔血管平滑肌细胞质粒转染48 h结果(TUNEL×100)
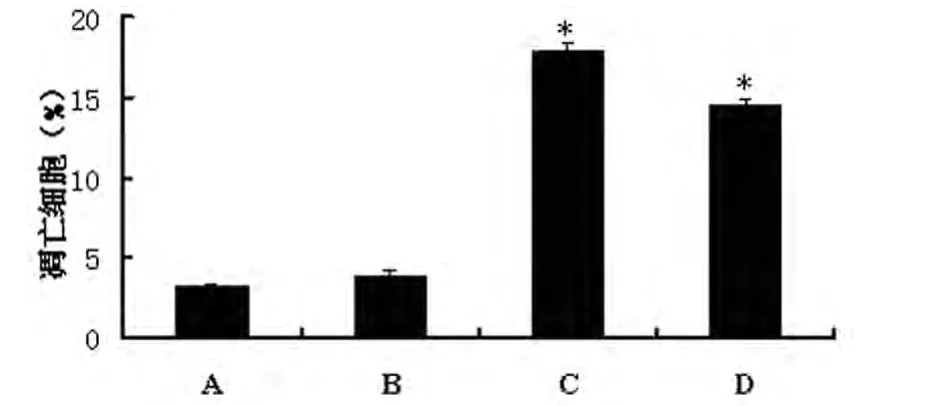
图8 TUNEL检测凋亡直方图。A为空白对照组、B为阴性对照组,C为Akt1-shRNA-1,D为Akt1-shRNA-2
3 讨论
随着社会的发展,血管闭塞性疾病越来越给老年患者带来痛苦,而除介入操作外血管搭桥术可解决血管外科大部分疾病的困扰,而血管移植术后再狭窄的主要原因之一是血管中膜平滑肌细胞的增殖和向内膜迁移[2]。新生内膜增生开始于静脉移植术后的早期,并最终可能导致移植血管管腔狭窄或闭塞[3]。血管移植术后移植血管再狭窄的发生机制十分复杂,多种细胞因子、生长因子、血管活性物质参与已得到证实[4,5]。PKB(Akt)是PI3K-Akt-mTOR信号通路系统中一个重要信号位点,是调节细胞增殖和凋亡的重要信号分子;Akt家族包括Aktl,Akt2,Akt3三个亚类,它们的结构相似但功能截然不同,Aktl可能参与调控细胞生长和生存[6]。激活的Akt通过促进下游靶位点如(mTOR)等磷酸化而发挥其广阔的生物学效应。通过影响信号通路来防治VSMC的增殖和促进其凋亡是近年来血管外科领域基因研究的热点。
RNAi技术有其独特的优点即高效性、高特异性和可遗传性。目前已进行的一些哺乳动物细胞实验中应用RNAi技术表明其可有效地抑制细胞靶基因的表达。目前尚未见有关利用RNAi技术抑制Akt1基因表达的文献报道。本课题组应用RNAi技术抑制VSMCs Akt1基因的表达。通过Lipofectamine2000将shRNA转染入原代培养的兔胸主动脉平滑肌细胞内,利用荧光显微镜观察其转染效率,结果显示脂质体成功地将shRNA转染入原代培养兔胸主动脉平滑肌细胞内,48 h转染率为17.8%;应用流式细胞术于24、48、72、96 h检测shRNA抑制平滑肌细胞增殖,结果显示shRNA转染后试验组细胞凋亡数目增加,48 h凋亡率最高,之后随着时间延长凋亡细胞逐渐减少。上述结果分别从蛋白和细胞水平验证了针对Akt1的shRNA有效地抑制了兔原代培养血管平滑肌细胞的增殖,为下一步试验奠定了基础。
1 Payeli SK,Latini R,Gebhaed C,et al.Prothrombotic gene expression profile in vascular smooth muscle cells of human saphenous vein,but not internal mammary artery.Arterioscler Thromb Vasc Biol,2008,28:705-710.
2 Werth D,Grassi G,Konjer N,et al.Proliferation of human primary vascular smooth muscle cells depends on serum response factor.Eur J Cell Biol,2010,89:216-224.
3 刘苏健,刘宏,赵京,等.大鼠Pik3cb短发卡状RNA对平滑肌细胞增殖的影响.南京医科大学学报.2008,28:1234-1239.
4 Scott NA.Restenosis following implantation of bare metal coronary stents:pathophysiology and pathways involved in the vascular response to injury.Adv Drug Deliv Rev,2006,58:358-376.
5 Chapman MJ.From pathophysiology to targeted therapy for atherothrombosis:A role for the combination of statin and aspirin in secondary prevention.Pharmacol Ther,2007,113:184-196.
6 Song G,Ouyang G,Bao S.The activation of Akt/PKB signaling pathway and survival.J Cell Med,2005,9:59-71.
