雌激素对中华鳖性腺分化及DMRT1、SOX9基因表达的影响
2014-03-29莉胡涛宓猛冬杨克周钱国英葛楚天
王 莉胡 涛宓猛冬杨克周钱国英葛楚天
(1. 浙江万里学院生物与环境学院, 宁波 315100; 2. 上海海洋大学水产与生命学院, 上海 201306)
雌激素对中华鳖性腺分化及DMRT1、SOX9基因表达的影响
王 莉1,2胡 涛1宓猛冬1杨克周1钱国英1,2葛楚天1
(1. 浙江万里学院生物与环境学院, 宁波 315100; 2. 上海海洋大学水产与生命学院, 上海 201306)
中华鳖(Pelodiscus sinensis)性别决定的方式一直存在较大的争议, 分子机制更是不清楚。在大部分脊椎动物中, 雌激素在性别决定和性腺分化中扮演重要的调控作用。实验通过对性别分化前胚胎进行雌二醇(E2)和芳香化酶抑制剂(AI)处理, 研究雌激素在中华鳖性腺分化中的作用及机理。实验结果显示, 与对照组(雌性比例49%)相比, E2处理组中雌性中华鳖仔鳖比例显著增加, 高达92.3%; 而在AI处理组中, 雌性比例显著下调至13.1%。HE染色分析表明, ZZ(雄性)和ZW(雌性)胚胎分别经过E2和AI处理后, ZZ和ZW性腺结构呈现明显的雌性化和雄性化特征。同时, 通过RT-PCR和免疫荧光染色发现, E2能显著降低雄性性别关键因子DMRT1和SOX9 mRNA和蛋白表达水平; AI则表现相反的调节作用。综上所述, 雌激素通过抑制雄性性别关键因子DMRT1和SOX9的表达来抑制雄性分化, 促进雌性分化, 揭示雌激素在中华鳖雌性性别分化中起着重要的调控作用。
雌激素; DMRT1; SOX9; 性别分化; 性腺发育; 中华鳖
中华鳖(Pelodiscus sinensis)的性别决定方式一直存在较大争议[1—4], 现已基本确定中华鳖存在微小性染色体 ZW, 属于基因型性别决定机制(Genetic sex determination, GSD)[5], 但目前中华鳖性别决定和性腺分化的分子机理尚不清楚。性别决定是一个复杂的、多基因精确调控和激素介导的过程。哺乳动物GSD的分子机理研究表明位于Y染色体的SRY基因是性别决定的主控基因, 上调SOX9、SF1、MIS、WT1和DAX1等基因的表达, 联合性激素的介导作用, 最后决定性器官的分化发育[6,7]。因此, 要解析中华鳖性腺分化的分子机理首先是要找出其性别决定的关键基因及其与性激素之间的互作关系。
在参与性别决定和性腺分化的关键基因中, DMRT1(Double sex-and mab3-related transcription factor1)基因是目前为止已知的唯一在动物门间保守的基因。在脊椎动物中, DMRT1与SRY基因相似,在雄性胚胎中专一性表达, 并参与了雄性的性别决定过程, 该基因的缺失会导致性反转现象。相关研究表明在鸟类、一些鱼类和两栖类上, DMRT1或其同源基因位于雄性性染色体(Z或Y)上, 是性别决定的主控基因[8—10]。在龟鳖类中, DMRT1基因在雄性性腺中呈现特异性表达, 如红耳龟[11]和太平洋丽龟[12]。SOX9(Sry-type HMG box9)基因是另一个重要的雄性性腺分化关键基因, 在哺乳动物雄性睾丸发育中与SRY基因共同作用调控下游基因的表达[13]。在八孔海龟中, SOX9基因在雄性性腺中的表达量显著高于雌性性腺[14]。本实验室已克隆获得了中华鳖DMRT1和SOX9基因, 并发现它们在中华鳖性腺发育中呈现雄性特异性表达。
除了关键基因外, 性激素往往在性腺分化过程中也扮演着重要的调控角色。在龟鳖类性腺分化发育过程中, 精巢来自双向潜能性腺髓质的发育和皮质的退化; 卵巢刚好相反, 来自双向潜能性腺皮质的发育和髓质的退化[15]。雌激素在该过程中起重要作用:它对双向潜能性腺的皮质和髓质的发育分别起促进和抑制作用, 从而决定性腺的雌性发育方向[16,17]。研究发现, 在产雄性温度下, 向菱斑龟、密河鳄、恒河鳄胚卵注入雌二醇, 可诱导胚胎向雌性方向发育[18,19]。动物体内的内源雌激素是由内源雄激素转化而来, 芳香化酶(P450arom)是催化该反应的关键酶, 可使雄烯二酮或睾酮氧化脱去19-甲基, 转变成雌酮或雌二醇, 控制着体内雌雄性激素的平衡[20]。雌性欧洲龟经过芳香化酶抑制剂处理后, 体内雌激素合成受到抑制, 性腺向雄性方向发育[21]。
本实验采用雌二醇与芳香化酶抑制剂在特定的发育时间点上对中华鳖胚胎进行处理, 待仔鳖出壳后对鳖胚性腺结构进行组织学分析, 同时从 mRNA和蛋白水平分析DMRT1和SOX9基因的表达变化,研究雌激素在中华鳖性腺分化中的作用及对DMRT1和SOX9基因表达的影响。
1 材料与方法
1.1 主要试剂
雌二醇(17β-estradiol, E2), 芳香化酶抑制剂来曲唑购自大连美仑生物科技有限公司; PCR扩增、反转录试剂盒购自 TaKaRa宝生物工程(大连)有限公司; 驴血清购自杭州联科生物技术有限公司; 鼠源β-Catenin单克隆抗体、4′,6-二脒基-2-苯基吲哚购自美国Sigma公司; DMRT1、SOX9兔源多克隆抗体购自美国Millipore公司; Alexa Fluor®488 驴抗兔IgG(H+L)、Alexa Fluor®594 驴抗鼠IgG(H+L)购自美国Invitrogen公司。
1.2 中华鳖卵孵化及性激素处理
中华鳖卵采自浙江绍兴中亚鳖养殖场, 采用全裸无接触式加湿孵化箱进行孵化。中华鳖受精卵采集时间控制在产卵后 12h之内, 将采集的鳖卵直接裸立于孵化盘定位孔中, 设定孵化温度 31 , ℃ 开启超声波雾化加湿器, 湿度控制在 75%—85%。孵化1d后, 弃去未受精卵, 调整动物极, 使其朝上发育。设置3个孵化箱, 分别为对照组、雌激素处理组和芳香化酶抑制剂处理组, 每组为200枚中华鳖受精卵。
孵化至15期时, 在正对胚胎的卵壳上滴加5 μL药物。对照组为 5 μL 95%乙醇, 实验组分别为50 μg/μL雌二醇(E2)和 50 μg/μL芳香化酶抑制剂(AI)。孵化至第17期进行第二次药物处理(用量与第一次等同)。
1.3 性腺提取及处理
收集出壳的稚鳖, 统计孵化率和平均体重, 宰杀后在体视显微镜下分离并提取性腺-中肾复合体。剥离一条性腺用于 RNA提取, 另一半性腺-中肾复合体用于组织学染色分析; 同时取每只稚鳖的心脏组织用于染色体核型分析。
1.4 性腺总RNA提取及RT-PCR
将每组中10个性腺组织, 按Trizol试剂说明书进行总RNA提取, 用核酸蛋白分析仪(Nanodrop)测定总 RNA浓度及纯度, 用 RNase-free水稀释使总RNA 浓度约为 2—5 μg/μL, –80℃冷冻保存。在PrimeScript Reverse Transcriptase (TaKaRa)和1 μL Oligo d(T)18Primers引物作用下合成 cDNA。以此cDNA为模板, 按照以下参数表 1进行 PCR扩增: 94 ℃ 预变性5min; 94℃变性 30s, 退火30s, β-actin引物退火温度为 59.5 , ℃ DMRT1基因引物退火温度为57.3 , ℃ SOX9基因引物退火温度为56.6 , 72℃ ℃延伸 1min, 循环35次; 然后72℃再延伸10min; 4℃保存。PCR扩增产物使用凝胶成像分析系统拍照。
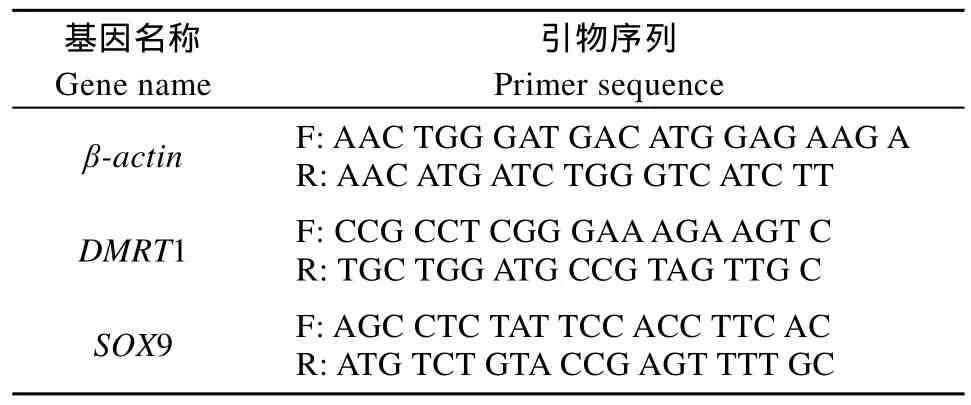
表1 引物序列Tab. 1 Primer sequences
1.5 石蜡切片
将取出的另一半组织保存于 4%多聚甲醛内,室温固定24h后转入50%乙醇。在体视显微镜下进行组织形状修正, 经过乙醇浓度由低到高梯度脱水,二甲苯透明, 纯石蜡包埋, 进行常规石蜡连续切片,以(5—6) μm厚度为宜。
1.6 苏木精-伊红染色
将切片进行二甲苯脱蜡, 乙醇梯度水分渗透,苏木素-伊红染色, 脱水, 封片。正置显微镜(OLYMPUS)下观察拍照。
1.7 免疫荧光染色
脱蜡后切片放入 0.01 mol/L柠檬酸钠溶液, 95℃抗原修复 20min, 冷却至室温。在封闭液(10%正常驴血清, 3%BSA, 0.1%Triton X-100, 0.01 mol/L PBS)中室温孵育 1h, 吸去周边多余液体, 分别加兔抗SOX9(1∶500)、DMRT1(1∶250)和鼠抗β-catenin (1∶250), 4℃过夜。用0.01 mol/L PBST和洗脱液(1%Normal Donkey Serum, 3%BSA, 0.1%Triton X-100, 0.01 mol/L PBS)清洗10 min×3; 在室温避光环境下, 滴加羊抗兔IgG 488(1∶250)和羊抗鼠IgG 594(1∶250), 孵育1h, 用0.01 mol/L PBST和洗脱液清洗10min×4。滴加DAPI(286 nmol/L)液室温避光染色5min, 0.01 mol/L PBS清洗5min×3。加抗荧光淬灭液封片, 于荧光正置显微镜拍照。
2 结果
2.1 雌二醇(E2)及芳香化酶抑制剂(AI)处理后的性腺组织形态学观察
正常25期雄性(ZZ)性腺外形呈椭圆形, 皮质区退化为单细胞层, 髓质区发育, 原始性索形成, 并由大量的 Sertoli前体细胞围绕原始生殖细胞组成(图1A)。25期雌性(ZW)性腺外形呈伞状, 皮质区发育, 髓质逐渐退化, 大量生殖细胞分布在皮质区(图1C)。ZZ性腺经过E2处理后, 外形大致呈现伞状, 比正常雌性稍大, 皮质区明显发育, 4—5层生殖细胞位于其中, 髓质区明显退化, 中间形成腔隙结构,此时的性腺具有明显的雌性性腺特征(图1B)。ZW性腺经过AI处理后, 性腺结构明显雄性化, 皮质区趋于退化, 髓质区发育, 形成较明显的原始性索,原始生殖细胞主要分布于髓质区(图1D)。
2.2 E2和AI对中华鳖胚胎雌雄比例的影响
中华鳖鳖胚经过药物处理后, 孵化出壳, 对性腺进行H&E染色分析其生理性别比例。从表2可以看出, 鳖卵经过药物处理后, 孵化率没有受到影响,仔鳖生长正常。在对照组中, 雌雄比约为 1∶1, 雌性占出壳总数的 49.0%。E2处理组中, 雌性性别比例显著增加, 高达92.3%。而在AI处理组中, 由于雌激素受到抑制, 雌性比例显著下调至13.1%。该数据表明, 雌激素在中华鳖性腺分化中具有重要的调控作用。
2.3 E2和AI对DMRT1和SOX9基因mRNA表达的影响
为了确认雌激素在中华鳖性腺分化中的作用, 本文还研究了E2和AI对性腺分化关键基因DMRT1和SOX9表达的影响。首先检测了这两个基因的mRNA表达水平。如图2所示: DMRT1和SOX9基因在正常雄性中高度特异性表达, 在正常雌性中均不表达。经过E2处理后, 雄性(ZZ)胚胎性腺中SOX9基因表达量下调, DMRT1基因表达甚至消失。而雌性(ZW)胚胎经过AI处理后, SOX9和DMRT1基因开始出现表达, 但表达量均低于正常雄性。RT-PCR实验结果表明, 在中华鳖性腺分化过程中, 雌激素能抑制雄性性腺分化关键基因DMRT1和SOX9的表达。
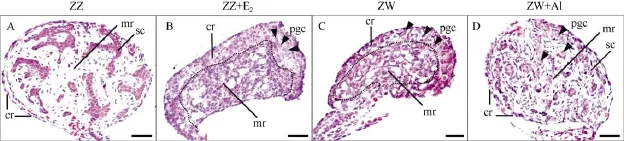
图1 E2及AI处理后中华鳖性腺组织形态学观察Fig. 1 Histological analysis of E2or AI-treated embryonic gonads in Pelodiscus sinensis
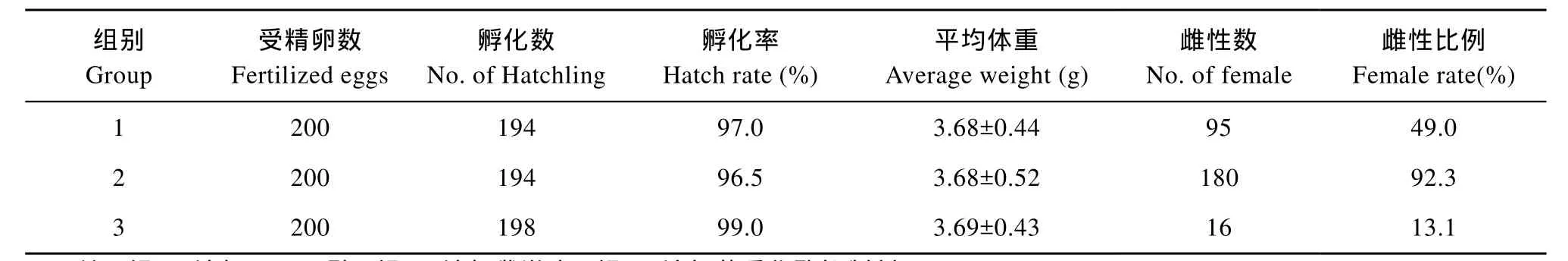
表2 E2及AI对中华鳖胚胎雌雄比例的影响Tab. 2 The effect of E2or AI on sex ratio of embryos in Pelodiscus sinensis
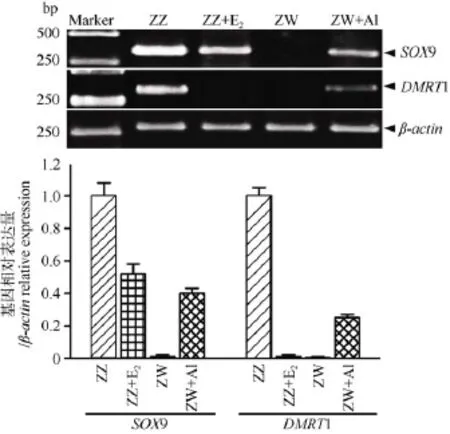
图2 E2和AI对中华鳖SOX9和 DMRT1基因mRNA表达水平的影响Fig. 2 Effects of E2or AI on the mRNA expressions of SOX9 and DMRT1 genes during gonadal differentiation in Pelodiscus sinensis
2.4 E2和AI对DMRT1和SOX9蛋白表达的影响
为了进一步验证雌激素能抑制 DMRT1和SOX9的表达, 本实验通过免疫荧光染色, 检测性腺中DMRT1和SOX9蛋白在E2或AI处理后的表达情况。
中华鳖DMRT1蛋白在雄性性腺髓质中大量表达, 主要定位于性索中Sertoli前体细胞的细胞核中,并围绕着原始生殖细胞(图3A-D); 但在正常雌性性腺中未见表达(图3I-L)。β-连锁蛋白(Catenin)作为细胞黏附的重要调控因子, 与细胞膜上 cadherin蛋白结合, 参与细胞的黏附作用。在中华鳖性腺中, β-catenin蛋白主要位于雄性性腺髓质区性索细胞以及雌性性腺皮质区细胞的细胞膜上(图3B、J)。雄性胚胎经过 E2处理后, DMRT1蛋白表达消失, β-catenin蛋白在皮质区细胞中大量表达, 呈现典型的雌性性腺结构(图3E-H)。雌性胚胎经过AI处理后, DMRT1蛋白开始在性腺髓质区表达; 除了皮质区, β-catenin蛋白在髓质区也有少量表达, 呈现雌雄同体现象(图3M-P)。
如图4所示, 在正常雄性中华鳖胚胎性腺中, SOX9蛋白主要在Sertoli前体细胞的细胞核中大量表达, 充满整个性腺髓质区(图4A-D); 雌性性腺中并未检测到SOX9荧光信号(图4I-L)。经过E2处理后, 雄性性腺中 SOX9蛋白表达显著下调, 并且主要定位于皮质区生殖细胞的周围细胞中, β-catenin蛋白主要分布于皮质区细胞中(图4E-H)。雌性胚胎经过AI处理后, SOX9蛋白表达显著增加, 在髓质区和皮质区中均有分布; β-catenin蛋白亦在髓质区和皮质区中表达(图4M-P)。
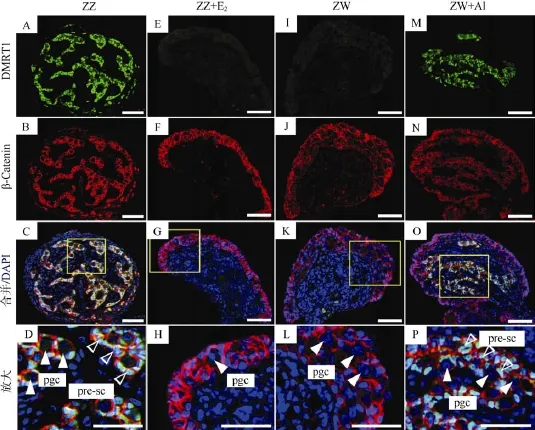
图3 E2和AI处理后中华鳖性腺的DMRT1&β-catenin免疫荧光染色Fig. 3 DMRT1 & β-catenin immunofluorescence of E2or AI-treated gonads in Pelodiscus sinensis
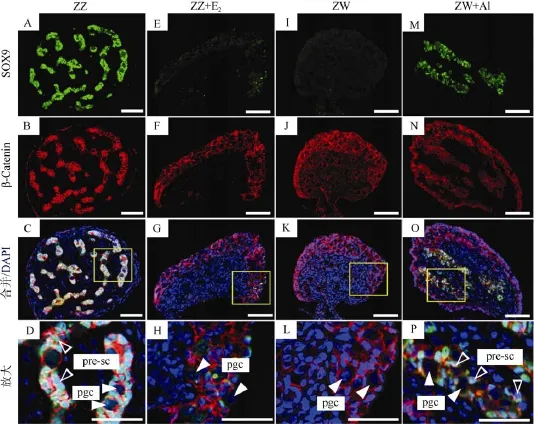
图4 E2和AI处理后中华鳖性腺的SOX9&β-catenin免疫荧光染色Fig. 4 SOX9 & β-catenin immunofluorescence of E2or AI-treated gonads in Pelodiscus sinensis
以上免疫荧光染色结果与 RT-PCR分析结果相一致, 表明雌激素的确能抑制DMRT1和SOX9的表达, 促进性腺向雌性方向分化。
3 讨论
在除哺乳动物外的大部分脊椎动物中, 雌激素在早期性腺分化中发挥重要的调控作用, 主要表现在: 在雄性性腺分化期间施加外源性雌激素能拮抗遗传因子或环境信号, 诱导雄性向雌性的性别逆转[22—24]; 而在雌性动物性别决定前注射芳香化酶抑制剂能诱导雌性向雄性的性别逆转[25—28]。本实验采用雌二醇(E2)与芳香化酶抑制剂(AI)在中华鳖性腺分化早期对胚胎进行处理后发现, E2处理组中雌性子代比例高达 92.3%, 性腺皮质区发育, 髓质区明显退化, 向雌性性腺转化; 而AI处理组中的雄性比例可达86.9%, 性腺结构明显雄性化。本研究表明雌激素信号在中华鳖雌性性别分化中起重要的调控作用。Wibbels, et al. 和Crews, et al.研究发现, 雌激素和芳香化酶抑制剂均能诱导蜥蜴和巴西龟胚胎发生性别逆转[25,26]。Olmstead, et al.亦发现外源性芳香化酶抑制剂可诱导非洲爪蟾雌性性腺发育为雄性性状[27]。这说明, 在爬行动物中, 雌激素在早期性别分化中的调控作用极可能是高度保守的。
雌激素对中华鳖雄性胚胎的雌性诱导作用虽然已经确定, 但是关于其如何诱导双向潜能性腺向雌性方向发育的分子机制还不清楚。在性别决定和性腺分化的关键基因中, DMRT1和SOX9基因是非常保守的雄性决定因子。DMRT1基因沉默的ZZ遗传雄鸡中出现了雌性化的卵巢组织[8], SOX9基因在小鼠胚胎性腺向睾丸分化中是必需和有效的, 其与雄性分化的相关性在脊椎动物中呈现高度保守[29—31]。在巴西龟中, 向胚胎注射雌二醇能显著抑制DMRT1和SOX9基因的表达[32]。另外, Durando, et al.发现雄性宽吻鳄胚胎进行雌二醇处理后, SOX9表达显著下降[33], 提示雌激素参与雄性性别决定因子的表达调控。我们前期研究发现, DMRT1和SOX9基因在中华鳖性腺发育过程中呈高度雄性特异性表达。在本实验中, 我们对中华鳖雄性和雌性胚胎分别进行雌二醇(E2)和芳香化酶抑制剂(AI)处理, 结果显示在E2组中DMRT1和SOX9 mRNA和蛋白表达显著下降, AI组中DMRT1和SOX9表达则急剧上升。这说明雌激素通过抑制DMRT1和SOX9的表达来抑制雄性分化, 从而诱导雌性发育, 与Barske和Capel的研究结果相一致[34]。此外, Murdock 和Wibbels研究发现 DMRT1在红耳龟雄性性腺中的特异性表达早于 SOX9[35]。我们在前期研究中, 亦发现中华鳖DMRT1基因先于SOX9在雄性性腺中开始表达, 加上本实验中雌激素对DMRT1的抑制作用较SOX9基因明显, 推测出龟鳖类动物的 DMRT1基因可能作用于SOX9的上游。
综上所述, 本实验发现雌激素通过抑制雄性性别关键因子DMRT1和SOX9的表达来抑制雄性分化,从而促进雌性分化和卵巢发育, 揭示了雌激素在中华鳖雌性性别分化中的重要调控作用, 而关于中华鳖性别决定的具体分子机理尚待进一步研究。
[1] Zhu D Y, Sun X Z. Sex determination in Trionyx sinensis [J]. Chinese Journal of Zoology, 2000, 35(6): 37—39 [朱道玉,孙西寨. 中华鳖的性别决定. 动物学杂志, 2000, 35(6): 37—39]
[2] Nie L W, Guo C W, Wang M, et al. Sex determination mechanism of Trionyx sinensis [J]. Chinese Journal of Applied and Environmental Biology, 2001, 7(3): 258—261 [聂刘旺, 郭超文, 汪鸣, 等. 中华鳖的性别决定机制. 应用与环境生物学报, 2001, 7(3): 258—261]
[3] Choo B L, Chou L M. Does incubation temperature influence the sex of embryos in Trionyx sinensis [J]. Journal of Herpetology, 1985, 26(3): 341—342
[4] Kawagoshi T, Uno Y, Matsubara K, et al. The ZW micro-sex chromosomes of the Chinese soft-shelled turtle (Pelodiscus sinensis, Trionychidae, Testudines) have the same origin as chicken chromosome 15 [J]. Cytogenetic and Genome Research, 2009, 125(2): 125—131
[5] Ji X, Chen F, Du W, et al. Incubation temperature affects hatchling growth but not sexual phenotype in the Chinese soft-shelled turtle, Pelodiscus sinensis (Trionychidae) [J]. Journal of Zoology, 2003, 261(4): 409—416
[6] Piprek R P. Genetic mechanisms underlying male sex determination in mammals [J]. Journal of Applied Genetics, 2009, 50(4): 347—360
[7] Shoemaker C M, Crews D. Analyzing the coordinated gene network underlying temperature-dependent sex determination in reptiles [J]. Seminars in Cell & Developmental Biology, 2009, 20(3): 293—303
[8] Smith C A, Roeszler K N, Ohnesorg T, et al. The avian Z-linked gene DMRT1 is required for male sex determination in the chicken [J]. Nature, 2009, 461(7261): 267—271
[9] Matsuda M, Nagahama Y, Shinomiya A, et al. DMY is a Y-specific DM-domain gene required for male development in the medaka fish [J]. Nature, 2002, 417(6888): 559—563
[10] Shibata K, Takase M, Nakamura M. The DMRT1 expression in sex-reversed gonads of amphibians [J]. General and Comparative Endocrinology, 2002, 127(3): 232—241
[11] Shoemaker C M, Queen J, Crews D. Response of candidate sex-determining genes to changes in temperature reveals their involvement in the molecular network underlying temperature-dependent sex determination [J]. Molecular Endocrinology, 2007, 21(11): 2750—2763
[12] Kettlewell J R, Raymond C S, Zarkower D. Temperaturedependent expression of turtle Dmrtl prior to sexual differentiation [J]. Genesis, 2000, 26(3): 174—178
[13] Zanaria E, Walker A P. Mutations in the DAX-1 gene give rise to both X-linked adrenal hypoplasia congenita and hypogonadotropic hypogonadism [J]. Nature, 1994, 372(607): 635—641
[14] Jamil A E, Kanhoush R, Magre S, et al. Sex-specific expression of SOX9 during gonadogenesis in the amphibian Xenopus tropicalis [J]. Developmental Dynamics, 2008, 237(10): 2996—3005
[15] Zhu D Y. Morphological and histological observation of gonadal development in soft-shelled turtle, Trionyx sinensis [J]. Acta Hydrobiologica Sinica, 2009, 33(5): 924—930 [朱道玉. 中华鳖性腺的发生与发育研究. 水生生物学报, 2009, 33(5): 924—930]
[16] Dodd K L, Wibbels T. Estrogen inhibits caudal progression but stimulates proliferation of developing Mullerian ducts in a turtle with temperature-dependent sex determination [J]. Comparative Biochemistry and Physiology A-Molecular & Integrative Physiology, 2008, 150(3): 315—319
[17] Ramsey M, Crews D. Steroid signaling and temperature dependent sex determination-reviewing the evidence for early action of estrogen during ovarian determination in turtles [J]. Seminars in Cell & Developmental Biology, 2009, 20(3): 283—292
[18] Brian E V, Michael A E, Larry G T, et al. Sex-determining mechanisms in squamate reptiles [J]. Journal of Experimental Zoology, 1994, 270(1): 45—56
[19] Jeyasula P, Allen R P. Embryonic brain-gonadal axis in temperature-dependent sex determination of reptiles: A role for P450 aromatase (CYP19) [J]. Journal of Experimental Zoology, 1998, 281(5): 428—449
[20] Schulz R, de Franca L, Lareyre J, et al. Spermatogenesis in fish [J]. General and Comparative Endocrinology, 2010, 165(3): 390—411
[21] Pieau C, Girondot M, Mercier N R, et al. Temperaturesensitive of sexual differentiation of gonads in the European pond turtle: Hormonal involvement [J]. Journal of Experimental Zoology, 1994, 270(1): 86—94
[22] Tousignant A, Crews D. Effect of exogenous estradiol applied at different embryonic stages on sex determination, growth, and mortality in the leopard gecko (Eublepharis macularius) [J]. Journal of Experimental Zoology, 1994, 268(1): 17—21
[23] Hirai N, Nanba A, Koshio M, et al. Feminization of Japanese medaka Oryzias latipes exposed to 17-β estradiol: Formation of testis–ova and sex-transformation during early-ontogeny [J]. Aquatic Toxicology, 2006, 77(1): 78—86
[24] Edwards T M, Moore B C, Guillette L G. Reproductive dysgenesis in wildlife: a comparative view [J]. International Journal of Andrology, 2006, 29(1): 109—121
[25] Wibbels T, Crews D. Putative aromatase inhibitor induces male sex determination in a female unisexual lizard and in a turtle with temperature-dependent sex determination [J]. Journal of Endocrinology, 1994, 141(2): 295—299
[26] Crews D, Bergeron J M. Role of reductase and aromatase in sex determination in the red-eared slider (Trachemys scripta), a turtle with temperature-dependent sex determination [J]. Journal of Endocrinology, 1994, 143(2): 279—289
[27] Olmstead A W, Kosian P A, Korte J J, et al. Sex reversal of the amphibian, Xenopus tropicalis, following larval exposure to an aromatase inhibitor [J]. Aquatic Toxicology, 2009, 91(2): 143—150
[28] Smith C A, Katz M, Sinclair A H. DMRT1 is upregulated in the gonads during female to male sex reversal in ZW chicken embryos [J]. Biology of Reproduction, 2003, 68(2): 560—570
[29] Barrionuevo F, Bagheri-Fam S, Klattig J, et al. Homozygous inactivation of Sox9 causes complete XY sex reversal in mice [J]. Biology of Reproduction, 2006, 74(1): 195—201
[30] Kobayashi A, Chang H, Chaboissier M C, et al. Sox9 in testis determination [J]. Annals of the New York Academy of Sciences, 2005, 1061(1): 9—17
[31] Morrish B C, Sinclair A H. Vertebrate sex determination: many means to an end [J]. Reproduction, 2002, 124(4): 447—457
[32] Murdock C, Wibbels T. Dmrt1 expression in response to estrogen treatment in a reptile with temperature-dependent sex determination [J]. Journal of Experimental Zoology Part B Molecular and Developmental Evolution, 2006, 306(2): 134—139
[33] Durando M, Cocito L, Rodriguez H A, et al. Neonatal expression of amh, sox9 and sf-1 mRNA in Caiman latirostris and effects of in ovo exposure to endocrine disrupting chemicals [J]. General and Comparative Endocrinology, 2013, 191(1): 31—38
[34] Barske L A, Capel B. Estrogen represses SOX9 during sex determination in the red-eared slider turtle Trachemys scripta [J]. Developmental Biology, 2010, 341(1): 305—314
[35] Murdock C, Wibbels T. Expression of Dmrt1 in a turtle with temperature-dependent sex determination [J]. Cytogenetic and Genome Research, 2003, 101(3-4): 302—330
THE EFFECTS OF ESTROGEN ON GONADAL DIFFERENTIATION AND EXPRESSIONS OF DMRT1 AND SOX9 IN PELODISCUS SINENSIS
WANG Li1,2, HU Tao1, MI Meng-Dong1,YANG Ke-Zhou1, QIAN Guo-Ying1,2and GE Chu-Tian1
(1. College of Biological and Environmental Sciences, Zhejiang Wanli University, Ningbo 315100, China; 2. College of Fisheries and Life Sciences, Shanghai Ocean University, Shanghai 201306, China)
The molecular mechanism of sex determination in Pelodiscus sinensis has been a long-standing mystery. In many vertebrate species, estrogens play a key role in sex determination and gonadal differentiation. To investigate the effect of estrogens in the gonadal differentiation of P. sinensis and the underlying molecular mechanism, we treated the undifferentiated embryos with 17β-estradiol (E2) and aromatase inhibitor (AI). Results showed that the female ratio increased by 92.3% after E2treatment, whereas female ratio in AI treatment group decreased dramatically to 13.1%. Meanwhile, the obvious masculinization of genetically female embryos and feminization of genetically male embryos were observed after AI and E2treatment, respectively. Moreover, RT-PCR and immunofluorescence analysis showed that E2could significantly downregulated mRNA and protein expressions of DMRT1 and SOX9, which were the key factors involving in male development. However, AI exerted the opposite effect. In conclusion, estrogens inhibited the male development via the inhibition of expression of DMRT1 and SOX9, and consequently led to female development, indicating the important role of estrogens in the female sexual differentiation in Pelodiscus sinensis.
Estrogens; DMRT1; SOX9; Sexual differentiation; Gonadal development; Pelodiscus sinensis
Q344+.1
A
1000-3207(2014)03-0467-07
10.7541/2014.66
2013-08-29;
2013-12-25
国家自然科学基金(31101884); 973计划前期专项(2011CB111513); 浙江省公益性技术应用研究项目(2013C32054);宁波市科技创新团队(2012B82016); 宁波市自然科学基(2012A610142)资助
王莉(1987—), 女, 山西吕梁人; 硕士研究生; 主要从事龟鳖类性别决定研究。E-mail: wlerdans@gmail.com
葛楚天(1983—), 男, 浙江宁海人; 博士, 副教授, 硕士生导师; 主要研究为动物生殖生物学。E-mail: cge@zwu.edu.cn
