微藻培养基平衡pH的研究
2014-03-29丹朱晓艳温小斌耿亚红李夜光
张 丹朱晓艳温小斌耿亚红李夜光
(1. 中国科学院武汉植物园, 中国科学院植物种质创新与特色农业重点实验室, 武汉 430074; 2. 中国科学院大学, 北京 100049)
微藻培养基平衡pH的研究
张 丹1,2朱晓艳1,2温小斌1,2耿亚红1李夜光1
(1. 中国科学院武汉植物园, 中国科学院植物种质创新与特色农业重点实验室, 武汉 430074; 2. 中国科学院大学, 北京 100049)
“平衡pH”是“培养基中二氧化碳分压与空气中二氧化碳分压平衡时的pH”, 是微藻培养基的一个重要特征参数。选用常用的三种微藻培养基: BG11培养基、BBM培养基和Zarrouk培养基, 使用鼓泡通入空气的方法, 研究碳源、氮源、磷源浓度和盐度对培养基平衡pH的影响。结果如下: 在NaHCO3浓度0—16.8 g/L范围内, 三种培养基的平衡pH都随碳源浓度的增加而升高; NaNO3浓度在0—2.5 g/L范围内, 对培养基平衡pH没有影响; 0.1 g/L KH2PO4使BG11培养基的平衡pH稍有升高, 与之相反, BBM培养基的平衡pH稍有下降, 进一步提高磷(P)浓度(最高 0.4 g/L), BG11培养基和 BBM培养基的平衡 pH不再变化; P浓度变化对Zarrouk培养基的平衡pH没有影响; 三种培养基的平衡pH都随盐度的升高而降低。碳源浓度是影响培养基平衡 pH的最主要因素, 平衡 pH与碳源浓度的关系可以用回归方程 y=0.3504ln(x)+8.9647(R2=0.9708)表示,氮源浓度对平衡pH没有显著影响, 磷源浓度和盐度对培养基平衡pH有影响, 但影响不大。控制藻液pH不低于平衡pH, 可以提高微藻培养中CO2的利用效率, 有利于实现微藻CO2生物固定的环境效益。
微藻; 平衡pH; 培养基; 碳浓度
世界上商业化生产的微藻(Micro algae)主要有螺旋藻(Spirulina)、小球藻(Chlorella)、红球藻(Haematococcus)和杜氏藻(Dunaliella)等[1—4], 已经被开发为保健品和珍贵水产品的饲料添加剂。某些微藻细胞中可以积累大量油脂, 其中的三酰甘油酯(TAG)经过转酯化生成脂肪酸甲酯, 就是生物柴油,可以替代化石燃料[5,6], 利用微藻生产生物柴油具有多种优势[7,8]。微藻有望成为继粮食作物生物乙醇、纤维素生物乙醇和陆生作物生物柴油之后第三代生物质能源的原材料[9]。
目前, 规模化培养微藻都是采用液体培养, 如何高效地向藻液中补充 CO2, 一直是研究者们关注的一个问题[10]。研究者们注意到, 在一定的条件下, 藻液中的CO2会向空气中释放, 造成碳源的浪费[11,12]。李夜光等[13,14]研究发现藻液的 pH决定螺旋藻培养液向空气中释放 CO2, 还是从空气中吸收 CO2, 当藻液的 pH高于“培养液的 CO2浓度与空气中 CO2浓度相平衡时的 pH”, 藻液从空气中吸收 CO2, 反之, 藻液向空气中释放 CO2。我们在培养微藻的过程中发现“培养液的 CO2浓度与空气中 CO2浓度相平衡时的 pH”是微藻培养基的一个重要特征参数,将其称为“空气平衡 pH”, 简称“平衡 pH”, 并给“平衡pH”一个规范的定义: “培养基中二氧化碳分压与空气中二氧化碳分压平衡时的 pH”。与螺旋藻培养基一样, 当各种微藻培养基 pH低于其“平衡 pH”,藻液向空气中释放 CO2, 随着 CO2的释放, 培养基pH升高, 直到达到平衡pH, 培养基不再向空气中释放CO2; 当培养基的pH高于平衡pH, 培养基从空气中吸收CO2, 随着CO2的吸收, 培养基pH下降, 直到达到平衡 pH, 培养基不再从空气中吸收 CO2, 此时, CO2的吸收和释放达到动态平衡。利用烟道气中的 CO2为碳源培养产油微藻是目前微藻生物柴油研发的一个重要指导思想。对于大规模培养, 如何高效地利用CO2, 尽量减少培养过程中CO2向空气的释放,是必须解决的关键技术问题。目前, 未见对微藻培养基平衡pH深入研究的报道。
本文选择有代表性的三种培养基, BG11培养基、BBM培养和Zarrouk培养基, 研究培养基的主
1 材料与方法
改良的BG11培养基[15]; BBM培养基; 改良的Zarrouk培养基(除NaHCO3浓度根据实验设计变化外, 培养基其他成分及浓度与Zarrouk培养基相同)。
1.2 碳源、氮源、磷源及盐度浓度设置
碳源、氮源、磷源及盐度实验使用的药品及其浓度见表1。
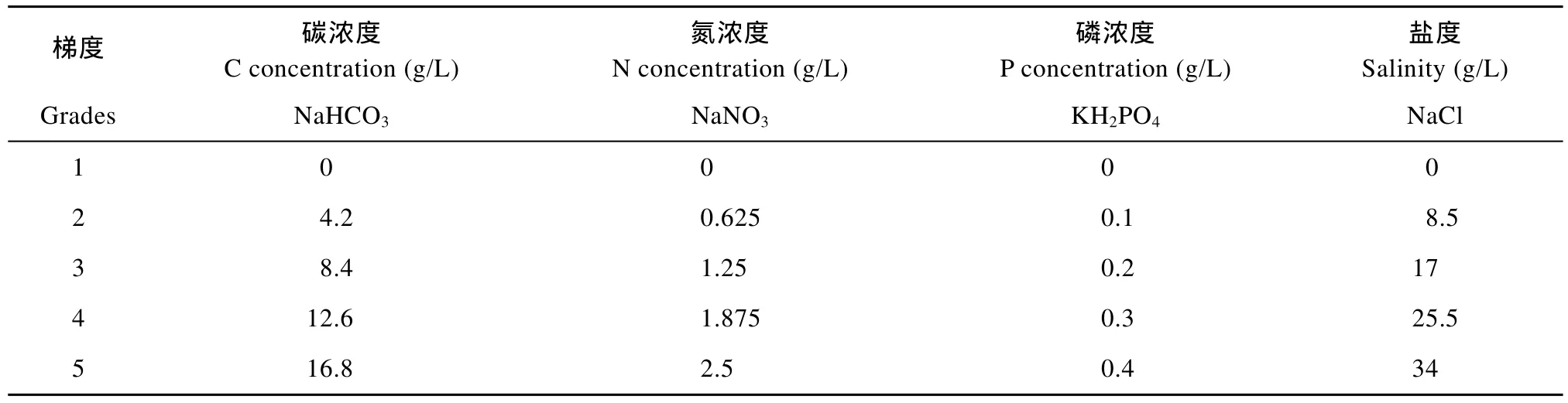
表1 培养基 C、N、P浓度及盐度Tab. 1 Salinity and the concentration of C, N and P of the medium
根据表1中的浓度配制BG11、BBM、Zarrouk培养基。BG11培养基的磷源为K2HPO4·3H2O, BBM培养基的磷源为K2HPO4·3H2O和KH2PO4, Zarrouk培养基的磷源为KH2PO4。
1.3 实验装置及实验条件
1.4 培养基pH的测定
采用 MODEL 868 pH 计(Thermo Electron Corporation)测定培养基的pH。
1.5 培养基平衡pH的测定
取200 mL培养基于通气培养装置的玻璃培养管中(每种处理设3个平行样), 在液面处做标记。向培养基中通入空气, 每隔一段时间测定培养基的 pH,测pH之前向玻璃培养管中加入蒸馏水使液面回到初始位置, 补充蒸发的水分。待培养基的pH没有显著变化时停止通气, 此时的pH即为培养基的平衡pH。
2 结果
2.1 碳源浓度对培养基平衡pH的影响
向不同碳源浓度的培养基鼓泡通入空气, BG11、BBM和Zarrouk培养基的pH表现出相同的变化趋势, 这种变化又分为两种模式: (1)没加碳源的培养基pH基本没有变化, 维持初始的pH; (2)补加碳源的培养基的 pH在通气后的 5h内快速升高, 5—10h, pH上升明显减缓, 10h后, pH虽然随着通气时间的延长而升高, 但是变化已经非常缓慢, 30h后, pH达到稳定(图1)。
培养基的pH保持稳定, 说明培养基向空气中释放 CO2的速率与从空气中吸收 CO2的速率相同, 表示培养基中CO2的分压等于空气中CO2的分压[14,16],根据平衡pH的定义, 对应的pH就是培养基的平衡pH。不同碳源浓度培养基的平衡pH见表2。
2.2 氮源浓度对培养基平衡pH的影响
不同氮源浓度的 BG11和BBM培养基的初始pH分别在7.8和6.7上下, 通气后, BG11和BBM培养基的 pH稍有下降, 很快分别稳定在 7.3和 6.6上下(图未显示);不同氮源浓度的Zarrouk培养基的初始pH在7.8上下, 在通气后, 30h后达到稳定(图未显示)。不同氮源浓度的BG11、BBM和Zarrouk培养基的平衡pH如表3所示。
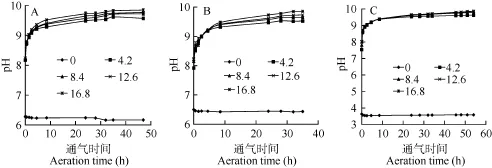
图1 不同碳源浓度的培养基pH随通气时间的变化Fig. 1 pH value-time course of medium with different concentration of carbon during bubbling aeration
2.3 磷源浓度对培养基平衡pH的影响
不同磷源浓度的BG11和BBM培养基的初始pH分别为6.9—7.8和6.18—8.57, 在通气后, BG11和BBM培养基的pH稍有下降, 逐步达到稳定; 不同磷源浓度的 Zarrouk培养基的初始 pH 在7.71—8.19范围内, 在通气后, pH逐步上升, 30h后达到稳定(图未显示)。不同磷源浓度的BG11、BBM和Zarrouk培养基的平衡pH如表4所示。
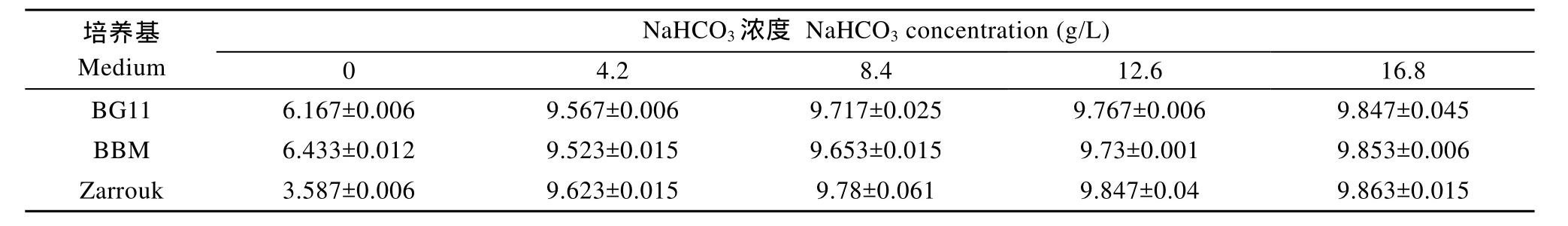
表2 不同碳源浓度培养基的平衡pH(平均值±标准差) Tab. 2 Equilibrium pH values (means±SD) of medium with different concentration of NaHCO3
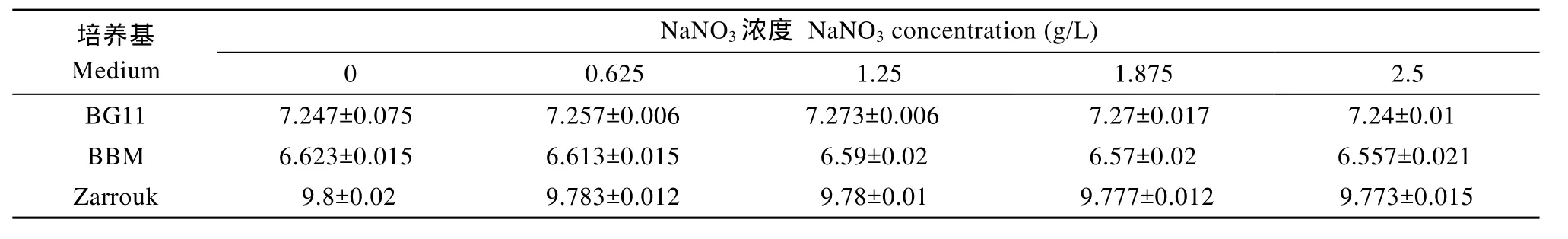
表3 不同氮源浓度培养基的平衡pH(平均值±标准差)Tab. 3 Equilibrium pH values (means±SD) of medium with different concentration of NaNO3

表4 不同磷源浓度培养基的平衡pH(平均值±标准差)Tab. 4 Equilibrium pH values (means±SD) of medium with different P concentration
2.4 盐度对培养基平衡pH的影响
不同盐度的BG11和BBM培养基的初始pH分别为7.3—7.5和5.9—6.3, 通气后, BG11和BBM培养基的pH稍有下降, 10h后达到稳定; 不同盐度的Zarrouk培养基的初始 pH7.6—7.8, 在通气后, pH逐步上升, 35h后达到稳定(图未显示)。不同盐度的BG11、BBM和 Zarrouk培养基的平衡 pH如表 5所示。
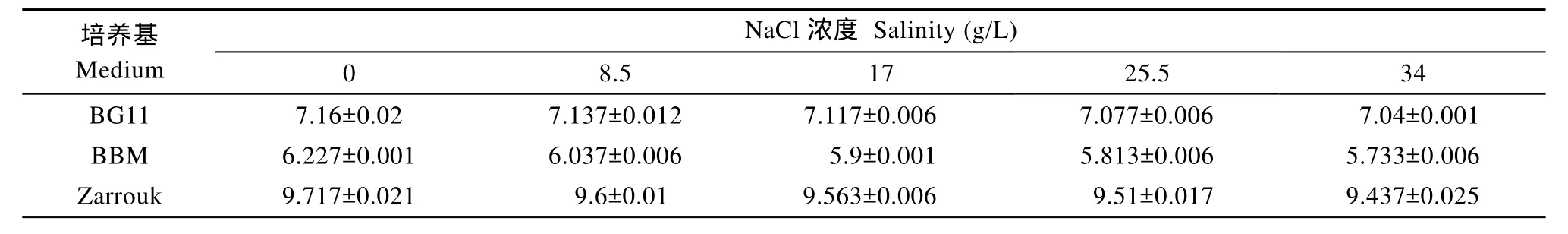
表5 不同盐度培养基的平衡pH(平均值±标准差)Tab. 5 Equilibrium pH values (means±SD) of medium with different salinities
3 讨论
3.1 碳源浓度对平衡pH的影响
培养基“平衡pH”的定义是: 培养基中二氧化碳分压与空气中二氧化碳分压相等时的 pH。空气中CO2相对稳定, 培养基中二氧化碳分压主要取决于碳源的浓度, 可见, 碳源浓度是影响微藻培养基平衡pH的主要因素。


表 2数据显示, 当培养基其他成分不变, 随着碳源浓度的增加, 平衡pH先快速升高, 碳源浓度对培养基的平衡 pH的影响达到极显著水平(P<0.01);然后升高幅度趋于缓慢, 当碳源浓度达到4.2 g/L时,平衡 pH几乎不再随着碳源浓度的增加而升高, 碳源浓度的影响不显著(P>0.05)。出现这种情况很可能与 CO2的活度有关, 当碳源浓度较高时, 随着碳源的进一步增加, 虽然 CO2的浓度增加, 但是其活度并未显著增加, CO2分压相应也没有显著增加, 平衡pH基本不变。
除了不加碳源使Zarrouk培养基的平衡pH明显低于BG11和BBM培养基, 其他碳源浓度下, 三种培养基的平衡pH很接近。以BG11培养基为例, 将平衡pH对碳源浓度做图(图2), 培养基平衡pH与碳源浓度的关系可以用回归方程 y=0.3504ln(x)+8.9647 (R2=0.9708)表示。
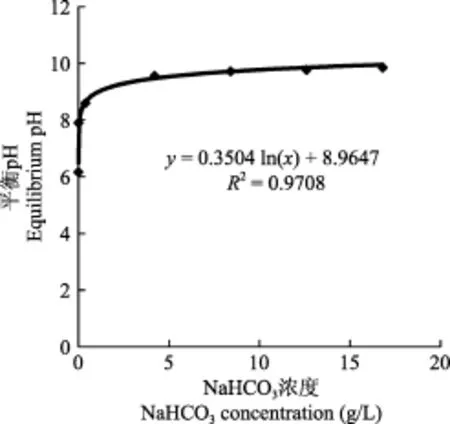
图2 平衡pH随碳源浓度的变化Fig. 2 Equilibrium pH values changing with NaHCO3concentrations
3.2 氮源浓度对平衡pH的影响
BBM培养基不含碳源, BG11培养基含有低浓度碳源(0.02 g/L Na2CO3), Zarrouk培养基含有高浓度碳源(6 g/L NaHCO3), 三种培养基的平衡pH都不随氮源浓度的改变而变化(P>0.05)(表 3), 表明无论培养基 CO2分压高或低, 都不受氮源(NaNO3)浓度变化的影响。氮源浓度对平衡pH没有影响, 我们认为有两方面原因: (1)NaNO3是中性化合物, 不能与三种碳源形式发生任何的化学反应从而影响化学反应方程式(1)和(2)的平衡移动; (2)在实验设定的浓度范围内, NaNO3浓度的变化没有对CO2的活度产生显著的影响。
3.3 磷源浓度对平衡pH的影响
磷源(K2HPO4·3H2O、KH2PO4)浓度对 BG11和BBM培养基的平衡pH有一定作用, 但是影响不大。0.1 g/L磷源小幅度提高了BG11培养基的平衡pH,但是却小幅度降低了BBM培养基的平衡pH, 磷源浓度的进一步升高, 两种培养基的平衡 pH基本不再变化(表4)。为什么磷源提高BG11的平衡pH, 却降低了BBM的平衡pH?可能与两种培养基的化学成分不同有关: BG11培养基含有少量Na2CO3(0.02 g/L), BBM 培养基不含碳源; BG11培养基的磷源是K2HPO4·3H2O, BBM培养基的磷源是K2HPO4·3H2O+ KH2PO4。
磷源浓度对Zarrouk培养基的平衡pH没有显著影响(P>0.05), 是因为 Zarrouk培养基中的 NaHCO3浓度高(6 g/L), NaHCO3是决定培养基平衡pH的因素, 磷源对平衡pH的影响不能表现出来。
3.4 盐度对平衡pH的影响
盐度降低了三种培养基的平衡 pH(表 5)。盐度是影响CO2溶解度的重要因素, 盐度越高CO2溶解度越低[16]。CO2溶解度降低, 其分压降低, 平衡 pH随之降低。
实验设置的最高盐度是 34, 达到海水的盐度。NaCl浓度由0升高到34 g/L, 三种培养基的平衡pH没有大幅度变化。可以推测, 如果用海水配制BG11、BBM和Zarrouk三种培养基, 其平衡pH稍有降低, 但是变化不会太大。也就是说, 本文研究的培养基主要成分对平衡 pH影响的结果, 也基本适用于海水培养基。
3.5 藻细胞对平衡pH的影响
在光照条件下, 藻细胞进行光合作用, 吸收利用培养基中的碳源, 使培养基pH不断升高[15]。所以,直接测定藻细胞对平衡 pH的影响是非常困难的。从理论上分析, 藻细胞进行光合作用吸收利用培养基中的碳源, 使培养基碳源浓度降低, 平衡pH随之降低; 藻细胞还同时吸收利用培养基中的氮源和磷源, 氮源浓度改变不影响培养基平衡 pH; 但是, 磷源浓度改变会对BG11培养基和BBM培养基的平衡pH产生一定的影响(表4)。所以, 藻细胞对平衡pH的影响主要是通过改变碳源、磷源等营养成分的浓度间接发挥作用。
3.6 平衡pH概念的扩展及其在微藻培养中应用
平衡pH是“空气平衡pH”的简称, 特指培养基的CO2分压与空气中CO2的分压平衡时的pH。以CO2为碳源培养微藻, 通常是将 CO2与空气以一定比例混合[1%—5% (v/v)]后通入藻液中。利用烟道气中的CO2为碳源培养微藻, CO2的比例在5%—15% (v/v)的范围内。显然, “空气平衡pH”的概念太狭窄,需要进行扩展。在平衡pH的前面标明CO2的浓度(v/v), 例如“1% CO2平衡pH”, “5% CO2平衡pH”和“15% CO2平衡pH”, 分别表示培养基的CO2分压与1%、5%、15%的混合气体中CO2分压平衡时的pH。概念扩展后, “平衡pH”适用于任何比例的CO2混合气体, 适用范围更宽。
掌握了培养基的平衡 pH, 制定 pH调控策略,在规模培养过程中控制藻液pH不低于平衡pH, 藻液中的 CO2就不会向气相中(CO2混合气体)释放,不仅可以提高微藻培养的经济效益, 而且有利于实现微藻CO2生物固定的环境效益。

[1] Richmond A. Spirulina [A]. In: Borowitzka M A, Borowitzka I J (Eds.), Micro-algal Biotechnology [C]. Cambridge: Cambridge University Press. 1988, 85—121
[2] Iwamoto H. Industrial production of microalgal cell-mass and secondary products—species of high potential: Chlorella [A]. In: Amos, Richmond (Eds.), Handbook of Microalgal Culture: Biotechnology and Applied Phycology [C]. Oxford: Blackwell Science Ltd. 2004, 255—263
[3] Zhang B Y, Geng Y H, Li Z K, et al. Production of astaxanthin from Haematococcus in open pond by two-stage growth one-step process [J]. Aquaculture, 2009, 295(3): 275—281
[4] Zhu Y H, Jiang J G. Continuous cultivation of Dunaliella salina in photobioreactor for the production of β-carotene [J]. European Food Research and Technology, 2008, 227(3): 953—959
[5] Chisti Y. Biodiesel from microalgae [J]. Biotechnology Advances, 2007, 25(3): 294—306
[6] Hu Q, Sommerfeld M, Jarvis E, et al. Microalgal triacylgly-cerols as feedstocks for biofuel production: perspective and advances [J]. Plant Journal, 2008, 54(4): 621—639
[7] Hao Z D, Liu P H, Yang X, et al. Screen and identification of tropical freshwater microalgae for lipid production [J]. Acta Hydrobiologica Sinica, 2013, 37(3): 547—552 [郝宗娣,刘平怀, 杨勋, 等. 热带淡水产油微藻的分离筛选与鉴定.水生生物学报, 2013, 37(3): 547—552]
[8] Xu J, Xu X D, Fang X T, et al. Screening and lipid analyses of high oleaginous Chlorella species [J]. Acta Hydrobiologica Sinica, 2012, 36(3): 426—432 [徐进, 徐旭东, 方仙桃, 等. 高产油小球藻的筛选及其油脂分析. 水生生物学报, 2012, 36(3): 426—432]
[9] Li J, Zhang X C, Hu H J, et al. Prospects and research strategies for the microalgal industry [J]. Chinese Science Bulletin, 2012, 57(1): 23—31 [李健, 张学成, 胡鸿钧, 等.微藻生物技术产业前景和研发策略分析. 科学通报, 2012, 57(1): 23—31]
[10] Märkl H, Mather M E. Mixing and aeration of shallow open pond [A]. In: Becker W, Tubingen (Eds.), Advance in Limnology, Vol. 20, Production and use of microalgae [C]. Germany , E: Schweizerbart’Sche Verlags Buchhandlung . 1985, 20: 85—93
[11] Livansky K. Losses of CO2in outdoor mass algal cultures: determination of the mass transfer coefficient KL by means of measured pH course in NaHCO3solution [J]. Archiv für Hydrobiologie. Supplementband. Untersuchungen des Elbe-Aestuars, 1990, 85: 87—97
[12] Vasquez V, Heussler P. Carbon dioxide balance in open air mass culture of algae [A]. In: Becker W, Tubingen (Eds.), Advance in Limnology, Vol. 20, Production and use of microalgae [C]. Germany, E: Schweizerbart’Sche Verlags Buchhandlung. 1985, 20: 95—113
[13] Li Y G, Hu H J, Gong X M. Studies on the mechanism of pH value change and carbon conversion ratio of Spirulina media [J]. Chinese Journal of Biotechnology, 1996, 12(sl): 242—248 [李夜光, 胡鸿钧, 龚小敏. 螺旋藻培养液pH变化的机理和碳源利用率的研究. 生物工程学报, 1996, 12(增刊): 242—248]
[14] Li Y G, Hu H J. Studies on the characteristics of absorption of CO2by Spirulina medium [J]. Journal of Wuhan Botanical Research, 1996, 14(3): 253—260 [李夜光, 胡鸿钧. 螺旋藻培养液吸收CO2特性的研究. 武汉植物学研究, 1996, 14(3): 253—260]
[15] Zhang G Y, Wen X B, Liang F, et al. The effects of physical and chemical factors on the growth and lipid production of Chlorella [J]. Acta Ecologica Sinica, 2011, 31(8): 2076—2085
[张桂艳, 温小斌, 梁芳, 等. 重要理化因子对小球藻生长和油脂产量的影响. 生态学报, 2011, 31(8): 2076—2085]
[16] Gu F Y. Solubility of Carbon dioxide in aqueous sodium chloride solution under high pressure [J]. Journal of Chemical Engineering of Chinese Universities, 1998, 12(2): 118—123 [顾飞燕. 加压下二氧化碳在氯化钠水溶液中的溶解度. 高校化学工程学报, 1998, 12(2): 118—123]
STUDIES ON EQUILIBRIUM PH VALUES OF MICRO ALGAL MEDIUM
ZHANG Dan1,2, ZHU Xiao-Yan1,2, WEN Xiao-Bin1,2, GENG Ya-Hong1and LI Ye-Guang1
(1. Key Laboratory of Plant Germplasm Enhancement and Speciality Agriculture, Wuhan Botanical Garden, Chinese Academy of Sciences, Wuhan 430074, China; 2. University of Chinese Academy of Sciences, Beijing 100049, China)
Equilibrium pH value, one of the important chemical parameter of medium, is the pH value when CO2partial pressure in the micro alga medium equals to CO2partial pressure in the air. The three mostly used medium (BG11 medium, BBM medium and Zarrouk medium) were used to study the effects of carbon, nitrogen and phosphorus concentration and salinity on the equilibrium pH value by air bubbling aeration of the medium. Our results demonstrated that the increased NaHCO3concentration in the range of 0—16.8 g/L enhanced the equilibrium pH values of all three medium. In the concentration range of 0—2.5 g/L, NaNO3had no significant effect on equilibrium pH value of these three medium. 0.1 g/L KH2PO4raised the equilibrium pH value of BG11 medium, but decreased it in BBM medium. The further increased P concentration (maximum 0.4 g/L) did not regulate the equilibrium pH value of both BG11 and BBM medium. The P concentration in the range of 0—0.4 g/L did not affect the equilibrium pH value of Zarrouk medium. The salinity in the range of 0—34 decreased the Equilibrium pH value of all three medium. Carbon concentration is the most important factor to influence the equilibrium pH value of micro algae medium, and the relationship between equilibrium pH value and carbon concentration can be described with the regression equation: y=0.3504ln(x)+8.9647 (R2=0.9708). N concentration had no significant effect on equilibrium pH value. P concentration and salinity had limited impact on equilibrium pH value. The efficiency of CO2utilization will be improved at higher pH value compared with the equilibrium pH value. These results support the environmental benefit of biofixation of CO2by micro algae.
Microalgae; Equilibrium pH value; Medium; Carbon concentration
Q93-335
A
1000-3207(2014)03-0401-06
10.7541/2014.57
2013-03-28;
2013-10-14
中国石化集团微藻生物柴油成套技术开发项目(No. 210080); 国家“863”项目(No. 2013AA065805); 国家自然科学基金项目(No. CNSF31272680)资助
张丹(1987—), 女, 山东济宁人; 硕士研究生; 主要从事藻类学研究。E-mail: lantian0224@126.com
李夜光, E-mail: yeguang@wbgcas.cn
