饲料中非蛋白能量源对草鱼血清生化指标和肝脏组织的影响
2014-03-29郭小泽梁旭方袁小琛
郭小泽 梁旭方 方 刘 袁小琛 周 怡 李 彬
(华中农业大学水产学院, 农业部淡水生物繁育重点实验室, 武汉 430070)
饲料中非蛋白能量源对草鱼血清生化指标和肝脏组织的影响
郭小泽 梁旭方 方 刘 袁小琛 周 怡 李 彬
(华中农业大学水产学院, 农业部淡水生物繁育重点实验室, 武汉 430070)
在鱼类饲料中, 脂肪和碳水化合物是两种主要的非蛋白能量源。饲料中添加适量的非蛋白能量源可以节约蛋白质、减少鱼体氮排泄对养殖水体的污染[1]。然而, 饲料中添加高水平的非蛋白能量源会影响鱼类的摄食和生长、造成鱼体脂肪大量蓄积, 影响肉质和风味[2,3], 并且大量的脂肪蓄积会增加其在体内的过氧化, 导致生理状态发生变化影响鱼体的健康[4,5]。在鱼类中, 肝脏是鱼体最重要的代谢器官, 经常被作为营养和生理代谢状况的指示性器官, 饲料中不同营养素可使鱼类的肝脏组织发生变化[6,7]。同时, 鱼类的血液与机体的代谢、营养状况及疾病有着密切的关系, 当鱼体受到外界因素的影响而发生生理或病理变化时, 必定会在血液指标中反映出来[8]。
草鱼(Ctenopharyngodon idella)是我国主要淡水养殖品种之一, 关于草鱼对非蛋白能量源的营养需求已经有一些报道。 Du, et al.[9]报道草鱼对能量的需求相对比较低, 饲料中脂肪含量高于 6%就会对草鱼的生长性能和体组成产生不良影响。Gao, et al.[10]研究发现饲料中碳水化合物和脂肪的含量分别为27.47%和5.87%时草鱼生长最快。Tian, et al.[11]报道在饲料中蛋白质含量为23%时, 草鱼对小麦淀粉的需求量不超过33%。但是在生产中, 人们为了追求较高的经济效益普遍在饲料中添加较高水平的非蛋白能量源, 从而导致草鱼体内大量脂肪蓄积和营养性脂肪肝的发生[12]。本实验旨在研究饲料中高水平的非蛋白能量源饲料对草鱼血清生化指标和肝脏组织学的影响,为非蛋白能量源在草鱼饲料中的合理运用提供相关理论依据。
1 材料与方法
1.1 实验设计和饲料
实验设计了 4组等氮配合饲料, 分别为对照组(Control)、高纤维组(High-CEL)、高糖组(High-CBH)和高脂组(High-LIP)。实验饲料配方和营养成分如表1所示。饲料原料均购自武汉天龙饲料有限公司, 原料粉碎经过40目筛后混匀, 经螺旋压杆制粒机制成粒径为2 mm的颗粒, 自然风干后, 置于–20℃冰箱中备用。
1.2 实验鱼和养殖条件
实验草鱼购于武汉市水产科学研究所, 购回后用5%氯化钠溶液浸泡5min进行消毒处理, 然后暂养于华中农业大学水产学院的控温流水循环系统中。暂养期间, 投喂商品饲料(购自武汉天龙饲料有限公司)进行驯化。经2周驯化后, 挑选 360尾体质健康、规格整齐一致[初均重(60±2.5) g]的个体, 随机分成4组, 每组3个平行, 每个平行30尾鱼, 饲养于控温流水循环系统的12个圆柱形塑料桶(半径0.6 m, 高1.2 m, 容积为 1360 L)中, 进行正式实验。每天饱食投喂三次, 时间分别为8: 30、12: 30、16: 30。实验期间, 每天吸污一次, 并且每天冲洗滤布, 日夜连续充气增氧。整个实验期间每天记录水温、pH、溶氧和氨氮, 分别为(28.5 ± 1.5)℃、7.5 ± 0.33、 (6.5 ± 0.5) mg/L、(0.15 ± 0.03) mg/L。养殖9周后, 进行样品采集。
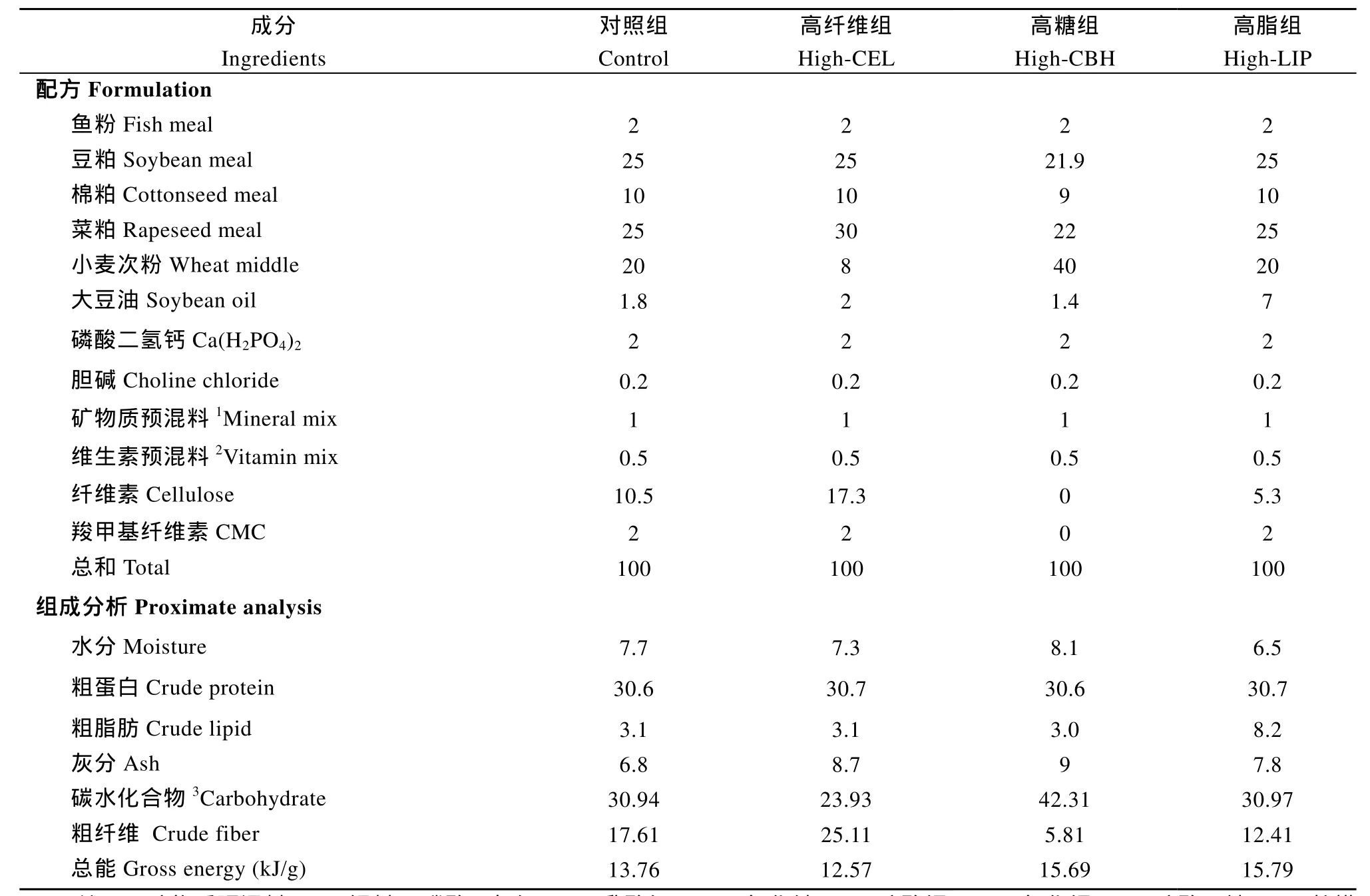
表1 实验饲料组成和化学成分(%干物质)Tab. 1 Formulation and chemical composition of the experimental diets (% dry matter)
1.3 样品采集与分析
养殖实验结束后禁食24h, 每组随机取6条鱼, 用MS-222(100 mg/L)麻醉后, 测量体长和体重。尾静脉采血,解剖并分离肝脏, 将肝脏进行称重, 记录并计算肝体指数。肝体指数(Hepatosomatic index, HSI ) = 100×肝脏重/鱼体重。
肝脏固定于10%的福尔马林缓冲液中, 按常规组织切片法进行脱水、石蜡包埋、切片和HE染色(苏木精-伊红), 在显微镜下观察肝脏组织形态并拍照。
将采集的血液样品在37℃下凝血1—2h(不加抗凝剂), 4℃冰箱过夜(让血块凝固), 4℃条件下, 3000 r/min 离心10min, 小心吸取上层血清, 用于检测甘油三酯(TG)、总胆固醇(CHO)、血糖(GLU)、总蛋白(TP)、总胆红素(TB)、直接胆红素(DBIL)和尿素氮(BUN)含量及谷丙转氨酶(ALT)、谷草转氨酶(AST)和碱性磷酸酶(ALP)的活性。以上检测指标均用南京建成生物工程研究所的试剂盒进行检测。
1.4 数据统计与分析
实验数据以平均值±标准误(Mean ± SE)表示, 实验结果均采用 SPSS 11.5统计软件进行单因素方差分析(One-Way ANOVA), Duncan氏检验法进行多重比较, P<0.05 表示差异显著。
2 结果
2.1 饲料中非蛋白能量源对草鱼生长相关性状的影响
由表 2可知, 纤维组的草鱼体长、体重和肝体指数都显著低于其他三组(P<0.05); 高糖组与对照组相比, 体长和体重有上升的趋势, 但差异不显著(P>0.05), 而高脂组体重显著低于对照组(P<0.05); 高糖组的肝体指数最高,并且与对照组有显著性差异(P<0.05), 而高脂组肝体指数较对照组无显著性差异(P>0.05)。
2.2 饲料中非蛋白能量源对草鱼血液生化指标的影响
由表 3可知, 随着饲料中非蛋白能量源含量的升高,草鱼血液的生化指标也随之发生变化。高糖组和高脂组的血液中的 TG和 CHO浓度显著高于对照组和高纤维组(P<0.05), 而高纤维组TG和CHO相对于对照组有下降的趋势但不显著(P>0.05)。高糖组的ALT、AST和ALP这三种酶活性显著高于对照组和纤维组(P<0.05), 而高脂组与对照组没有显著性的差异(P>0.05), 但显著高于高纤维组(P<0.05)。高糖组和高脂组草鱼血液中的TP和BUN的浓度与对照组没有显著性差异(P>0.05), 而高纤维组显著性低于对照组(P<0.05)。饲料中不同水平的非蛋白能量源对草鱼血液中的 TBIL和 DB含量没有显著的影响(P>0.05)。高纤维组的 GLU浓度显著高于对照组和高糖组(P<0.05), 高糖组显著低于对照组(P<0.05), 而高脂组高于对照组但差异不显著(P>0.05)。
2.3 饲料中非蛋白能量源对草鱼肝脏组织的影响
对照组的肝细胞排列整齐, 有部分出现细胞肿大,但细胞核未出现偏移 (图版Ⅰ-1)。高纤维组的肝细胞排列致密整齐, 肝细胞索明显, 细胞核位于细胞中央, 细胞大小正常, 没有脂肪滴 (图版Ⅰ-2)。高糖组的肝脏细胞严重肿大变形, 细胞中充满脂肪滴, 细胞核挤压至一侧, 甚至出现细胞核萎缩或消失, 呈现透明的空泡化(图版Ⅰ-3)。脂肪组的肝细胞有稍许的肿大, 细胞浆内有大小不一的脂肪滴出现, 部分出现细胞核偏移和空泡化(图版Ⅰ-4)。
3 讨论
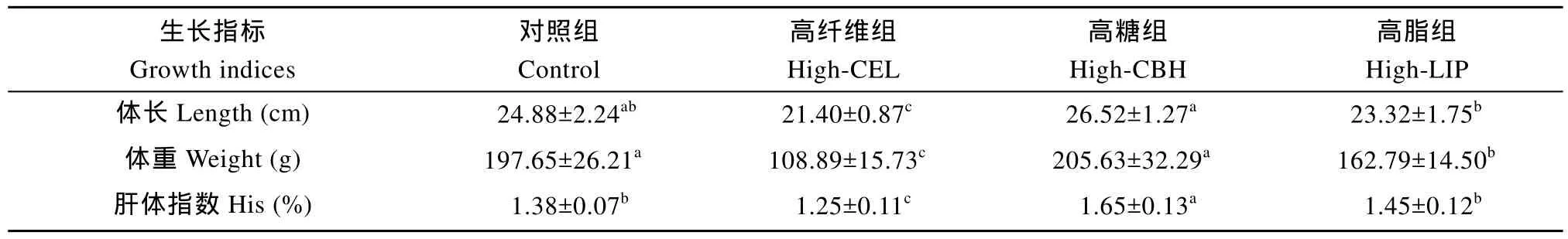
表 2 饲料中非蛋白能量源对草鱼生长的影响Tab. 2 Effect of dietary non-protein energy sources on growth of grass carp
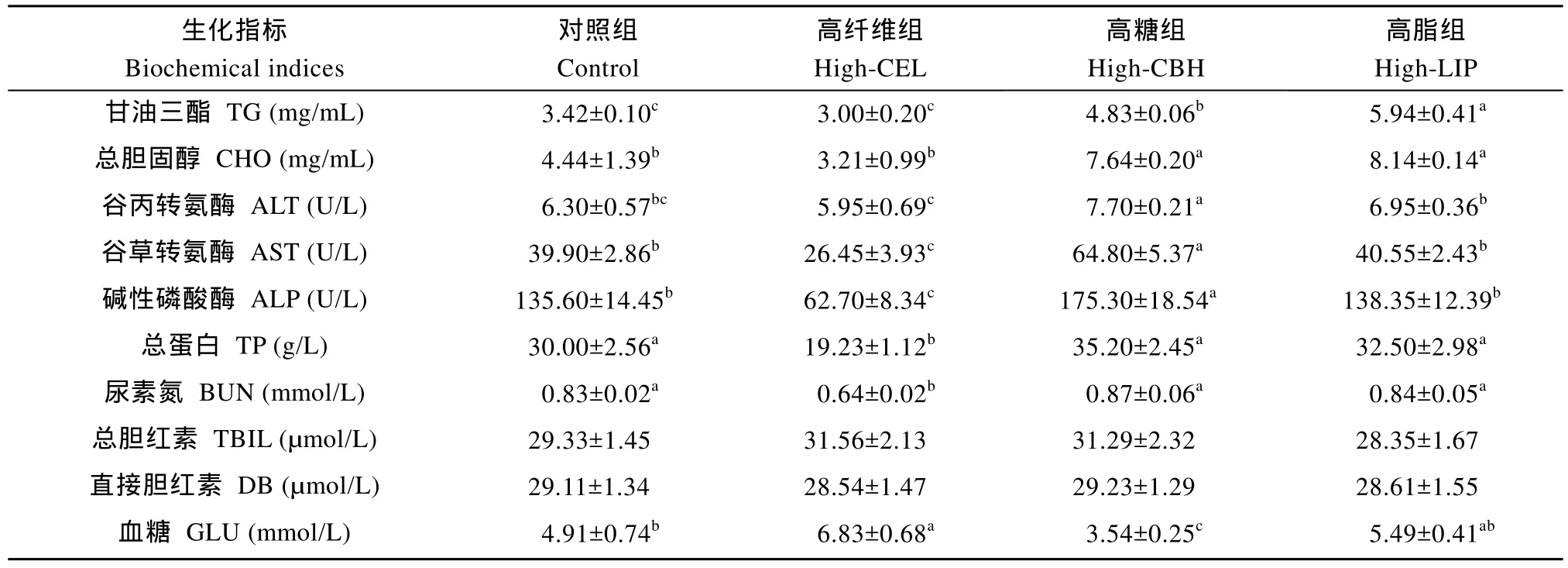
表3 饲料中非蛋白能量源对草鱼血清生化指标的影响Tab. 3 Effects of dietary non-protein energy sources on serum biochemical indices of grass carp
经过 9周的养殖实验, 四种不同非蛋白能量源的饲料对草鱼的体重有显著的影响。其中高纤维组和高脂组与对照组相比较都有显著的下降(P<0.05)。纤维素在饲料中一般起填充和粘合的作用, 鱼类很难消化纤维素[13]。黄忠志等[14]报道了草鱼饲料中纤维素含量的适宜范围为10%—20%, 饲料中纤维素含量过高会造成饲料的蛋白质及热量水平低, 影响草鱼的生长。在本实验中, 与对照组饲料相比, 高纤维组饲料中增加了纤维素的含量(粗纤维含量高达 25.11%), 相应降低了可消化碳水化合物的含量。虽然有报道指出草鱼肠道微生物可以分解纤维素, 但分解的量非常有限[15], 而且饲料中纤维素含量过高会降低饲料的适口性[16]。因此, 高纤维组草鱼体重较对照组降低的原因可能是由于饲料中可消化能水平降低所致。高脂组草鱼体重的较对照组亦有显著的降低(P<0.05), 这与Du, et al.[9]报道的当饲料中脂肪含量超过 4%时, 草鱼的生长和饲料利用率随着饲料中脂肪含量的升高而降低的结果相一致。高糖组的草鱼生长与对照组相比较没有显著性的差异(P>0.05), 这与Tian, et al.[11]报道的饲料中不同淀粉水平对草鱼生长中的研究结果不一致, 这种差异可能的原因是由于饲料配方、实验草鱼的规格及实验条件不同所造成的。在HSI方面, 高糖组的草鱼HSI显著高于对照组。这与Tian, et al.[11]报道草鱼HSI随饲料中小麦淀粉含量的增加而升高的研究结果相同。但增加饲料中脂肪的含量并未影响草鱼的HSI, 这与Du, et al.[17]在草鱼中的研究结果相一致。
鱼类血液指标被广泛运用于评价鱼体健康状况、营养状况及对环境的适应状况, 是一种良好的生理、病理和毒理学指标[18]。血清中的脂类可间接反映鱼体脂肪代谢的状况, 因为鱼体吸收外源性食物中的脂类运输到肝脏组织、肝脏组织中合成的内源性脂肪运出到肝外及脂肪组织的动员都是通过血液来完成的[19]。在本实验中, 高糖组和高脂组的草鱼血清中甘油三酯和胆固醇的含量要显著高于对照组, 并且甘油三酯的升降伴随着胆固醇的升降。摄食高糖组饲料的草鱼血脂升高的原因可能是过量的碳水化合物转化为脂类, 增加了血液中脂肪的含量[20]。但是吴建开等[21]在军曹鱼 (Rachycentron canadum) 中的研究发现, 血液中甘油三酯含量随饲料中碳水化合物水平的升高而降低。这种差异可能是由于两种鱼对碳水化合物的利用率不同所导致的。实验中草鱼血脂水平与饲料中脂肪含量呈正相关关系, 这与在其他一些鱼类中的研究结果一致[22]。然而, 一些研究结果发现, 随着饲料中脂肪水平的增加血液中甘油三酯和胆固醇的含量反而下降, 尤其是甘油三酯下降更为明显[23]。这种结果可能是由于鱼体肝脏中极低密度脂蛋白(VLDL)合成不足所导致的, 因为鱼类肝脏中的甘油三酯是通过VLDL的形式运输到肝外的[24]。
AST和ALT是存在于肝脏细胞胞浆内的两种重要的转氨酶, 在正常状态下, 血液中这两种酶的活性很低, 当肝细胞发生病变和损伤时引起细胞膜通透性增加, 导致这两种酶由细胞内释放到血液中。因此, 这两种酶在血液中的活性通常被用来指示肝脏的健康程度。研究发现, 饲料中糖的含量达到 48%时可使吉富罗非鱼(Oreochromis niloticus)和奥尼罗非鱼(Oreochromis niloticus♀ × O. aureus♂)的肝脏受到损伤, 导致血液中AST和ALT活性升高[16,25]。在本实验中, 高糖组的草鱼血液中 AST和ALT的活性显著高于对照组(P<0.05), 这与在吉富罗非鱼和奥尼罗非鱼中的研究结果相似。从肝脏组织学观察发现摄食高糖饲料组的草鱼肝细胞严重肿大变性, 细胞浆内充满脂肪滴呈空泡化, 细胞核被挤压于一侧, 部分肝细胞中细胞核萎缩或消失, 说明可能由于随着肝细胞中脂肪的大量蓄积而致使肝脏组织受到损伤[26]。然而, 高脂组的 AST和 ALT与对照组却没有显著性的差异(P>0.05),这与在其他鱼类上的研究结果不相一致[22]。在本实验的条件下, 摄食高脂肪的饲料比摄食高糖饲料对草鱼肝脏的损伤小。ALP与营养免疫相关, 在正常情况下, 血清中ALP的活性是很低的, 当肝脏或骨骼发病时, 血清中ALP酶活性会显著升高[22]。在本实验中, 高糖组的草鱼血清中 ALP显著高于对照组(P<0.05), 进一步证明了摄食高糖水平的饲料导致了草鱼肝脏损伤。
总蛋白是由白蛋白与球蛋白组成, 硬骨鱼类血清中总蛋白的含量为(30—50) g/L[27]。在本实验中, 除高纤维组显著低于正常值, 其余各组草鱼血清的总蛋白含量都在这个范围。良好的营养水平可以使血蛋白维持在较高的水平, 因此说明高纤维组的草鱼营养状况较差。血液中的胆红素大部分来自衰老红细胞裂解而释放出的血红蛋白,包括间接胆红素和直接胆红素。当肝细胞有异常时会引起直接型、中间型高胆红素血症[28]。在本研究中, 高糖组的总血红素与对照组相比没有显著的变化(P>0.05), 但有升高的趋势。而纤维组较其他组总胆红素含量最低, 说明其肝脏细胞损伤较小, 可以通过观察肝脏组织切片得到进一步的证实。血糖是反映鱼体糖代谢和全身组织细胞功能状态及内分泌机能的一个重要指标, 同时也是鱼体对饵料和营养、肝脏机能的一个反映。本实验结果发现, 草鱼血糖含量与饲料中碳水化合物水平呈负相关, 这可能是由于摄食低水平碳水化合物饲料的草鱼增强了糖异生作用, 而高糖组草鱼则增加了糖原的合成或脂肪的转化。该结果与碳水化合物水平对翘嘴红 鲌(Erythroculter ilishaeformis Bleeker)[29]、南方鲇幼鱼 (Silurus meridionalis Chen)[30]和厚唇弱棘鯻(Hephaestus fuliginosus)[18]血糖浓度影响的研究结果不一致, 造成这种差异的原因需要进一步的研究和探讨。
4 结论
饲料中高水平的非蛋白能量源对草鱼的生长、血液生化指标和肝脏组织有显著的影响, 尤其是饲料中高水平的碳水化合物更容易对肝脏组织造成损伤。因此, 在实际养殖中, 草鱼饲料中非蛋白能量源的添加量一定要科学和合理, 否则不仅会影响草鱼的生长, 而且会诱导草鱼营养性疾病的发生, 给草鱼养殖业造成不必要的经济损失。
[1] Tan Q, Xie S, Zhu X, et al. Effect of dietary carbohydrate -to - lipid ratios on growth and feed utilization in Chinese longsnout catfish (Leiocassis longirostris Günther) [J]. Journal of Applied Ichthyology, 2007, 23(5): 605—610
[2] Ai Q, Mai K, Li H, et al. Effects of dietary protein to energy ratios on growth and body composition of juvenile Japanese seabass, Lateolabrax japonicus [J]. Aquaculture, 2004, 230(1): 507—516
[3] Jafri A. Effect of dietary carbohydrate-to-lipid ratio on growth and body composition of walking catfish (Clarias batrachus) [J]. Aquaculture, 1998, 161(1): 159—168
[4] Craig S, Washburn B, Gatlin D. Effects of dietary lipids on body composition and liver function in juvenile red drum, Sciaenops ocellatus [J]. Fish Physiology and Biochemistry, 1999, 21(3): 249—255
[5] Rueda-Jasso R, L Conceicao, J Dias, et al. Effect of dietary non-protein energy levels on condition and oxidative status of Senegalese sole (Solea senegalensis) juveniles [J]. Aquaculture, 2004, 231(1): 417—433
[6] Segner H, Juario J. Histological observations on the rearing of milkfish, Chanos chanos, fry using different diets [J]. Journal of Applied Ichthyology, 1986, 2(4): 162—172
[7] Caballero M, G López-Calero, J Socorro, et al. Combined effect of lipid level and fish meal quality on liver histology of gilthead seabream (Sparus aurata) [J]. Aquaculture, 1999, 179(1): 277—290
[8] Gao L J, Shi Z H, Ai C X. Effect of dietary lipid sources on the serum biochemical indices of Acipenser schrenckii juvenile [J]. Marine Fisheries, 2005, 27(4): 319—323 [高露姣, 施兆鸿, 艾春香. 不同脂肪源对施氏鲟幼鱼血清生化指标的影响. 海洋渔业, 2005, 27(4): 319—323]
[9] Du Z Y, Liu Y J, Tian L X, et al. Effect of dietary lipid level on growth, feed utilization and body composition by juvenile grass carp (Ctenopharyngodon idella) [J]. Aquaculture Nutrition, 2005, 11(2): 139—146
[10] Gao W, Liu Y J, Tian L X, et al. Effect of dietary carbohydrate - to - lipid ratios on growth performance, body composition, nutrient utilization and hepatic enzymes activities of herbivorous grass carp (Ctenopharyngodon idella) [J]. Aquaculture Nutrition, 2010, 16(3): 327—333
[11] Tian L X, Liu Y J, Yang H J, et al. Effects of different dietary wheat starch levels on growth, feed efficiency and digestibility in grass carp (Ctenopharyngodon idella) [J]. Aquaculture International, 2012, 20(2): 283—293
[12] Tian L X, Liu Y J, Hung S S. Utilization of glucose and cornstarch by juvenile grass carp [J]. North American Journal of Aquaculture, 2004, 66(2): 141—145
[13] NRC (National Research Council). Nutrient Requirement of Fish [M]. Washington D.C: National Academy Press. 1993, 33
[14] Huang Z Z, Liao C X, Cao J Y. Effects of dietary cellulose level on growth and feed utilization of grass carp, Ctenopharyngodon idella [J]. Freshwater Fisheries, 1983, 6: 1—4 [黄忠志, 廖朝兴, 曹经晔. 饲料配方中纤维素含量对草鱼生长及饲料利用的影响. 淡水渔业, 1983, 6: 1—4]
[15] Saha S, Roy R N, Sen S K, et al. Characterization of cellulase-producing bacteria from the digestive tract of tilapia, Oreochromis mossambica (Peters) and grass carp, Ctenopharyngodon idella (Valenciennes) [J]. Aquaculture Research, 2006, 37: 380—388
[16] Wu F, Wen H, Jiang M, et al. Effects of different dietary carbohydrate levels on growth performance and blood biochemical parameters of juvenile GIFT tilapia (Oreochromis niloticus) [J]. Journal of Northwest A&F University (Nature Sciences Edition), 2012, 40(12): 9—13 [吴凡, 文华, 蒋明, 等. 饲料碳水化合物水平对吉富罗非鱼幼鱼生长性能和血液主要生化指标的影响. 西北农林科技大学学报(自然科学版), 2012, 40(12): 9—13]
[17] Du Z Y, Clouet P, Zheng W H, et al. Biochemical hepatic alterations and body lipid composition in the herbivorous grass carp (Ctenopharyngodon idella) fed high-fat diets [J]. British Journal of Nutrition, 2006, 95(5): 905—915
[18] Zhou Y, Guo W Y, Yang Z G, et al. Advances in the study of haemotological indices of fish [J]. Journal of Shanghai Fisheries University, 2001, 10(2): 163—165 [周玉, 郭文场,杨振国, 等. 鱼类血液学指标研究的进展. 上海水产大学学报, 2001, 10(2): 163—165]
[19] Xiang X, Chen J, Zhou X H, et al. Effects of five lipid sources on growth performance and serum biochemical indices of Schizothorax prenanti [J]. Chinese Journal of Animal Nutrition, 2010, 22(2): 498—504 [向枭, 陈建, 周兴华, 等. 5种脂肪源对齐口裂腹鱼生长性能及血清生化指标的影响. 动物营养学报, 2010, 22(2): 498—504]
[20] Song L P, Han B, Wang A Y, et al. The effects of dietary carbohydrate levels on growth performance and plasma biochemical indices in Hephaestus fuliginosus [J]. Journal of Dalian Ocean University, 2010, 25(4): 293—297 [宋理平, 韩勃, 王爱英, 等. 碳水化合物水平对厚唇弱棘鯻 生长和血液指标的影响. 大连海洋大学学报, 2010, 25(4): 293—297]
[21] Wu J K, Cao J M, Liang H O, et al. Effects of dietary carbohydrate levels on growth, serum biochemical indices and hepatic carbohydrate metabolic enzymes in Cobia juvenile [A]. In: Chinese Associaticin of Animal Scienice and Veterinary Medicine—The Ninth Academic Symposium, Chongqing, China [C]. 2004 [吴建开, 曹俊明, 梁海鸥, 等.饲料中碳水化合物水平对军曹鱼幼鱼生长、血清生化指标和肝脏糖代谢酶的影响. 中国畜牧兽医学会动物营养学分会——第九届学术研讨会. 中国, 重庆. 2004]
[22] Wang A M, Han G M, Feng G N, et al. Effect of dietary lipid levels on growth performance, nutrient digestibility and blood biochemical indices of GIFT tilapia (Oreochromis niloticus) [J]. Acta Hydrobiologica Sinica, 2011, 29(1): 80—87 [王爱民, 韩光明, 封功能, 等. 饲料脂肪水平对吉富罗非鱼生产性能、营养物质消化及血液生化指标的影响.水生生物学报, 2011, 29(1): 80—87]
[23] Gan H, Li J M, Feng G P, et al. Effects of different lipid levels on growth and haematological biochemistry in juvenile tilapia (Oreochromis niloticus × Oreochromis aureus) [J]. Journal of Shanghai Ocean University, 2009, 18(1): 35—41 [甘晖, 李坚明, 冯广朋, 等. 饲料脂肪水平对奥尼罗非鱼幼鱼生长和血浆生化指标的影响. 上海海洋大学学报, 2009, 18(1): 35—41]
[24] Nanton D, Lall S, McNiven M. Effects of dietary lipid level on liver and muscle lipid deposition in juvenile haddock, Melanogrammus aeglefinus L [J]. Aquaculture Research, 2001, 32(s1): 225—234
[25] Wu F, Wen H, Jiang M, et al. Effects of different dietary carbohydrate levels on growth performance, body composition and serum biochemical indices of juvenile hybrid tilapia (Oreochromis niloticus♀ × O. aureus♂) [J]. Journal of South China Agricultural University, 2011, 32(4): 91—95 [吴凡, 文华, 蒋明, 等. 饲料碳水化合物水平对奥尼罗非鱼幼鱼生长、体成分和血清生化指标的影响. 华南农业大学学报, 2011, 32(4): 91—95]
[26] Feng J and Jia G. Studies on the fatty liver diseases resulted from different lipid levels in Sciaenops ocellatus diets [J]. Acta Hydrobiologica Sinica, 2005, 29(1): 61—64 [冯健, 贾刚. 饲料中不同脂肪水平诱导红姑鱼脂肪肝病的研究. 水生生物学报, 2005, 29(1): 61—64]
[27] Ozaki H. Blood and Circulatory Physiology of Fish [M]. Shanghai: Shanghai Science and Technology Press. 1982, 105—106 [尾崎久雄. 鱼类血液与循环生理. 上海: 上海科学技术出版社. 1982, 105—106]
[28] Liu Q, Tan Q S, Chen X X, et al. Changes of biochemical characteristics and organization structure in liver of grass carp (Ctenopharyngodon idellus) with hepatobiliary syndrome [J]. Journal of Anhui Agricultural Sciences, 2009, 39(14): 6463—6465, 6467 [刘迁, 谭青松, 陈孝煊, 等. “肝胆综合症”草鱼血液生化特性及组织结构变化. 安徽农业科学, 2009, 39(14): 6463—6465, 6467]
[29] Ge X P, Liu B, Xie J, et al. Effect of different carbohydrate levels of dietary on growth, plasma biochemical indices and hepaticpancreas carbohydrate metabolic enzymes in topmouth culter [J]. Journal of Nanjing Agricultural University, 2007, 30(3): 88—93 [戈贤平, 刘波, 谢骏, 等. 饲料中不同碳水化合物水平对翘嘴红 鲌生长及血液指标和糖代谢酶的影响.南京农业大学学报, 2007, 30(3): 88—93]
[30] Lin X Z, Luo Y P, Xie X J. Effects of dietary carbohydrate level on glycolytic enzymes and serum glucose concentrations in the juvenile southern catfish after feeding [J]. Acta Hydrobiologica Sinica, 2006, 30(3): 304—310 [林小植, 罗毅平, 谢小军. 饲料碳水化合物水平对南方鲇幼鱼餐后糖酵解酶活性及血糖浓度的影响. 水生生物学报, 2006, 30(3): 304—310]
EFFECTS OF NON-PROTEIN ENERGY SOURCES ON SERUM BIOCHEMICAL INDICES AND HISTOLOGY OF LIVER IN GRASS CARP (CTENOPHARYNGODON IDELLA)
GUO Xiao-Ze, LIANG Xu-Fang, FANG Liu, YUAN Xiao-Chen, ZHOU Yi and LI Bin
(Key Lab of Freshwater Animal Breeding, Ministry of Agriculture, College of Fisheries, Huazhong Agricultural University, Wuhan 430070, China)
非蛋白能量源; 血清生化指标; 肝脏组织; 草鱼
Non-protein energy sources; Serum biochemical indices; Histology of liver; Grass carp
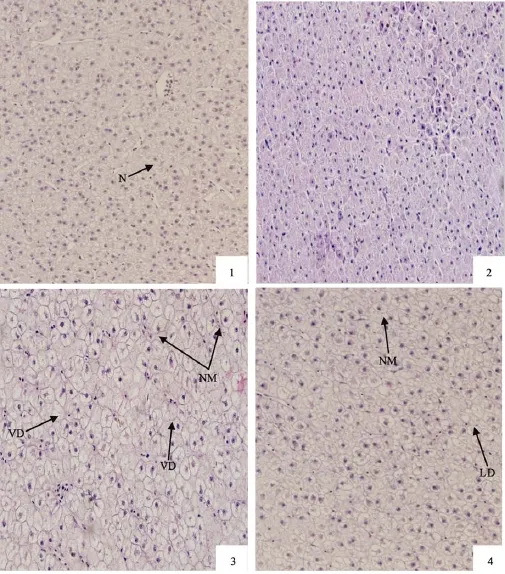
图版Ⅰ PlateⅠ
S965.1
A
1000-3207(2014)03-0582-06
10.7541/2014.82
2013-04-10;
2014-01-20
国家重点基础研究发展计划“973”项目(2009CB118702); 水产养殖动物营养需求与高效配合饲料开发项目(公益性行业(农业)科研专项)(201003020)资助
郭小泽(1982—), 男, 山西芮城人; 博士; 研究方向为鱼类营养代谢调控。E-mail: xiaoze206@126.com
梁旭方(1965—), 男, 教授。E-mail: xfliang@mail.hzau.edu.cn
