不同产地野生猪苓多糖与麦角甾醇的含量分析
2014-03-29李香串梁文仪
李香串,梁文仪
(1.山西省医药与生命科学研究院,山西 太原 030006;2.山西中医学院,山西 太原 030024)
猪苓为多孔菌科真菌猪苓[Polyporusumbellatus(Pers.)Fries]的干燥菌核,主产于陕西、云南、河南、山西等省,其性平,味甘、淡,具有利水渗湿之功效[1],中医临床上主要用于治疗急性肾炎、淋病、糖尿病、全身浮肿、小便不畅、急性胃炎、泄泻、淋浊、带下[2-3]等。已报道的猪苓化学成分主要有多糖类、甾体类、非甾体类(除多糖类外)、氨基酸类、维生素类及微量元素等,其中猪苓多糖具有增强免疫功能、抗肿瘤、保肝、抗老防衰、抗辐射、抗诱变等作用[4-5];麦角甾醇具有一定的利尿作用,生物代谢研究发现麦角甾醇和麦角甾醇的过氧化物可以通过一系列的生物合成途径合成麦角甾酮,麦角甾醇的利尿作用可能是麦角甾醇在体内二氧化酶作用下转化为麦角甾酮[6]。本实验参考文献报道[10-13]采用紫外-可见分光光度法及高效液相色谱法测定不同产地猪苓中猪苓多糖及麦角甾醇的含量,比较不同产地、不同来源猪苓药材的质量差异,为猪苓的优种选育及质量标准研究提供科学依据。
1 仪器与试药
1.1 仪器
UV-1601紫外可见分光光度仪(北京瑞利分析仪器公司);METTLER TOLEDO EL204 型万分之一电子天平;METTLER TOLEDO AB135-S 型十万分之一电子天平(梅特勒-托利多仪器(上海)有限公司);KQ200E 型超声波清洗仪(昆山市超声仪器有限公司);HH-2水浴锅(金坛市杰瑞尔电器有限公司);DL-5C离心机(上海安亭科学仪器厂);HC-500A型粉碎机(浙江省安康市金穗机械制造厂);DIONEX Summit HPLC色谱仪(P680 HPLC Pump,UVD 170U检测器,Chromeleon工作站)等。
1.2 试药
D-无水葡萄糖标准品(购于中国食品药品检定研究院,批号:110833-201205);麦角甾醇标准品(购于中国食品药品检定研究院,批号:111845-201102);无水乙醇、浓硫酸、苯酚、甲醇等均为分析纯;甲醇(OCEANPAK,瑞典)为色谱纯。
猪苓药材部分采集于山西、陕西等地,部分购于太原市内各药店(见表1),经鉴定均为多孔菌科真菌猪苓[Polyporusumbellatus(Pers.)Fries]的干燥菌核或子实体,粉碎过40 目筛,混合均匀后备用。

表1 猪苓样品来源

图1 猪苓样品图
2 方法与结果
2.1 猪苓多糖的含量测定
2.1.1 对照品溶液的制备
取D-无水葡萄糖适量,精密称定,加蒸馏水制成每1 mL含0.055 5 mg的对照品溶液,备用。
2.1.2 供试品溶液的制备
取猪苓粉末约1 g,精密称定,置圆底烧瓶中,加水100 mL,加热回流1 h,滤过,如上重复提取1 次,合并滤液,浓缩至适量,转移至50 mL量瓶中,加水至刻度,摇匀,精密量取25 mL,加无水乙醇100 mL,摇匀,冷藏静置24 h,离心,取沉淀加水溶解,置50 mL量瓶中,并稀释至刻度,摇匀,即得。
2.1.3 标准曲线的制备
精密量取对照品储备液(0.925 0 mg·mL-1)0.2 mL,0.4 mL,0.6 mL,0.8 mL,1.0 mL,1.2 mL,1.4 mL,分别置10 mL量瓶中,加水至刻度,摇匀。精密量取上述各对照品溶液1 mL,分别加5 %苯酚溶液2.5 mL,混匀,加入浓硫酸10 mL,摇匀,放冷后,沸水浴15 min冷却。以试剂为空白,在489 nm波长处采用紫外-可见分光光度法测吸光度值。以吸光度(A)为纵坐标(y),对照品溶液浓度(C)为横坐标(x),得到葡萄糖标准曲线方程为y=5.065 6x+0.047 3,r=0.999 0,结果表明葡萄糖含量在0.018 5 mg·mL-1~0.129 5 mg·mL-1范围内时与吸光度呈良好的线性关系,该标准曲线可用于样品中猪苓多糖的含量计算。标准曲线见图2。

图2 猪苓多糖标准曲线图
2.1.4 精密度试验
精密量取葡萄糖对照品溶液(0.055 5 mg·mL-1)1.0 mL,照“标准曲线的制备”项下操作,显色测定吸光度,重复6 次,以A值计算,RSD值为1.59%,结果符合要求。测定结果见表2。

表2 精密度试验结果
2.1.5 重复性试验
取10 号猪苓样品粉末6 份,精密称定,按“供试品溶液的制备”项下方法制备供试品溶液,按“标准曲线的制备”项下操作,显色测定吸光度,计算猪苓多糖的含量,其RSD为2.54%,表明重复性良好。结果见表3。

表3 重复性试验结果
2.1.6 稳定性试验
取10 号猪苓样品粉末1 份,精密称定,按“供试品溶液的制备”项下方法制备供试品溶液,按“标准曲线的制备”项下操作,显色后,于 0 min,30 min,60 min,90 min,120 min连续测定,以A值计算,RSD值为1.82 %,表明2 h内样品稳定性良好。结果见表4。
表4 稳定性试验结果
2.1.7 加样回收试验
精密称取已知含量的10号样品约0.5 g共6份,每份分别加入葡萄糖标准品3.549 0 mg,按“供试品溶液的制备”项下操作,得各加样回收供试品溶液,按“标准曲线的制备”项下操作,完成显色后测定猪苓多糖含量,计算猪苓多糖回收率为99.50%,RSD为2.23%。测定结果见表5。

表5 加样回收率试验结果
2.1.8 样品的含量测定
取不同产地的样品,按“供试品溶液的制备”项下操作,得供试品溶液,按“标准曲线的制备”项下操作,显色后测定猪苓多糖含量,结果见表6。

表6 不同产地猪苓样品中猪苓多糖含量的测定结果
2.2 麦角甾醇的含量测定
2.2.1 色谱条件
色谱柱为Diamonsil C18(200 mm×4.6 mm,5 μm);流动相为甲醇;检测波长为283 nm;流速1.0 m·min-1;柱温 30 ℃。在此色谱条件下对照品和猪苓样品的HPLC色谱图分别见图3、图4。
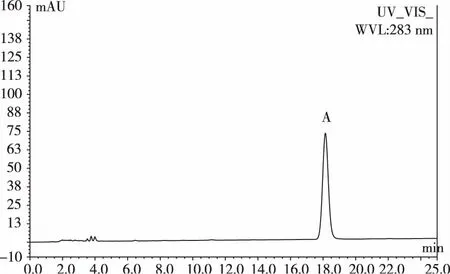
图3 麦角甾醇对照品HPLC色谱图
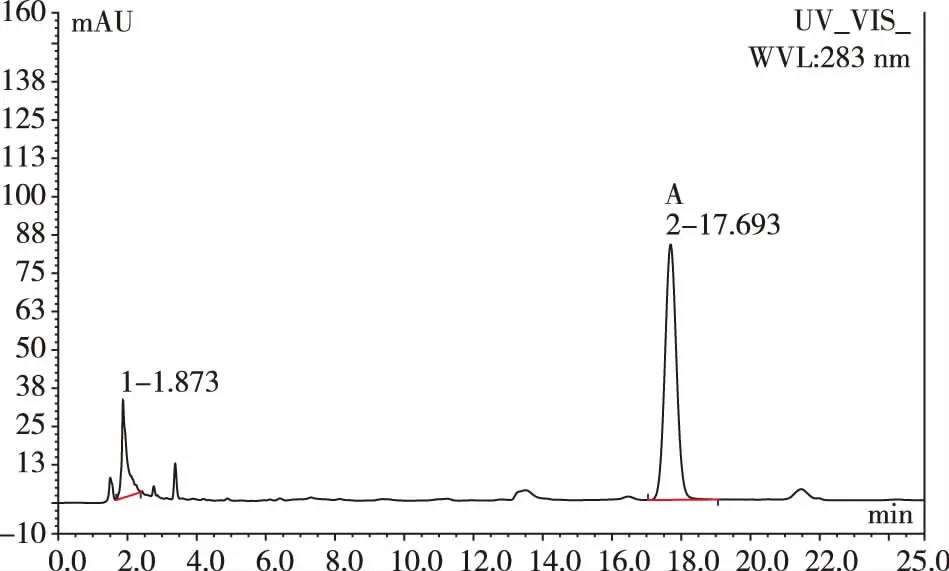
图4 猪苓样品HPLC色谱图
2.2.2 对照品溶液的制备
取麦角甾醇对照品适量,精密称定,加甲醇制成每1 mL含0.135 6 mg的麦角甾醇对照品溶液,备用。
2.2.3 供试品溶液的制备
取猪苓样品粉末约0.5 g,精密称定,置具塞锥形瓶中,精密加甲醇10 mL,称定重量,密塞,超声处理(功率220 W,频率40 kHz)1 h,放至室温,再称定重量,用甲醇补足重量后,摇匀,滤过,取续滤液即得。
2.2.4 标准曲线的制备
精密量取麦角甾醇对照品储备液(0.026 0 mg·mL-1)0.1 mL,0.2 mL,0.4 mL,0.8 mL,1.2 mL,1.6 mL,2.0 mL,分别置2 mL量瓶中,加甲醇定容至刻度,摇匀。精密吸取上述对照品溶液20 μL,按上述色谱条件测定,以进样量(mg)为横坐标(x),峰面积(A)为纵坐标(y),得麦角甾醇线性回归方程为:y=1 5472x+0.710 2,r=0.999 3,结果表明麦角甾醇进样量在0.000 226 0 mg~0.004 520 mg范围内与峰面积具有良好的线性关系,该标准曲线可用于样品中麦角甾醇的含量计算。标准曲线图见图5。

图5 麦角甾醇标准曲线图
2.2.5 精密度试验
精密吸取质量浓度为0.135 6 mg·mL-1麦角甾醇对照品溶液20 μL,在上述色谱条件下,重复进样6次,测得麦角甾醇色谱峰面积的RSD为1.41%,结果符合要求。测定结果见表7。

表7 精密度试验结果
2.2.6 重复性试验
精密称定9号猪苓样品粉末约0.5 g,按“供试品溶液的制备”项下操作,平行制备6 份,得供试品溶液,在上述色谱条件下测定峰面积,计算样品含量。测得麦角甾醇色谱峰面积的RSD为1.63%,说明该方法的有良好的重复性。测定结果见表8。

表8 重复性试验结果
2.2.7 稳定性试验
精密称定9 号猪苓样品粉末约0.5 g,按“供试品溶液的制备”项下操作,得供试品溶液,在上述色谱条件下,分别于0 h、2 h、4 h、8 h、12 h进样,测得麦角甾醇含量的RSD为1.90 %,表明样品溶液在12 h内稳定。测定结果见表9。

表9 稳定性试验结果
2.2.8 加样回收试验
精密称取已知含量的9 号样品约0.25 g共6 份,1~3号加入麦角甾醇标准品各0.376 1 mg,4~6号加入麦角甾醇标准品各0.406 8 mg,按“供试品溶液的制备”项下操作,在上述色谱条件下测定峰面积,计算麦角甾醇平均回收率为97.01 %,,RSD为2.30 %。测定结果见表10。

表10 加样回收率试验结果
2.2.9 样品的含量测定
取不同产地的样品,按“供试品溶液的制备”项下操作,得供试品溶液,在上述色谱条件下测定峰面积,根据峰面积值以外标一点法计算猪苓药材中麦角甾醇的含量,结果见表11。

表11 猪苓样品中麦角甾醇含量测定结果
3 讨 论
3.1 猪苓多糖含量测定的结果表明:不同产地和来源的样品中猪苓多糖含量存在一定差异。同一产地野生猪苓子实体中多糖的含量远高于野生菌核中的含量,其中山西盂县产猪苓子实体多糖含量最高,为60.694 6 mg·g-1,是菌核含量(2.151 7 mg·g-1)的28.2 倍,山西沁源产猪苓子实体多糖含量次高,为18.160 0 mg·g-1,是菌核含量(8.520 4 mg·g-1)的2.13倍,山西盂县子实体猪苓多糖的含量为山西沁源的3.3 倍;菌核中猪苓多糖的含量范围为2.151 7 mg·g-1~8.887 2 mg·g-1,以陕西留坝最高,山西沁源次之,山西盂县最低。以猪苓多糖为选种质量指标,分离菌种首选山西盂县猪苓花。
3.2 10个来源的猪苓样品中麦角甾醇的含量之间存在一定的差异,且子实体中的含量远高于菌核中的含量,根据《中国药典》2010版的规定,按干燥品计算麦角甾醇含量不得少于0.070%[2],上述所有样品均符合规定;其中山西沁源产猪苓子实体麦角甾醇含量最高,为4.187 0 mg·g-1,是菌核含量(2.023 2 mg·g-1)的2.1 倍;山西盂县产猪苓子实体麦角甾醇含量次高,为3.551 1 mg·g-1,是菌核含量(0.825 9 mg·g-1)的4.3倍;菌核中麦角甾醇的含量范围为0.825 9 mg·g-1~2.023 2 mg·g-1,山西沁源样品最高,山西盂县样品最低。本研究范围内山西沁源产猪苓药材品质较好;以麦角甾醇为选种质量指标,分离菌种以山西沁源的猪苓花和菌核为最好。
3.3 同一产地猪苓子实体中多糖和麦角甾醇的含量远高于菌核中的含量,而菌核是法定的药用部位,鉴于猪苓野生资源匮乏,进一步研究子实体的药用价值,为扩大猪苓有效利用部位和来源提供科学依据。
3.4 猪苓多糖作为猪苓的有效成分之一,具有调节机体免疫功能,对慢性肝炎、肿瘤病有一定疗效,《中国药典》2010版却未规定猪苓多糖的含量限度,因此,仅采用麦角甾醇评价猪苓是不全面和不系统的。为了更全面地衡量药材质量,可进一步研究猪苓多糖与麦角甾醇在猪苓利水渗湿功效上的相互作用,从而揭示这两种有效成分之间的关系。
3.5 根据实验结果得不同来源猪苓中多糖与麦角甾醇的含量之间没有必然的关系,因此对于多糖含量高而麦角甾醇含量很低的猪苓药材(如3号产地猪苓药材)可作为提取猪苓多糖的原料使用, 由此可使猪苓资源合理应用。
参考文献:
[1] 康廷国.中药鉴定学[M].2版.北京:中国中医药出版社,2007:436-436.
[2] 国家药典委员会.中国药典:一部[S].北京:中国医药科技出版社,2010:299.
[3] 李萍,梁宗锁,陈德育,等.猪苓菌丝菌核的显微结构及其多糖含量研究[J].西北农林科技大学学报:自然科学版,2007(6):218-222.
[4] 赵英永,崔秀明,张文斌,等.猪苓的化学成分与药理作用研究进展[J].中药材,2009,11:1785-1787.
[5] 崔大鹏,和瑞欣.猪苓化学成分及药理作用浅述[J].河南中医,2011,31(2):185-186.
[6] 赵英永.中药猪苓的化学成分及其药理学研究[D].西北大学,2010.
[7] 戚淑威,赵琪,程远辉,等.猪苓的研究进展[J].云南农业科技,2011(5):7-9.
[8] Normile D.Asian medicine:The new face of traditional Chinese medicine[J].Science,2003;299:188-190.
[9] Jiang W Y.Therapeutic wisdom in traditional Chinese medicine:a perspective from modern science[J].Trends Pharmacological Science 2005,26:558-563.
[10] 苏玉顺,李艳君,赵方振,等.紫外-可见分光光度法在植物多糖含量测定中的应用[J].光谱实验室,2011(3):1101-1107.
[11] 乔丽华,贾小燕,刘萍,等.猪苓复合多糖含量测定的条件实验[J].中国卫生检验杂志,2010(4):726-728.
[12] 田广文,陈德育,李学俊,等.猪苓多糖苯酚-硫酸法测定条件的优选[J].中国农学通报,2007(7):75-78.
[13] 罗毅,潘细贵,刘刚,等.苯酚-硫酸法测定多糖含量显色方式的优选[J].中国中医药信息杂志,2005(1):45-46.
