地特胰岛素对2型糖尿病患者体质量影响的临床观察
2014-03-28赵晓宏
赵晓宏,陈 灿
(西安交通大学附属三二○一医院内分泌科,陕西 汉中 723000)
胰岛素作为糖尿病治疗的重要药物之一,其增加体质量的负作用在一定程度上影响其临床应用。由于体质量增加对远期糖尿病患者的心血管事件发生风险及心血管事件死亡风险都呈正相关,目前越来越多的研究者开始关注糖尿病治疗所引发的患者体质量增加。使用能够减重或者对于体质量影响为中性的药物则是未来糖尿病治疗的趋势和方向[1]。近年来,地特胰岛素独特的减少体质量增加的作用引起人们的兴趣,但国内相关的报道较少,本研究对口服磺脲类失效的2型糖尿病患者起始地特胰岛素治疗,对比分析治疗前后患者空腹血糖(fasting plasma glucose,FPG)、糖化血红蛋白(glycated haemoglobin,HbA1c)和体质量指数(body mass index,BMI)的变化,并采用BMI评估地特胰岛素对患者体质量的影响。
1 资料与方法
1.1一般资料 选择2011年1月至2012年12月在西安交通大学附属3201医院内分泌科门诊就诊的口服磺脲类治疗效果不佳而未曾接受胰岛素治疗的2型糖尿病患者72例(排除眼肾心及神经系统有严重并发症者),坚持完成试验的66例患者纳入本研究。以BMI作为患者体质量的评估标准将患者分为3组:BMI<24 kg/m2者20例(A组),其中男13例,女7例,年龄37~55(46.3±8.4)岁;24 kg/m2≤BMI<28 kg/m2者22例(B组),其中男14例,女8例,年龄34~54(44.2±9.6)岁; BMI≥28 kg/m2者24例(C组),其中男16例,女性8例,年龄36~54(44.9±8.8)岁。三组患者在年龄、性别等方面差异无统计学意义(P>0.05),具有可比性。
1.2研究方法 为避免口服降糖药物对体质量判断的影响,入选患者均停用以往所有口服降糖药物1周,治疗前为所有患者进行正规糖尿病饮食和运动治疗指导以及自我血糖监测的培训,并签署治疗知情同意书。所有患者治疗前均进行FPG及HbA1c检测,并测量身高、体质量,计算BMI。地特胰岛素(诺和诺德公司生产)起始剂量为0.2 U/(kg·d),于每晚睡前(22:00左右)皮下注射。治疗过程中记录每日的胰岛素用量,每3日测1次FPG,并据血糖逐渐调整地特胰岛素的剂量,直至FPG达标(FPG<7 mmol/L)。治疗结束(6个月)后复查FPG及HbA1c,测量身高、体质量,再次计算BMI,对比分析治疗前后患者的血糖水平以及体质量变化。
2 结 果
2.1三组患者治疗前后FPG、HbA1c、BMI的比较 FPG水平治疗前后比较,三组均较治疗前显著降低(P<0.05),治疗前三组间FPG比较差异无统计学意义(P>0.05),治疗后三组间FPG比较差异有统计学意义(P<0.05),且C组FPG水平低于A组(q=46.85,P<0.05)。HbA1c值治疗前后比较,三组均低较治疗前显著降低(P<0.05),治疗前和治疗后三组间比较差异均无统计学意义(P>0.05)。BMI治疗前后比较,C组较治疗前显著降低(P<0.05);治疗前,三组间比较差异有统计学意义(P<0.05),且A组显著低于B组和C组(q=78.55,P=0.01;q=267.43,P=0.00),B组显著低于C组(q=74.72,P=0.01);治疗后,三组间比较差异有统计学意义(P<0.05),且A组显著低于B组和C组(q=76.20,P=0.01;q=198.65,P=0.00),B组显著低于C组(q=46.92,P=0.04)(表1)。
A组:BMI<24 kg/m2者;B组:24 kg/m2≤BMI<28 kg/m2者;C组:BMI≥28 kg/m2者FPG:空腹血糖;HbA1c:糖化血红蛋白;BMI:体质量指数
2.2三组患者地特胰岛素用量比较 A组地特胰岛素用量为(13.45±1.47) U,B组为(14.73±1.42) U,C组为(18.88±2.66) U,三组间比较差异有统计学意义(F=78.10,P=0.02),组间两两比较结果显示:A组与B组比较差异无统计学意义(q=5.36,P=0.68),C组胰岛素用量显著高于A组(q=214.84,P=0.00)、B组(q=92.16,P=0.00)(图1)。
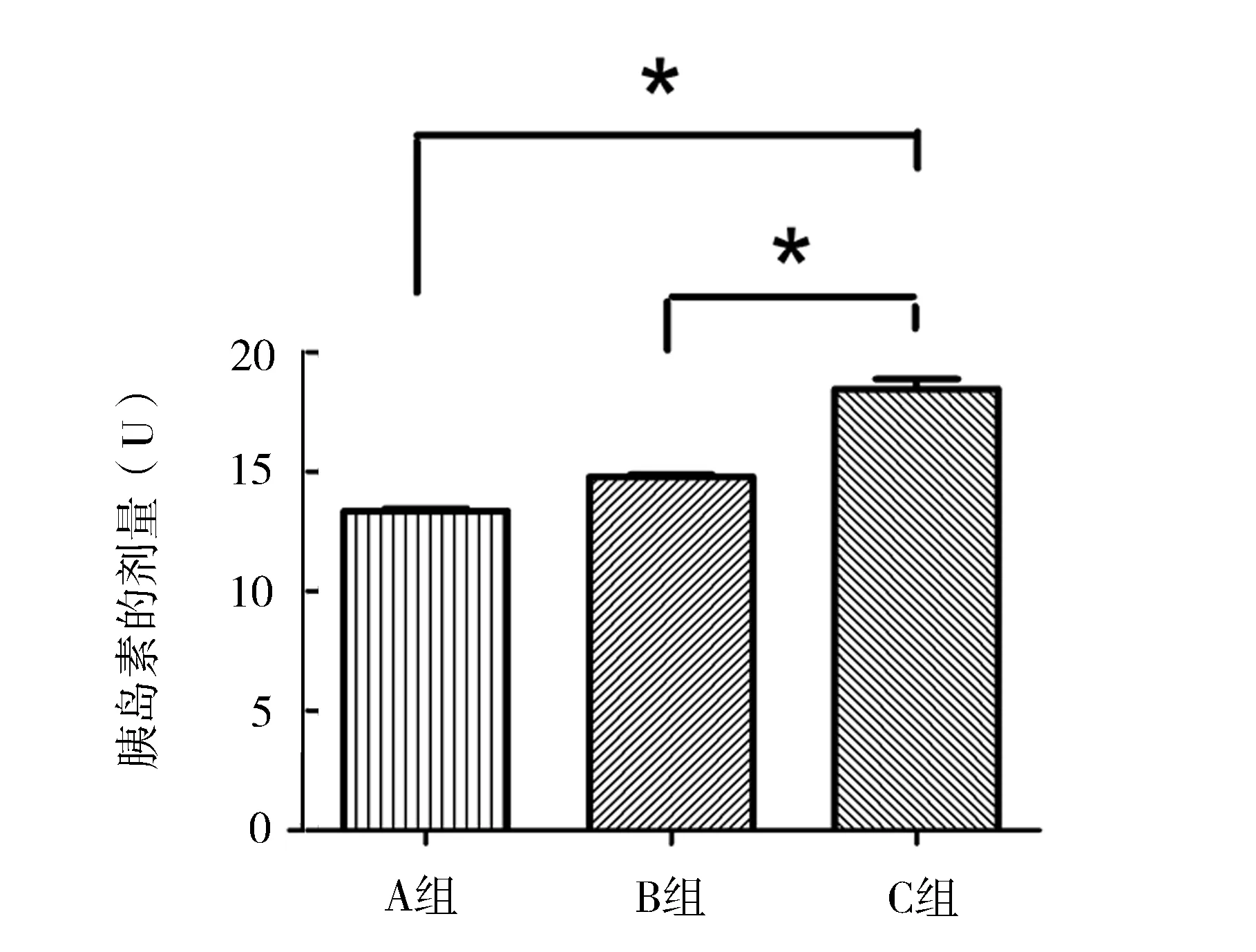
※与C组比较,P<0.05;A组:BMI<24 kg/m2者;B组:24 kg/m2≤BMI<28 kg/m2者;C组:BMI≥28 kg/m2者
2.3不良反应情况 66例患者治疗过程中仅C组有1例发生一次可感知低血糖,主要症状为心慌、出汗,当时血糖为3.2 mmol/L,进食后症状很快缓解。其余均未报告出现不良反应。
3 讨 论
体质量增加(超重和肥胖)为2型糖尿病重要的发病原因之一,因此在很好地控制血糖的同时,应尽量减少甚至避免体质量的增加。然而,不同的药物在降糖的同时,都不可避免的带来一些不良反应。外源性胰岛素是有效的降糖治疗方式,其主要的不良反应是低血糖和体质量增加。注射外源性胰岛素后,能促进全身组织细胞对葡萄糖的摄取和利用,并抑制糖原的分解和糖原异生,因此,胰岛素具有良好的降低血糖的作用,同时促进脂肪细胞内中性脂肪合成并抑制其分解,在脂肪组织中引起脂肪沉积,从而导致肥胖。其次,糖尿病患者在接受外源性胰岛素剂量偏大时,易产生低血糖的饥饿感,从而导致食欲和摄入量增加而产生肥胖。UKPDS研究[2]、DCCT研究[3]以及Nichols等[4]研究均显示,胰岛素治疗可引起患者不同程度的体质量增加,因此,与胰岛素治疗相关的体质量增加成为糖尿病患者接受胰岛素治疗时的主要顾虑。
地特胰岛素是一种新型的长效胰岛素类似物,其在良好控制血糖的同时,并不引起显著的体质量增加。这方面的研究国外相对较早,报道较多。Philis-Tsimikas等[5]研究、PREDICTIVETM研究[6]以及Rosenstock等[7]研究均表明,睡前一次地特胰岛素与甘精胰岛素达到的血糖控制相似,但地特胰岛素显著减少了患者的体质量增加,且基线BMI越高,体质量降低越显著。
本研究结果显示,各组治疗后FPG、HbA1c均较前显著降低,而BMI增加在A组并不显著,B组BMI略有降低,但无显著性差异,而C组降低相对较为显著。A、B、C三组治疗结束时组间FPG、HbA1c比较无显著性差异,但地特胰岛素用量差异较为显著,C组剂量显著高于A、B两组。表明地特胰岛素可有效控制不同BMI患者的血糖,低血糖发生少。在达到相似疗效的情况下肥胖患者的胰岛素用量仍然高于体质量正常和超重患者,这与其他基础胰岛素相似,
但对体质量的影响地特胰岛素显著优于其他基础胰岛素。而且本研究结果提示了一种趋势,即随着BMI增加,地特胰岛素可有效降低与胰岛素治疗相关的体质量增加,尤其是肥胖患者的体质量甚至有一定程度的降低,这与国外研究结果[5-7]相似。
至于地特胰岛素可降低与胰岛素治疗相关体质量增加的确切机制目前仍不十分清楚。可能的机制为[8]:①由于地特胰岛素本身的结构特点和理化特性使得它进入人体后以缓慢、稳定的速率被吸收,有效地减少了血糖波动和个体变异性,能够带来持久、稳定的基础血糖控制,降低了低血糖发生率,从而减少针对低血糖的防御性食物摄入,减少体质量增加。②皮下注射地特胰岛素后,在外周体循环中,98%以上地特胰岛素与血浆白蛋白动态结合,这种结合使地特胰岛素不能透过毛细血管壁进入周围组织,但可以通过肝窦进入肝细胞,这样大部分胰岛素首先在肝脏发挥作用,抑制肝脏内源性葡萄糖产生。地特胰岛素这种肝脏和外周组织的分布,更接近生理性胰岛素分泌。而越能模拟生理状态下胰岛素特征的胰岛素制剂,则越少引起体质量增加[9]。因此,地特胰岛素可减轻外周组织的过度胰岛素化,减少了外周脂肪的合成。③近年来一些研究表明,在脑组织中,胰岛素通过胰岛素受体和胰岛素受体底物的信号转导通路对能量代谢和食欲的调节起重要作用。地特胰岛素的脂肪酸侧链能使其更容易通过血脑屏障,增加它在大脑中的浓度,克服中枢神经系统中的胰岛素抵抗,充分发挥胰岛素在中枢的调节作用,从而起到抑制食欲、减少摄食、降低体质量的作用[10-11]。
总之,地特胰岛素与其他基础胰岛素一样,能有效控制不同BMI患者的血糖,而低血糖发生率相对较低,尤其是可降低与胰岛素治疗相关的体质量增加的独特作用在很大程度上减少了患者对胰岛素使用的顾虑,为体质量超标的糖尿病患者带来了福音,尤其是肥胖患者可能从中获益更多。
[1] 母义明.地特胰岛素在糖尿病治疗中的应用与体重控制[J].中国糖尿病杂志,2012,20(5):397-399.
[2] No authors listed.Intensive blood-glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes(UKPDS 33)[J].Lancet,1998,352(9193):837-853.
[3] The diabetes control and complications Research Group.Adverse events and their association with treatment regimens inthe diabetes control and complications trial[J].Diabetes Care,1995,18(11):1415-1427.
[4] Nichols GA,Gomez-Caminero A.Weight changes following the intiation of new anti-hyperglycaemic therapy[J].Diabetes Obes Metab,2007,9(1):96-102.
[5] Philis-Tsimikas A,Charpentier G,Clauson P,etal.Comparison of once-daily insulin detemir with nph insulin added to a regimen of oral antidiabetic drugs in poorly controlled type 2 diabetes[J].Clin Ther,2006,28(10):1569-1581.
[6] Dornhorst A,Lüddeke HJ,Koenen C,etal.Transferring to insulin detemir from NPH insulin or insulin glargine in type 2 diabetes patients on basal-only therapy with oral antidiabetic drugs improves glycaemic control and reduces weight gain and risk of hypoglycaemia:14-week follow-up data from PREDICTIVETM[J].Diabetes Obes Metab,2008,10(1):75-81.
[7] Rosenstock J,Davies M,Home PD,etal.A randomised,52-week,treat-to-target trial comparing insulin detemir with insulin glargine when administered as add-on to glucose-lowering drugs in insulin-naive people with type 2 diabetes[J].Diabetologia,2008,51(3):408-416.
[8] 沈洁.地特胰岛素减少体重增加的可能机制与临床应用[J].中国糖尿病杂志,2010,18(3):238-240.
[9] Pumell JQ,weyef C.wejght effect of current and experimental drugs for diabetes mellitus;from promotion to alleviation ofobesity[J].Treat Endocnol,2003,2(1):33-47.
[10] Hennige AM,Sartorius T,Tschritter O,etal.Tissue selectivity of insulin detemir action in vivo[J].Diabetologia,2006,49(6):1274-1282.
[11] Tschritter O,Hennige AM,Preissl H,etal.Cerebrocortical beta activity in overweight humans responds to insulin detemir[J].PLoS One,2007,2(11):e1196.
