微RNAs在骨髓间充质干细胞向三胚层方向分化中的调控作用
2014-03-28岑晓霞综述冀凯宏审校
岑晓霞,熊 俊(综述),冀凯宏※(审校)
(第二军医大学 1学员旅学员七队, 2基础部组织胚胎学教研室,上海 200433)
骨髓间充质干细胞(bone mesenchymal stem cells,BMSCs)是近年来发现的一类存在于骨髓的具有自我更新和多向分化潜能的成体干细胞。体外分离培养后在不同的诱导条件下,BMSCs具有向成骨细胞、软骨细胞、脂肪细胞、骨骼肌细胞、神经细胞和肝细胞等多种细胞分化的能力[1]。微RNA(microRNAs miRNA)是一类内源性的非编码RNA,能够通过与靶信使RNA(mRNA)特异性结合而导致靶mRNA降解或抑制其翻译,从而对基因进行转录后调控。采用cDNA克隆结合生物信息学分析是寻找miRNAs基因的经典方法,更加深入彻底地了解miRNAs对BMSCs的三胚层诱导分化作用,对揭示成体干细胞的谱系分化调节机制及其在临床治疗上的应用具有重要意义。
1 miRNAs的作用和生成过程
miRNAs是一类长度为19~25个核苷酸的非编码小分子RNA,通过与靶mRNA特异性结合在转录后水平调控基因表达。最早的两个miRNAs(lin-4和let-7)是在研究C.elegans的发育调控时发现的。miRNAs基因在动物基因组中约占1%,却可能参与调控至少30%的相关基因的表达,可见miRNAs在生物体生长发育过程中的重要性[2]。miRNAs在真核生物细胞的基因表达、细胞周期调控和个体发育等多种行为上起重要调控作用,并且与干细胞的多潜能性维持和多向分化能力方面存在着紧密关联。
miRNAs首先在细胞核内转录成前体转录本(primary transcript miRNAs,pri-miRNAs),在细胞核内Drosha酶的作用下剪切形成60~70个核苷酸的具有发夹结构的miRNAs前体(pre-miRNAs),然后由转运蛋白运输到细胞质中。随后,另一个核酸酶Dicer在细胞质中将其剪切产生约为22个核苷酸长度的miRNA:miRNA*双链。这种双链很快被引导进入RNA诱导沉默复合体中,其中一条单链miRNAs被降解,另一条即为成熟的单链miRNAs分子,它通过与靶基因的3′UTR(非编码区)区互补配对,对靶基因miRNAs进行切割或者翻译抑制(图1)[3]。
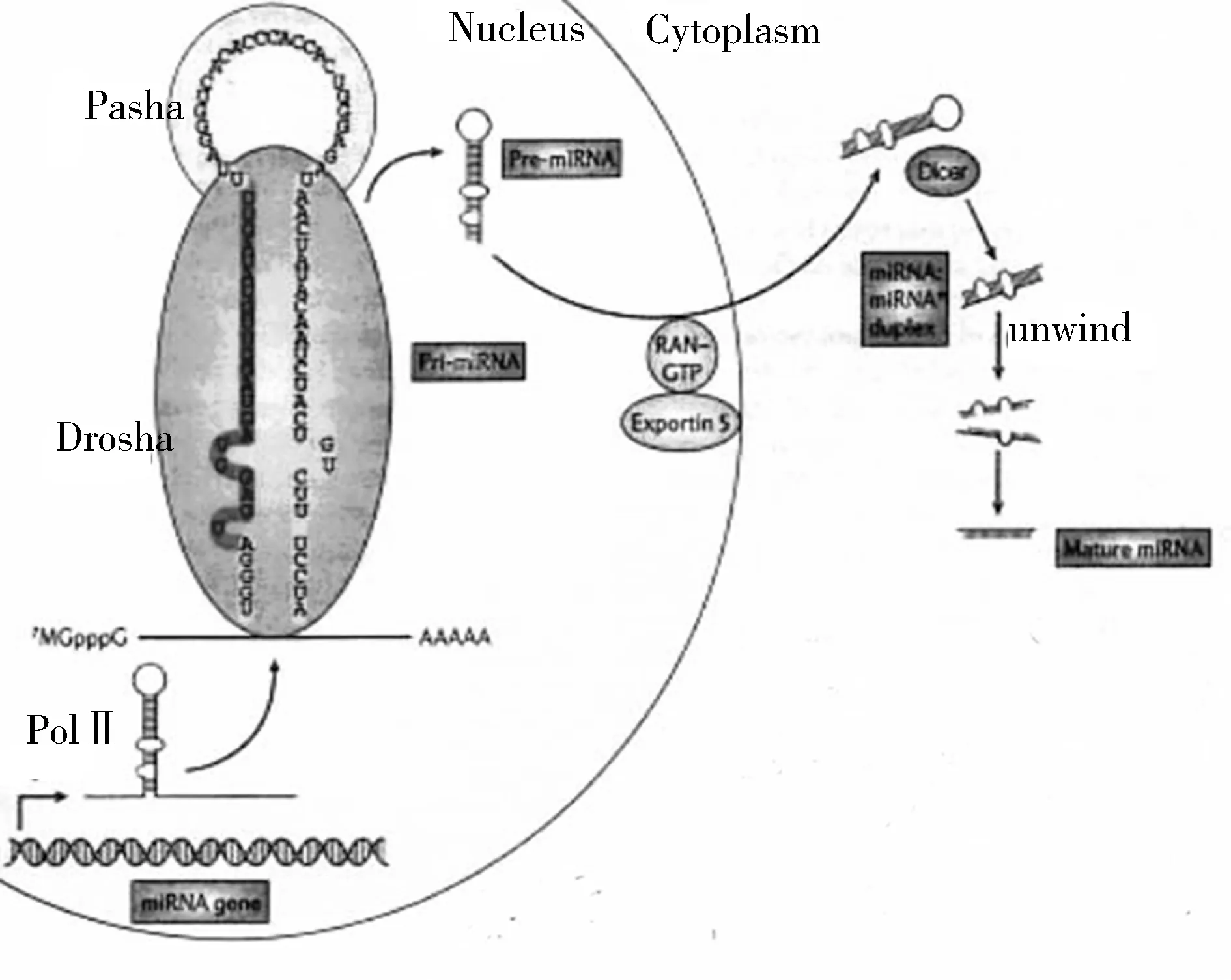
图1 miRNAs合成示意图
PolⅡ:RNA聚合酶;Drosha:核糖核酸酶Drosha;Pasha:核糖核酸酶Drosha的辅助因子;Pri-miRNA:初级转录本;Pre-miRNA:miRNA前体;Dicer:核糖核酸酶Dicer;Exportin 5/RNA-GTP:核输出蛋白;Nucleus:细胞核;Cytoplasm:细胞质;unwind:解旋;miRNA/miRNA duplex:双链miRNA;Mature miRNA:成熟miRNA
2 miRNAs的特点
miRNAs作为细胞内具有转录后调控作用的非编码RNA,具有以下特点。①细胞特异性:不同组织、不同细胞的miRNAs的表达谱及序列特征不同,该特点可以作为某些组织或细胞的特异性分子标志;②“时空”特异性:细胞在不同发育阶段miRNAs组成不同,在特定细胞的特定阶段“出现”特定的miRNAs,决定细胞的分化方向和分化时相,是细胞定时、定向分化的开关;③保守性:不同种属、不同组织器官以及不同细胞之间相同或相似的miRNAs分子具有相似的调控功能;④miRNAs作用靶点:多为呈“时空” 特异性表达的转录调控基因以及凋亡调控基因,通过调控细胞增殖和细胞凋亡,从而调控细胞功能和结构的特殊化[4-6]。正因为miRNAs具有上述特点,决定了其在干细胞的维持和分化过程中将扮演重要作用。
3 miRNAs在BMSCs三胚层分化中的作用
3.1miRNAs诱导BMSCs分化为成骨细胞 研究人员利用基因芯片检测miRNAs的表达情况,并通过芯片显著性分析方法,比对出BMSCs较其诱导分化后的靶细胞,有8个miRNAs(miR-424,34a,593,10a,148a,602,709,665)过表达,其中miR-424在BMSCs自我更新和三胚层分化中起重要的维持和调控作用[7]。另有研究表明,将miR-30a-5p经体外转染入间充质干细胞(mesenchemal stem cells,MSCs),并诱导MSCs成骨定向分化,发现它能在MSCs定向成骨分化的过程中起到促进增强作用[8]。在BMSCs向成骨分化过程中,miR-26a的表达上升约25倍,实验显示miR-26a mimics(模拟生物体内源的miRNAs)的转染可以促进BMSCs的成骨分化潜能。在骨质疏松环境中,miR-26a表达下降,间接证实了miR-26a对小鼠BMSCs成骨潜能的促进作用[9]。miR-34家族的两个成员miR-34b和miR-34c,不但可以通过阻碍细胞周期蛋白D1、细胞周期蛋白依赖性激酶激活性激酶4和细胞周期蛋白依赖性激酶激活性激酶6的蛋白积累从而抑制成骨细胞的增殖,而且还能够通过降低特异AT序列结合蛋白2的蛋白表达抑制成骨细胞的最终分化成熟[10]。miR-125b可抑制ST2间充质干细胞的增殖,并进一步抑制其向成骨细胞分化[11]。
3.2miRNAs诱导BMSCs分化为肝细胞 科学家们寻找到了影响BMSCs分化为肝细胞的miRNAs。对人BMSCs和向肝细胞特异性分化的huc-BMSCs的全部RNA在不同时段进行搜集数据分析,发现有25种miRNAs过表达;有36种miRNAs低表达。这些miRNAs表达的变化也在大量反转录聚合酶链反应中被证实。这些实验结果说明miRNAs对BMSCs分化为肝细胞发挥一定的调控作用[12]。
研究显示,miRNAs通过抑制或促进某些生物因子的表达而对肝细胞增殖发挥调控作用。研究人员通过对小鼠进行2/3肝切除术后,检测miRNAs的表达发现,在细胞周期G1~S的时相转变过程中,这些小鼠肝细胞中的miRNAs呈现缺失或延搁。其中,miR-21的产生和miR-378的抑制最为显著[13]。let-7家族成员可能通过抑制肝细胞核因子4A的表达,在干细胞自我维护与更新中充当信号分子[14]。研究人员通过对比受损肝组织与正常肝组织发现,miR-23a、miR-27a和miR-27b的表达在受损肝组织中显著降低。基质细胞衍生因子1/趋化因子受体4对诱导干细胞迁移、参与受损肝组织再生中起到决定性作用,通过荧光素酶含量测定及蛋白印迹进一步分析发现,miR-27b可以通过抑制基质细胞衍生因子1/趋化因子受体4的表达来阻止干细胞的定向迁移[15]。
3.3miRNAs诱导BMSCs分化为神经细胞 研究人员发现,miR-124在大脑发育过程中的表达呈上升状态。miR-124在中枢神经系统发育过程中通过抑制C末端小结构域磷酸酶1的表达使BMSCs分化为神经细胞[16]。另一种控制神经干细胞分化的miRNAs是miR-137,miR-137的过表达抑制了细胞增殖而促进了NSCs的分化。miR-137通过抑制麦角酰二乙胺1调节神经干细胞的分化。另外,miR-137还通过抑制树突形成来调控神经元的成熟[17]。miR-128也是一种大量存在于脑组织中的神经细胞所特有的miRNAs,在大脑发育过程中表达升高,促进神经干细胞的分化[18]。构建小鼠miRNAs-9-1慢病毒载体(miRNAs-9-1-LV)并感染小鼠BMSCs,感染miRNAs-9-1-LV后的BMSCs经β-巯基乙醇诱导向神经细胞分化比率增加[19]。有趣的是,BMSCs还可以将miR-133b转运至神经细胞来调控神经突起的生长。研究发现,对小鼠大脑中动脉栓塞的MSCs疗法使miR-133b在大脑同侧半球中的水平显著升高[20]。在体外,当MSCs暴露于大脑中动脉栓塞的小鼠大脑同侧局部缺血组织后,MSCs内外的miR-133b水平提高。同样,在接受MSCs浓缩成分治疗的体外原代培养的神经元细胞和星形细胞中miR-133b的水平升高。对从成体小鼠细胞中分离出的NSPCs(neural stem/progenitor cells)进行原代培养,发现miR-106b-25基因簇(miR-106b,miR-93和miR-25)的重要性。研究发现,剔除 miR-25可降低NSPCs的增殖,然而miR-25 的异常表达却促进了NSPCs的增殖。在NSPCs中完整表达miR-106b-25基因簇也能提高神经干细胞产生新神经细胞的能力[21]。
4 结语和展望
目前,科学家们正在不断探索如何将BMSCs准确高效地诱导成需要的组织细胞,miRNAs在BMSCs向三胚层分化的研究成果无疑对该课题具有重要的指导作用。同时,研究人员也已开始关注如何将其成果更好的运用到临床。如丁金勇等[22]所做的BMSCs分化为成骨细胞优化生物活性玻璃的实验研究发现,具有适宜孔隙率的生物活性玻璃复合材料有望成为培养人工骨的种子支架,为骨组织工程的临床应用奠定了实验基础。有理由相信,miRNAs在BMSCs向三胚层分化的作用机制将会更加清晰,利用miRNAs准确诱导,并控制BMSCs分化为各种组织细胞将为人类健康带来更大福祉。
[1] Pittenger MF,Mackay AM,Beck SC,etal.Multilineage potential of adult human mesenchymal stem cells[J].Science,1999,284(5411):143-147.
[2] Schmittgen TD.Regulation of microRNAs processing in development,differentiation and cancer[J].J Cell Mol Med,2008,12(58):1811-1819.
[3] Bartel DP.MicroRNAs:genomics,biogenesis,mechanism,and function[J].Cell,2004,116(36):281-297.
[4] Lagos-Quintana M,Rauhut R,Meyer J,etal.New microRNAs from mouse and human[J].RNA,2003,9(2):175-179.
[5] Rhoades MW,Reinhart BJ,Llim LP,etal.Prediction of plant microRNA targets[J].Cell,2002,110(4):513-520.
[6] Lewis BP,Shih IH,Jones-Rhoades MW,etal.Prediction of mammalian microRNA targets[J].Cell,2003,115(7):787-798.
[7] 高洁,韩建伟,朱洪繁,等.miR-424在人骨髓间充质干细胞分化过程中的表达[J].中华创伤杂志,2010,26(8):752-756.
[8] 王海鹏,高杰,张小平,等.miR-30a-5p在人骨髓间充质干细胞向成骨细胞分化过程中的生物学功能及验证[J].中国医药导报,2011,8(16):23-26.
[9] 范龙坤,华泽权,金岩,等.miR-26a对小鼠骨髓间充质干细胞成骨分化能力的调控作用[J].中国医科大学学报,2012,41(7):591-595,606.
[10] Wei J,Shi Y,Zheng L,etal.Karsenty,miR-34s inhibit osteoblast proliferation and differentiation in the mouse by targeting SATB2[J].J Cell Biol,2012,197(4):509-521.
[11] Mizuno Y,Yagi K,Tokuzawa Y,etal.miR-125b inhibits osteoblastic differentiation by down-regulation of cell proliferation[J].Biochem Biophys Res Commun,2008,368(2):267-272.
[12] Cui L,Zhou X,Li J,Wang L,etal.Dynamic microRNA profiles of hepatic differentiated human umbilical cord lining-derived mesenchymal stem cells[J].PLoS One,2012,7(9):e44737.
[13] Song G,Sharma AD,Roll GR,etal.MicroRNAs control hepatocyte proliferation during liver regeneration[J].Hepatology,2010,51(5):1735-1743.
[14] Koh W,Sheng CT,Tan B,etal.Analysis of deep sequencing microRNA expression profile from human embryonic stem cells derived mesenchymal stem cells reveals possible role of let-7 microRNA family in downstream targeting of hepatic nuclear factor 4 alpha[J].BMC Genomics,2010,11(Suppl 1):S6.
[15] Lü MH,Li CZ,Hu CJ,etal.microRNA-27b suppresses mouse MSC migration to the liver by targeting SDF-1αin vitro[J].Biochem Biophys Res Commun,2012,421(2):389-395.
[16] Visvanathan J,Lee S,Lee B,etal.The microRNA miR-124 antagonizes the anti-neural REST/SCP1 pathway during embryonic CNS development[J].Genes Dev,2007,21(7):744-749.
[17] Smrt RD,Szulwach KE,Pfeiffer RL,etal.MicroRNA miR-137 regulates neuronal maturation by targeting ubiquitin ligase mind bomb-1[J].Stem Cells,2010,28(6):1060-1070.
[18] Bruno IG,Karam R,Huang L,etal.Identification of a microRNA that activates gene expression by repressing nonsense-mediated RNA decay[J].Mol Cell,2011,42(4):500-510.
[19] 景黎君,贾永林,鲁晶晶,等.MicroRNA-9-1慢病毒载体的构建及其对小鼠骨髓间质干细胞诱导分化为神经细胞的影响[J].中国病理生理杂志,2011,27(2):326-331.
[20] Xin H,Li Y,Buller B,etal.Exosome-mediated transfer of miR-133b from multipotent mesenchymal stromal cells to neural cells contributes to neurite outgrowth[J].Stem Cells,2012,30(7):1556-1564.
[21] Brett JO,Renault VM,Rafalski VA,etal.The mirnas cluster miR-106b~25 regulates adult neural stem/progenitor cell proliferation and neuronal differentiation[J].Aging (Albany NY),2011,3(2):108-124.
[22] 丁金勇,靳安民,张梅霞,等.骨髓间充质干细胞分化为成骨细胞优化生物活性玻璃的实验研究[J].中国医师杂志,2006,8(4):444-447.
