高效液相色谱检测血浆伏立康唑浓度研究
2014-03-28雷玲
雷 玲
(海军总医院药剂科,北京 100048)
伏立康唑作为一种新型高效广谱抗菌药物,在临床抗真菌治疗方面发挥着重要作用。伏立康唑于2002年经美国食品药品管理局批准上市[1],其抗菌机制主要是抑制麦角甾醇生成,引起真菌细胞膜的完整性遭到破环,导致真菌细胞死亡[2-3]。伏立康唑还具有间接的免疫调节功能[4]。该药抗菌谱主要包括急性侵袭性曲霉菌、侵袭性念珠菌属、足放线病菌属和镰刀菌属等[5-6]。值得注意的是,该药的个体代谢差异较大[7-9],因此在临床上应对伏立康唑的血浆药物浓度进行检测,实现个体化治疗具有重要的意义。高效液相色谱法(high performance liquid chromatography,HPLC)将具有不同极性的单一溶剂或不同比例的混合溶剂、缓冲液等流动相泵入装有固定相的色谱柱,在柱内各成分被分离后,进入检测器进行检测,从而实现对试样的分析。本试验利用HPLC对患者血浆中伏立康唑浓度进行分析,旨在为临床用药提供依据、提高其临床药效。
1 资料与方法
1.1一般资料 选取2013年1月至2013年12月在海军总医院感染科室中采用伏立康唑治疗真菌感染的患者60例,根据患者意愿及治疗方案将患者分为口服组40例,注射组20例。口服组中男22例、女18例,年龄18~58(32.6±2.9)岁。注射组中男10例、女10例,年龄18~60(33.5±3.2)岁。所有患者在试验前1个月均未服用任何药物,均于试验前询问病史,进行心电图、血尿常规等检查,合格者纳入试验对象,并签署知情同意书。
1.2HPLC法检测伏立康唑浓度
1.2.1仪器与试剂 Agilent1100型高效液相色谱仪(包括Agilent色谱工作站,四元输液泵,G1316A柱温箱,自动进样器,二极管陈列检测器)(美国安捷伦公司生产),AB204-A型电子分析天平[梅特勒-托利多(上海)仪器公司生产],旋涡混合仪(北京踏锦科技有限公司生产,Muti-Tube Vortexer VX-Ⅲ),TG16-W型离心机(中国湘仪赛特离心机仪器有限公司生产)。伏立康唑对照品(批号:100862-200701)和劳拉西泮对照品(批号:030062)均购自中国药品生物制品检定所,纯度均为100%,其中劳拉西泮对照品作为内标化合物。磷酸二氢钠为分析纯;甲醇、乙腈为色谱纯;水为超纯化水。
1.2.2标准品溶液的配制 劳拉西泮对照品溶液:精密称取劳拉西泮对照品50 mg,置于50 mL容量瓶中,用50%甲醇溶液溶解并稀释至50 mL,制成1000 mg/L的劳拉西泮对照品内标液,将内标液用甲醇稀释为20 mg/L的工作液,置于4 ℃冰箱冷藏备用。伏立康唑对照品溶液:精密称取100 mg伏立康唑对照品,置于100 mL容量瓶中,用50%甲醇溶液溶解并稀释至100 mL,制成1000 mg/L的伏立康唑对照品储备液,置于4 ℃冰箱冷藏备用。
1.3给药方法 口服组均口服伏立康唑(成都华神集团股份有限公司制药厂,批号:20060223),每日给药2次,每次4mg/kg,持续用药2周。静脉注射组以4 mg/kg伏立康唑(丽珠集团丽珠制药厂,批号:20070504)+5%葡萄糖200 mL静脉注射,每日2次,持续用药7 d。
1.4HPLC法进行浓度测定
1.4.1色谱条件 色谱柱为ZORBAX Extend-C18(4.6 mm×250 mm,5 μm),流动相:0.1 mol/L磷酸二氢钠-水-乙腈(20 ∶35 ∶45),流速为:1.0 mL/min,柱温40 ℃,进样量20.0 μL,检测波长为256 nm。
1.4.2血样采集 所有受试者试验前10 h进食清淡食物,禁食过夜,于次日清晨给药,给药后2 h方可饮水,4 h后统一进食低脂食物。采用肘静脉取血的方法分别在给药前(0 h)和给药后0.25,0.5,0.75,1.0,1.5,2.0,2.5,3.0,4.0,6.0,8.0,12.0,24.0 h取血5.0 mL,注入肝素抗凝管中,以离心半径20 cm,3000 r/min离心10 min,取上层血浆置于-65 ℃保存待测。
1.4.3血浆样品处理与测定 精密量取200 μL的血浆样品置于2 mL的离心管中,加入劳拉西泮内标液100 μL,混合均匀,加入100 μL的氢氧化钠溶液(0.1 mg/L)以碱化血浆,用乙酸乙酯-二氯甲烷(75∶25)1.5 mL进行萃取,旋涡振荡5 min,3500 r/min离心10 min,取上清液置于另一个2 mL离心管中真空挥干,用100 μL流动相复溶,进样20.0 μL。
1.4.4标准曲线与方法专属性 取标准空白血浆(上海恒远生物科技有限公司提供)1.0 mL,加入不同体积的伏立康唑对照品储备液,配制浓度分别为0.1、0.2、0.5、1.0、2.0、4.0、8.0和10.0 mg/L的系列标准血浆样品,根据HPLC测定的结果,绘制标准曲线,再分别配制伏立康唑的浓度分别为0.2、2.0和8.0 mg/L的低、中、高3种浓度血浆样品各5份,测定日内精密度:1 d内低、中、高每种浓度连续测定5次;日间精密度为3 d内,每日各浓度测定1次;稳定性试验:在1.0、2.0、4.0、6.0、8.0、10.0、12.0 h对血浆样品进行HPLC检测,观察不同时间色谱行为的差异程度,不同时间点测定值的相对标准偏差(relative standard deviation,RSD)均<15%时,认为稳定性良好。并计算提取回收率和方法回收率,提取回收率=伏立康唑峰面积/等量伏立康唑对照品溶液峰面积,方法回收率=实测浓度/理论浓度。
1.4.5血液样品的测定 将所有患者经肘静脉采血处理后的样品,按“1.4.1”项下的色谱条件进行HPLC测定,并利用标准曲线计算各时间点血浆中伏立康唑的浓度。药师将上述测定结果及时反馈给主管医师,根据血药浓度值及时调整给药剂量和给药方案。
1.5统计学方法 所有数据均输入Excel数据软件中进行分析处理,并以伏立康唑峰面积与内标峰面积的比值Y与血药浓度X进行线性回归。
2 结 果
2.1标准曲线结果 采用Excel数据软件,得出伏立康唑浓度的线性回归方程:Y=0.5238X+0.002(r2=0.9997),线性范围为0.1~10.0 mg/L。40例口服组定量下限为0.1 mg/L;20例静脉注射组定量下限为0.12 mg/L。
2.2方法专属性结果 HPLC检测发现伏立康唑色谱峰分离良好、峰形对称,血浆内源性杂质峰不明显,口服组保留时间为5.8~8.2 min,平均保留时间为(7.0±0.9)min;静脉注射组保留时间为6.2~8.7 min,平均保留时间为(7.4±0.9)min。劳拉西泮保留时间为5.2~6.3 min,平均保留时间为(5.68±0.36)min。所取3个浓度的血浆样品,进行方法学考察发现,日内和日间精密度RSD均<5%,表明方法的精密度良好;回收率试验结果显示,方法回收率和提取回收率较好,各浓度下均在80%~120%的范围内(表1)。

图1 口服组伏立康唑面积与与内标峰面积的线性关系

图2 注射组伏立康唑浓度与内标峰面积的线性关系
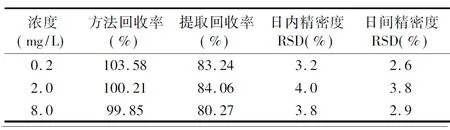
表1 伏立康唑回收率和精密度实验结果 (n=5)
2.3临床应用结果 40例口服组患者血浆中伏立康唑浓度为1.30~1.82 mg/L,平均浓度为(1.56±0.85)mg/L;20例静脉注射组患者血浆中伏立康唑浓度为1.37~1.87 mg/L,平均浓度为(1.62±0.58)mg/L。
3 讨 论
目前,可以采用多种方法检测生物样本中伏立康唑的浓度,其中主要有高效液相荧光检测法和紫外检测法以及高效液相-质谱联用法[9-12]。本试验采用的HPLC方法检测血浆中伏立康唑的浓度,操作具有方法专属性高、简单实用、灵敏度高、分离效果较好的优点。本试验采用0.1 mol/L磷酸二氢钠-水-乙腈(20 ∶35 ∶45)为流动相,所得峰形对称,伏立康唑色谱峰分离完全,杂峰干扰较小;此外,采用乙酸乙酯-二氯甲烷(75 ∶25)作为萃取剂,不仅所用萃取剂减少,而且分离效果更佳,缩短了样品处理时间。本试验建立的HPLC检测方法准确度好,提取回收率高,日内和日间RSD均符合要求,达到了伏立康唑治疗药物浓度检测要求,为临床用药剂量和给药方案调整提供重要参考依据,有利于实现患者个体化治疗的安全实施。
[1] Jeu L,Piacenti FJ,Lyakhovetskiy AG,etal.Voriconazole[J].Clin Ther,2003,25(5):1321-1381.
[2] Johnson LB,Kauffman CA.Voriconzole: a new triazole antifungal agent[J].Clin Infect Dis,2003,36(5):630-637.
[3] Keady S,Thacker M.Voriconazole in the treatment of invasive fungal infections[J].Intensive Crit Care Nurs,2005,21(6):370-273.
[4] Ben-Ami R,Lewis RE,Kontoyiannis DP.Immunocompro-mised hosts:immunopharmacology of modern antifungals[J].Clin Infect Dis,2008,47(2):226-235
[5] 沈海蓉,李中东,钟明康.新型抗真菌药伏立康唑[J].中国新药与临床杂志,2004,23(5):308-310
[6] Smtih J,Safdar N,Knasinski V,etal.Voriconzole therapeutic drug monitoring[J].Antmicrob Agents Chemother,2006,50(4):1570-1572
[7] 曲恒燕,李媛媛,高洪志,等.伏立康唑人体药代动力学的特征与差异研究[J].中国药物应用与监测,2012,9(4):187-190.
[8] 王瓅珏,唐惠林,段京莉.CYP2C19基因多态性对伏立康唑药代动力学影响的系统评价[J].中国临床药理学杂志,2011,27(8):607-611.
[9] 张志华,易鸿,何周康,等.HPLC-MS/MS法测定伏立康唑的血药浓度及其在生物等效性研究中的应用[J].中南药学,2009,7(12):889-892.
[10] 武晓捷,董晓易,陈轶坚,等.伏立康唑治疗药物浓度检测方法的建立[J].中国感染与化疗杂志,2009,9(2):118-122.
[11] 董平,孟现民,刘荣,等.RT-HPLC法测定AIDS合并肺部真菌感染患者伏立康唑的血药浓度[J].中国临床药学杂志,2010,19(3):163-166.
[12] 史卉妍,彭亮,谭志荣,等.高效液相色谱法测定人血浆中伏立康唑浓度[J].中南药学,2007,5(4):305-308.
