耳用地塞米松热敏性凝胶的制备及性能的检测
2014-03-28程雪峰敖华飞
王 勤,程雪峰,李 聪,顾 健,敖华飞
(上海交通大学医学院附属第三人民医院耳鼻咽喉-头颈外科,上海 201900)
中内耳疾病包括分泌性中耳炎、自身免疫性内耳疾病及梅尼埃病等,临床常用的治疗方法为全身应用激素,为达到有效药物浓度,需要使用较大剂量,因此会引起全身不良反应。近年来有学者尝试局部用药治疗,但由于鼓室经咽鼓管与鼻腔相通,难以让药物较长时间滞留,大大影响疗效。热敏性凝胶[1-3]具有随温度升高而变成凝胶的特性,可以利用此特点使局部长期保持药物浓度,进而避免反复用药造成鼓室损伤[4-5]。本研究以泊洛沙姆407为基质制备耳用地塞米松热敏性凝胶,并对其体外释放性能进行检测,报告如下。
1 材料与方法
1.1材料
1.1.1试剂 地塞米松(上海楷洋生物有限公司,生产批号:090504),泊洛沙姆407(poloxamer407,德国BASF公司,生产批号:9003116),地塞米松对照品(中国药品生物制品检定所,生产批号:10098685)。
1.1.2仪器设备 1/10万电子天平(AE240型,梅特勒-托利多有限公司),DK-8D型电热恒温槽(上海精宏实验设备有限公司),88-Ⅰ型定时恒温磁力搅拌器(上海思乐仪器有限公司),UV-9200型紫外分光光度计(上海元析仪器有限公司),TK-20A型透皮扩散试验仪(上海锴凯科技贸易公司),微量离心机(BECKMAN COULTER,美国)。
1.2方法
1.2.1制备地塞米松热敏性凝胶 称取一定量的泊洛沙姆407,加入定量等渗的磷酸盐缓冲液(phosphate buffered saline,PBS)溶液配成浓度为16%、17%、18%、19%、20%的等量泊洛沙姆407溶液,另外称取等质量的地塞米松加入上述各泊洛沙姆407溶液中,使其地塞米松浓度为10 g/L,在恒温磁力搅拌下使上述溶液分散均匀,然后放置在4 ℃的冰箱中冷胀48 h,使凝胶分散均匀,充分溶解膨胀,得到澄清透明溶液。
1.2.2测定相转变温度 同时配制浓度为16%、17%、18%、19%、20%的泊洛沙姆407溶液放于4 ℃的冰箱中冷藏48 h得澄明溶液。取储存于冰箱中的泊洛沙姆溶液和含地塞米松的泊洛沙姆407凝胶溶液,取等质量的溶液分别置于容量瓶中,温度计直接插入容量瓶的溶液中(温度计的玻璃泡需与溶液充分接触),然后整体置于恒温水浴中,水浴缓慢升温(升温速率为1 ℃/1~2 min),观察并记录内容物不流动时刻的温度。每份溶液需要测定3次,取平均值。然后根据适合耳用的温度(34 ℃)选择合适的泊洛沙姆407浓度。
1.2.3测定波长的选择 配制浓度为10 mg/L的地塞米松溶液。另外选择释放介质即等渗PBS,在注射用水为空白对照的基础上对波长范围在300~500 nm内进行扫描。
1.2.4绘制标准曲线 将地塞米松对照品25 mg置于25 mL容量瓶中,加入等渗PBS适量溶解(储备液)。分别精密量取溶液0.1、0.2、0.3、0.4、0.5、0.6 mL,置于25 mL容量瓶中,并将其稀释至刻度,配成4、8、12、16、20、24 mg/L的溶液。取20μL溶液进样,在特定波长处测定不同浓度的地塞米松溶液的吸光度。
1.2.5测定精密度 按上述方法制备3种浓度(24.0、12.0、4.0 g/L)的地塞米松对照液各3份,置于室温,闭光保存。分别在同一日不同时点间测量5次,计算日内地塞米松吸光度的相对标准差(relative standard deviation,RSD);再在5 d内分别每日测量1次,计算日间RSD。
1.2.6测定回收率 分别精密量取含地塞米松10 g/L的样品1 mL 6份,置于50 mL的容量瓶中,各精密加入上述制备的含地塞米松1 g/L的储备液3.0、4.0、5.0 mL,加等渗PBS稀释至刻度摇匀(每份浓度各制备2份);再分别另取上述液体1 mL,以等渗PBS稀释至50倍,混合摇匀。取适量溶液以离心半径6 cm,3000 r/min离心5 min,取上清液测定并记录吸光度的数值。
1.2.7体外测定凝胶释药 采用TK-20A型透皮扩散试验仪,在Franz立式扩散池模型基础上进行测定。将试验仪的水浴箱维持在36.0 ℃,并控制使其保持在恒温状态,转速维持在200 r/min,分别将塞米松热敏性凝胶和等渗PBS加入到给药池和接受池,每隔一定时间取接受池样品1 mL,然后再加1 mL PBS溶液。在等渗PBS为空白对照的基础上,测量吸光度。不同时点间按上述方法进行测量,即可得到地塞米松热敏性凝胶不同时间点的药物累计释放量。
2 结 果
2.1地塞米松热敏性凝胶基质浓度的选择 以最接近人体中耳内的温度34 ℃作为相转变温度筛选的依据,由结果(图1)可知:浓度为17%的泊洛沙姆407溶液在34 ℃时已形成凝胶;地塞米松对泊洛沙姆407的相转变温度影响很小。故选择浓度为17%的泊洛沙姆407作为凝胶基质。
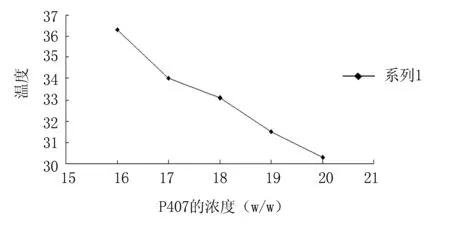
图1 不同浓度的泊洛沙姆407与凝胶温度的关系
2.2体外释放度的测定 测定波长的选择结果显示地塞米松紫外吸收光谱在415 nm的波长处有最大吸收,而415 nm波长处PBS吸收很少,两者能明显分离。故选择测定波长为415 nm。以C(浓度)对A(吸光度)进行线性回归绘制标准曲线得方程为C=44.241A-1.860(r=0.998,n=6)。试验结果表明,在4~24 mg/L范围内地塞米松和吸光度呈良好线性关系。日内精确度(RSD)=1.032%,日间RSD=1.936%,此结果符合方法学要求。回收率结果见表1,结果同样符合方法学要求。
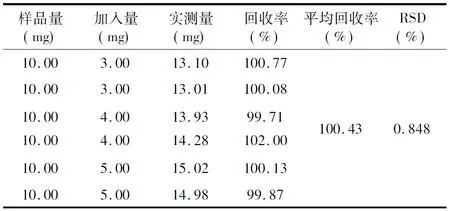
表1 回收率测定结果
RSD:相对标准差
2.3样品体外累计药物释放量的测定 据上述测定结果,选择以浓度为17%的泊洛沙姆407为基质的地塞米松热敏性凝胶进行体外累计药物释放量的测定。如图2所示:药物累计释放百分率和时间呈良好的线性关系,显示为零级动力学特征。并将此累计药物释放曲线进行零级释药曲线拟和,即可得方程y=0.3235x+10.184(r=0.9978),符合方法学要求。如图2所示两者良好的线性关系也说明样品在体外整个释放过程中无突释,在240 h时药物的累计释放量已经达到90%,整个释药过程完全,具有较好的缓释性和控释性。
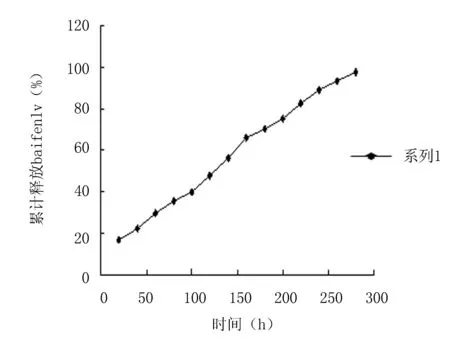
图2 地塞米松热敏性凝胶累计药物释放量曲线
3 讨 论
糖皮质激素是治疗中内耳疾病的重要药物,但血-外淋巴屏障严重限制药物到达中内耳组织,为达到有效药物浓度,需要使用较大剂量。由此便带来众多不可避免的不良反应,更是高血压、糖尿病、胃溃疡等疾病的禁忌,限制了其应用,进而限制了中内耳疾病的治疗效果。所以,近年来鼓室内局部用药治疗中内耳疾病成为国内外学者探讨的热点,然而如何在局部保持药物的高浓度长期给药成了研究的关键。
近年来,由于材料科学的发展,出现大量的药物缓释材料,为中内耳疾病的局部治疗提供帮助。热敏性凝胶具有特殊的环境敏感性,即在常规温度下为溶液状态,随着所处外界的温度升高,其能够发生相转化,形成非化学交联型半固体凝胶[3、6],所以以此作为载药基质,药物即可精确定位到具体的组织内,到达局部用药的目的,这样即可减少对全身其他组织的不良反应,进而可以扩宽地塞米松治疗中内耳疾病的适应证的范围。
利用泊洛沙姆407的特殊性质采用冷溶法制备地塞米松热敏性凝胶,目的是使热敏性凝胶在低温时为流动性较好的液态,随着所处外界温度的升高发生状态的转变,形成半固体凝胶。而本实验的重点是考察不同浓度的泊洛沙姆407的转化温度,以人体中耳内的温度34 ℃作为筛选温度的参考依据,选择合适的浓度的泊洛沙姆407。在此基础上同时考察了含不同浓度泊洛沙姆407的地塞米松热敏性凝胶的相转变温度,以排除加入的地塞米松对相转变温度的影响。
在本实验中以直观简单的倾斜法观察相转变问题,操作简单,结果准确可靠。本研究用等渗的PBS缓冲液进行配置样品,不仅保证了地塞米松的完全溶解,还保证了样品的pH值,减少了药物对鼓室内酸碱平衡的影响。查阅大量的凝胶体外释放的研究文献[7-10],研究凝胶类药物体外释放[9-11],在此基础上为了能较好地模拟人体中耳环境,本研究采用其中的立式Franz扩散池来检测凝胶药物的释放,此方法能较好地模拟鼓室相对封闭的环境,通过调节固定的转速来模拟鼓室所处的环境,稳定性好,测定准确。本研究制备的地塞米松耳用热敏型凝胶累计释放百分率接近90%时需要240 h,整个药物释放过程完全,且具有一定的控释作用。配置的地塞米松热敏性凝胶最突出的特点就是黏附力很强,药物表面活性高,增加药物与局部的接触时间和面积,同时减少了用药次数,增加了药物疗效,降低了对局部的刺激。
将泊洛沙姆407作为地塞米松的载药基质制备的地塞米松热敏性凝胶,此体外实验取得了良好的效果,但是否能够在体内有一定的疗效、能否很好地在体内降解值得进一步研究,期待此剂型成为治疗中内耳疾病的理想制剂。
[1] Cho HJ,Park EK,Song KW.Poloxamer/Cyclodextrin/Chitosan-based Thermoreversible Gel for Intranasal Delivery of Fexofenadine Hydrochloride[J].J Pharm Sci,2011,100(2):681-691.
[2] Dumortier G,Grossiord JL,Agnely F,etal.A review of poloxamer 407 pharmaceutical and pharmacological characteristics[J].Pharm Res,2006,23(12):2709-2728.
[3] Monti D,Burgalassi S,Rossato MS,etal.Poloxamer 407 microspheres for orotransmucosal drug deliverry.partⅡ:In vitro/in vivo evaluation[J].Int J Pharm,2010,400(1/2):32-36.
[4] Niu GF,Du FY,Song L,etal.Synthesis and characterization of reactive poloxamer 407s for biomedical applications[J].J Control Release,2009,138(1):49-56.
[5] Yong CS,Choi JS,Quan QZ,etal.Effect of sodium chloride on the gelation temperature,gel strength and bioadhesive force of poloxamer gels containing diclofenac sodium[J].Int J Pharm,2001,226(1/2):195-205.
[6] Albertini B,Passerini N,Sabatino MD.Poloxamer 407 microspheres for orotransmucosal drug delivery,partⅠ:Formulation,manufacturing and characterization[J].Int J Pharm,2010,399(1/2):71-79.
[7] Gupta S,Samanta MK,Raichur AM.Dual-drug delivery system based on in situ gel-forming nanosuspension of forskolin to enhance antiglaucome efficacy[J].Pharm Sci Tech,2010,11(1):322-335.
[8] Mansoor M,Amiji MM,Lai PK,etal.Intr-Tumoraladministration of paclitaxel in an in situ gelling poloxamer 407 formulation[J].Pharm Dev Technol,2002,7(2):195-202.
[9] Oh KS,Lee KE,Han SS,etal.Formation of core/shell nanoparticles with a lipid core and their application as adrug delivery system[J].Biomacromolecules,2005,6(2):1062-1067.
[10] Cafaggi S,Leardi R,Parodi B,etal.Preparation and evaluation of a chitosan salt-poloxamer 407 based matrix for buccal drug delivery[J].J Control Release,2005,102(1):159-169.
