腺苷和虫草素在北虫草子实体各部位中的分布及含量
2014-03-28颜玉文许登泉赵宇蕾王林鞠婧婧李雯葛晓群陈顺志
颜玉文许登泉赵宇蕾王 林鞠婧婧李 雯葛晓群* 陈顺志
(1 扬州大学医学院药学系药理教研室,江苏 扬州 225001;2 江苏学府生物工程有限公司,江苏 镇江 212000)
腺苷和虫草素在北虫草子实体各部位中的分布及含量
颜玉文1许登泉2赵宇蕾1王 林2鞠婧婧1李 雯2葛晓群1* 陈顺志2
(1 扬州大学医学院药学系药理教研室,江苏 扬州 225001;2 江苏学府生物工程有限公司,江苏 镇江 212000)
目的 研究腺苷和虫草素在北虫草子实体各部位中的分布和总含量。方法 用RP-HPLC法分别测定北虫草子实体头部、中部、底部及全部子实体中腺苷和虫草素含量。结果 ①1号样腺苷和虫草素的含量顺序为头部>底部>中部;总量顺序为中部>头部>底部。2号样腺苷分布规律没有明显变化,但各部位虫草素含量均有所改变,顺序为底部>中部>头部,总量顺序仍为中部>头部>底部。②两种样品的腺苷总含量没有明显差异,但2号样虫草素含量几乎是1号样的2倍。结论 北虫草子实体各部位中腺苷和虫草素的分布以及总含量均有明显不同。
北虫草子实体;HPLC;腺苷;虫草素
北虫草又名蛹虫草[ Cordyceps militaris(L.)Link],为麦角菌科虫草属的模式种,具有抗菌、抗肿瘤、调节机体免疫力等功能[1]。它与冬虫夏草同属不同种,研究发现北虫草和冬虫夏草的活性成分相似,其中腺苷和虫草素的含量比冬虫夏草还要高[2,3]。鉴于野生冬虫夏草资源短缺,价格昂贵,因此,开发利用北虫草具有广阔的市场和发展前景。目前,人工培育北虫草技术已很成熟,其培育方法有3种:一是将北虫草菌接种在蛹体上,长出子实体。二是将北虫草菌接种在大米、玉米、小麦等固体培养基上,长出子实体。三是液体培养北虫草菌丝体[4]。人工培育的北虫草子实体和菌丝体已成为医药和保健品开发利用的主要原料。
北虫草含有多种生理活性物质,其中核苷类物质如腺苷、虫草素等是研究较多的活性成分。腺苷具有很好的生理和药理作用[5]。据报道,美国已将虫草素作为抗癌、抗病毒新药进入临床试验,我国由虫草素合成的治疗白血病新药也已进入Ⅰ期临床阶段[6],虫草素作为新药用于临床已为期不远。由于虫草素的合成存在一些问题[6],因此,从北虫草子实体或菌丝体中提取虫草素将成为药物原料的重要来源之一。为此,我们有必要对北虫草子实体中活性成分的分布和含量有比较清楚的了解,以便更好地开发和利用它们。本实验拟选择腺苷和虫草素为活性成分指标,以大米培养基培育的北虫草子实体为样本,来考察两种成分在子实体不同部位的分布和含量。
1 仪器与材料
1.1 仪器
Agilent 1260型高效液相色谱仪(美国安捷伦公司);KQ-400KDB型高功率数控超声波清洗器(昆山市超声仪器有限公司);台式离心机(Eppendorf,Centrifuge,Germany);电热恒温鼓风干燥箱(上海跃进医疗器械厂);电子天平(Sartorius,Germany);中药粉碎机SZJ-8100(青岛索优电器有限公司)65目标准样筛(上海分样筛厂);冰箱(BCD-208F,Haier)。
1.2 样品和试剂
北虫草子实体1号样、2号样和培养基由江苏学府生物工程有限公司提供。腺苷标准品购自中国药品生物制品鉴定所,批号:110879-200202,虫草素标准品由江苏学府生物工程有限公司赠送。色谱试剂均为色谱纯,甲醇购自TEDIA,USA。
2 方 法
2.1 色谱条件
色谱柱ZOXBAX Eclipse XDB-C18(4.6 mm×250 mm,5 mm);二极管阵列检测器(DAD检测器),柱温30 ℃;流动相:水-甲醇(85∶15),流速1 mL/min,检测波长260 nm,进样量20 μL。
2.2 虫草标准品的确认
虫草素标准品经过紫外和核磁共振分析,并通过省级成果鉴定,其标准品的含量达到98 %以上(苏科鉴字[2005]第529号),进一步纯化后,经中国医科院药物鉴定所分析,其纯度达到99.65 %,并获得科技部创新基金项目支持,达到量产水平(项目编号06C26213201077),该产品已供应到中国药品生物制品检定所。
2.3 标准曲线制备
分别配制浓度为0.5 mg/mL腺苷和虫草素标准液,等量混合,得标准储备液。取储备液0.1 mL、0.2 mL、0.4 mL、0.8 mL、1.6 mL、3.2 mL和4.8 mL,以纯净水稀释定容至10 mL(浓度范围为2.5~120 μg/mL),过0.45 μm膜,进样。记录峰面积,分别以浓度为横坐标(X)、峰面积为纵坐标(Y)绘制标准曲线,得出回归方程。
2.4 样品溶液制备及测定
分别取北虫草子实体1号样、2号样头部、中部、底部、全草和培养基粉。取样方法为顶端膨大的孢子头为头部,靠近培养基的部分为根部,其余中间部分为中部,分别称重,计算各部分重量百分比。将样品在80 ℃烘2h,然后粉碎,过65目筛。取样0.06 g,精密称定,分别加水2 mL,48 ℃超声60 min,5000 r/min离心30 min,留上清,在沉淀中加水2 mL,同上超声,如此重复3次,合并3次提取的上清,过膜,进样。每种样品做3份平行样。记录峰面积,根据标准曲线的回归方程计算样品中腺苷和虫草素的浓度。样品含量(mg/g)=样品浓度×稀释倍数/样品重量。样品某部位活性成分总量( %)=部位总量/全草总量×100 %
2.5 加样回收率
准确称取已知腺苷或虫草素含量的北虫草子实体0.2 g,分别加入腺苷或虫草素标准品低、中、高三个剂量,每个剂量做3份平行样。然后按“2.4”项下制备供试品溶液的方法制备所需溶液,进行HPLC法分析,分别计算腺苷加样回收率以及虫草素加样回收率。
3 实验结果与讨论
本实验色谱条件参照文献[7]略加改进。我们曾对水-甲醇流动相的比例进行了考察,结果测得在水:甲醇=85∶15及90∶10两种比例下,分离效果并无大的差别,考虑到对仪器和系统的保护,选取水-甲醇(85∶15)为流动相。
3.1 标准曲线的绘制
在本色谱条件下,测得腺苷的保留时间为6.9 min;虫草素为8.9 min(图1)。在2.5~120 μg/mL浓度范围内,标准曲线呈线性关系,计算得腺苷回归方程:y=30962x+1.4829(R2 =0.9998);虫草素回归方程:Y=63637X+68.271(R2=0.9996)。
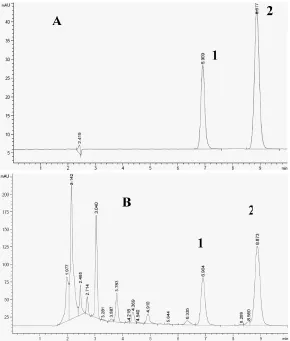
图1 标准品(A)与样品(B)的HPLC色谱图(1:腺苷;2:虫草素)
3.2 样品提取方法的考察
刘小莉等[7]研究发现以纯水作为提取剂,60 ℃超声50 min时提取效率最高,重复3次可完全提取。考虑到本实验所用的北虫草是以大米作为培养基的,培养基粉在温度超过50 ℃时容易变稠,故选择48 ℃超声。通过对超声时间(50 min、60 min、70 min)的考察,发现超声60 min时提取效率最好。
3.3 加样回收率
3.3.1 腺苷加样回收率
分别加入样品中腺苷含量一半的80 %、100 %和120 %低、中、高3个加入量,结果见表1。3个腺苷加样量的平均加样回收率(n=3)分别为98.0 %(RSD=0.66 %)、102.5 %(RSD=1.9 %)、99.9 %(RSD=1.3 %),平均加样回收率(n=9)为100.1 %(RSD=2.3 %)。
3.3.2 虫草素加样回收率
分别加入样品中虫草素含量一半的80 %、100 %和120 %低、中、高3个加入量,结果见表2。3个虫草素加样量的平均加样回收率(n=3)分别为100.8 %(RSD=0.9 %)、98.3 %(RSD=0.3 %)、101.1 %(RSD=1.5 %),平均加样回收率(n=9)为100.0 %(RSD=1.6 %)。
3.4 腺苷和虫草素在北虫草子实体中的分布
分别测定1号样、2号样头部、中部和底部腺苷和虫草素的量,计算每克样品的含量和每个部位的总量占全草总量的百分比,由此考察含量分布和总量分布,结果见表3。从表中可知,1号样头部腺苷和虫草素的含量均高于中部和底部,含量顺序为头部>底部>中部。然而,由于中部在全草中所占的重量比最大,因此中部腺苷和虫草素总量最多,总量顺序为中部>头部>底部。2号样头、中、底部腺苷的含量和总量分布规律与1号样的相似;但虫草素的分布发生了很大变化,各部位含量均升高,底部升高最多,为头部的2倍多,含量顺序变为底部>中部>头部。但各部位虫草素总量与储存一年的趋势仍然是一致的,即总量顺序仍然为中部>头部>底部。

表1 北虫草子实体中腺苷的加样回收率
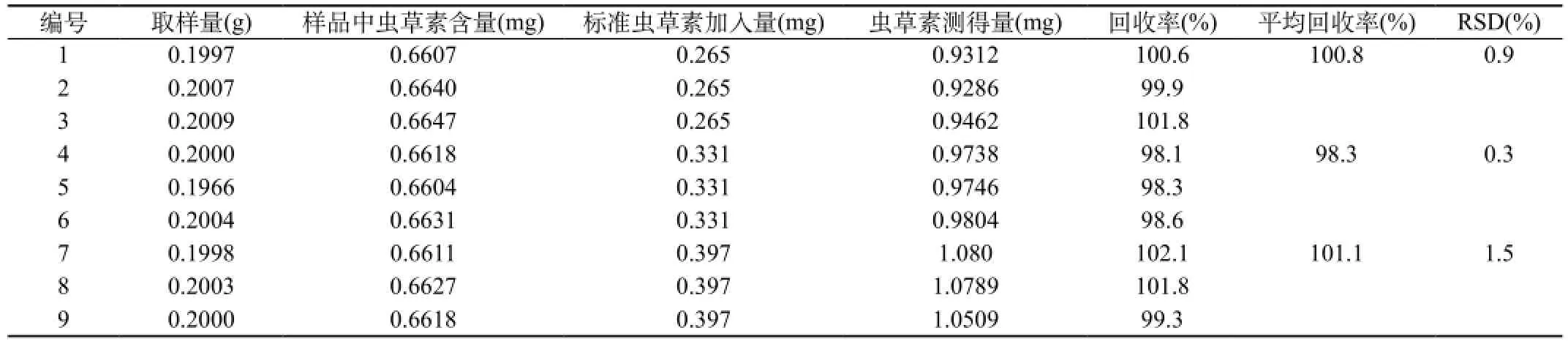
表2 北虫草子实体中虫草素的回收率
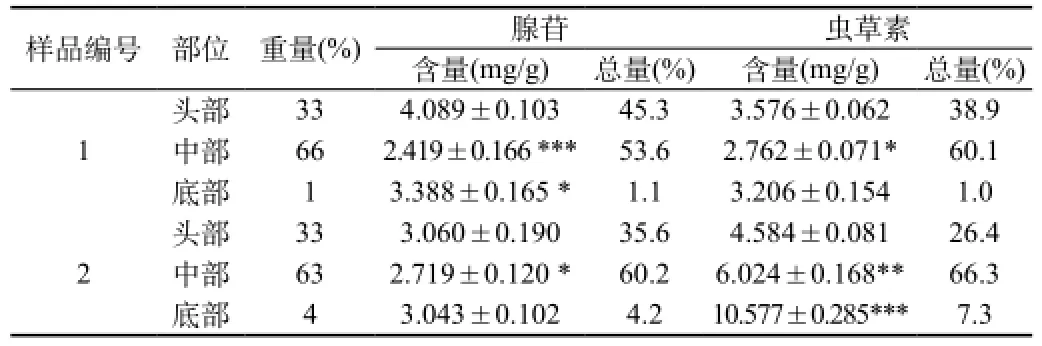
表3 北虫草子实体中腺苷和虫草素的分布比较(n=3)
张倩等[8]报道人工培育北虫草在不同生长时期各部分虫草素含量顺序是在不断变化的,即上部的含量随培养时间延长而增加,下部的含量则在下降,60 d时含量高低顺序是上部、中部、下部。而腺苷含量培养初期上部最高,下部最低,60 d时,各部位间没有差异了。因此采收时期不同,可能分布不同。另外,与该文报道的相比,我们取的底部比例很小,中部很大,因此取样方法不同也可能有影响。
3.5 北虫草子实体中腺苷和虫草素的总含量
测定全草中腺苷和虫草素的总含量。结果显示两种样品中腺苷含量虽有差异,但无显著性(表4)。虫草素含量差异较大,2号样几乎是1号样的2倍,差异有极显著性(P<0.001)(表4)。这两种样品从外观上看,1号样呈橘色,头部膨大数量较多,中部呈细柱状,底部微白;2号样呈褐色,头部膨大数量较少,中部呈粗扁状,底部略黑。显然是不同品种的北虫草。其活性成分的含量差异可能与菌种来源、培养方法[9]、培养条件[9]、生长时间[8]、保存时间[10]等有关。

表4 北虫草子实体中腺苷和虫草素总含量(n=3)
3.6 北虫草培养基中腺苷和虫草素的含量
本实验还对培养基中腺苷和虫草素含量进行了测定,结果为腺苷(6.242±0.129) mg/g,虫草素(1.238±0.042) mg/g,表明培养基中含有腺苷和虫草素。我们早在1995年就从培养基中提取虫草素获得成功,并通过省级成品鉴定[11,12]。从培养基中提取虫草素将是北虫草开发利用的重要途径之一。
4 结 论
本实验结果表明北虫草子实体不同部位的腺苷和虫草素的分布是不同的;不同品种或不同来源的北虫草子实体中上述成分的总含量亦存在差异。上述结果对开发利用北虫草子实体具有重要的指导意义。
[1] 孙军德,曹婧.不同北虫草菌株产类胡萝卜素分析[J].微生物学杂志,2012,32(3):95-97.
[2] 陈顺志,吴佩杰,管代义.组培蛹草与虫草成分的比较[J].食用菌, 1993(6):15-17.
[3] 李军,陈广生,方清茂.人工培养蛹虫草与冬虫夏草的比较研究[J].成都中医药大学学报,2010,33(3):82-84.
[4] 李亚洁,孟楠,石理鑫.柞蚕蛹虫草高产栽培技术的研究[J].食用菌,2009(1):34-35.
[5] 温鲁,夏敏,宋虎卫,等.液体培养蛹虫草虫草素和腺苷的代谢量[J].微生物学通报,2005,32(3):91-94.
[6] 都兴范,李军,王林美.蛹虫草中虫草素的研究进展[J].食用菌, 2012(6):3-5.
[7] 刘小莉,周剑忠,王英,等.虫草发酵菌丝体中腺苷和虫草素含量的检测[J].中国卫生检验杂志,2008,18(12):2507-2508.
[8] 张倩,唐永范,徐三妹.人工培育北冬虫夏草主要有效成分分布特点的研究[J].中医药学报,2011,39(4):72-74.
[9] 徐冲,钟丽娟,赵新海,等.蛹虫草菌丝固体法培养初探[J].山东农业科学,2010(11): 66-68.
[10] 史敏,赵宇,温学森.人工培养北虫草子座和培养基中多糖和核苷类成分的含量分析[J].食品与药品,2009,11(1):45-47.
[11] 陈顺志,刘毅,陈野,等.虫草素的紫外与红外光谱特征[J].中国生化药物杂志,1996,17(1):18-19.
[12] 陈顺志,褚景芝.虫草素及2′-脱氧腺苷的超导核磁共振与红外光谱鉴别[J].中国抗生素杂志,1996,21(1):9-11.
The Distribution and Contents of Adenosine and Cordycepin in Cordyceps militaris(L.)
YAN Yu-wen1, XU Deng-quan2, ZHAO Yu-lei1, WANG Lin2, JU Jing-jing1, LI Wen2, GE Xiao-qun1, CHEN Shun-zhi2
(1 Department of Pharmacology, Department of Pharmacy of Yangzhou University Medical College, Yangzhou 225001, China; 2 Jiangsu Xuefu Biological Engineering Co. Ltd, Zhenjiang 212000, China)
Objective To investigate the distribution and contents of adenosine and cordycepin in Cordyceps militaris(L.). Methods Using RP-HPLC to determine the contents of adenosine and cordycepin in the head, the middle, the bottom and the whole plant of Cordyceps militaris(L.). Results ①For sample 1, the contents of adenosine and cordycepin were the highest in the head of Cordyceps militaris, and were the lowest in the middle of it, respectively. But it was in the middle that the total amounts of adenosine and cordycepin were the highest, respectively. For sample 2, there was no obvious change in the distribution law of adenosine, but the contents of cordycepin in three parts had changed. The content of cordycepin was the highest in the bottom of Cordyceps militaris, and was the lowest in the head of it, respectively. But as to the total amounts, it was still the highest in the middle. ②There was no significantly difference between the contents of adenosine in two samples , but the content of cordycepin in sample 2 was twice higher than sample 1. Conclusion There were significantly differences on the distribution and total contents of cordycepin and adenosine.
Cordyceps militaris(L.); High performance liquid chromatography(HPLC); Adenosine; Cordycepin
R927.2
:B
:1671-8194(2014)02-0042-03
*通讯作者:E-mail:xqge@163.com
