168例HBsAg阳性患者HBV基因型分布及临床表现分析
2014-03-27夏明镜
夏明镜
(上海市杨浦区安图医院传染科,上海 200136)
乙型肝炎表面抗原(hepatitis B surface antigen,HBsAg)是临床上判断感染乙型肝炎病毒(hepatitis B virus,HBV)的标志之一。机体感染HBV后的病程各不相同,可与宿主的免疫状态、病毒的基因型等相关,也可能与疾病及其转归密切相关[1],因此了解HBV基因分布与其疾病的关系有十分重要的意义。本研究对168例HBsAg阳性患者的HBV基因型分布及临床表现进行了分析,现报告如下。
1 对象与方法
1.1对象 将2010年1月至2013年8月期间上海市杨浦区安图医院传染科收治的HBsAg阳性患者纳入研究,共168例,研究期间无失访、脱落、死亡病例。其中,男101例、女67例,年龄42~65(49.3±8.2)岁。
1.2方法
1.2.1入组患者HBV基因型的筛选 采用病毒基因组DNA抽提试剂盒[天根生物科技(北京)有限公司]分离患者血清中HBV-DNA,先用通用的外引物P1、S1-2进行第一轮HBV基因型聚合酶链反应(polymerase chain reaction,PCR),扩增A、B、C、D、E、F六型HBV基因型的共有序列约1100 bp;然后用A、B、C、D、E、F六型HBV基因型的特异性引物进行第二轮PCR,扩增产物进行琼脂糖凝胶电泳(100 V、50 min),紫外灯下显影,判断HBV基因型。
1.2.2入组患者的肝炎严重程度 按照下述标准对入组患者的炎症活动程度、肝纤维化程度进行分析。炎症活动程度:汇管区炎症、少数点状坏死为1期;点、灶状坏死,嗜酸小体形成为2期;出现桥接坏死为3期;桥接坏死范围广、累及多个小叶为4期。肝纤维化程度:汇管区出现纤维化,局限于小叶内为1期;纤维间隔形成、小叶结构保留为2期;小叶结构紊乱、未形成肝硬化为3期;出现早期肝硬化为4期。
1.2.3入组患者的肝功能指标测定 采集患者外周血5 mL,乙二胺四乙酸抗凝后,以离心半径25 cm,3000 r/min离心10 min,取血清检测肝功能指标,包括谷草转氨酶、谷丙转氨酶、碱性磷酸酶、γ谷氨酰转肽酶、总胆红素、HBV-DNA拷贝数。谷草转氨酶、谷丙转氨酶、碱性磷酸酶、γ谷氨酰转肽酶、总胆红素的检测采用电化学发光法,HBV-DNA拷贝数的检测采用荧光定量PCR法。
1.2.4入组患者的肝纤维化指标测定 采集患者外周血5 mL,乙二胺四乙酸抗凝后离心,收集血清检测Ⅲ型胶原N端肽、Ⅳ型胶原、层粘连蛋白、透明质酸酶。
1.4统计学方法 应用SPSS 18.0软件对数据进行
2 结 果
2.1入组患者HBV基因型的分布情况 入组的168例患者中,HBV基因型B型者132例,占78.57%;C型36例,占11.43%;A、D、E、F、G、H型均未发现(表1)。
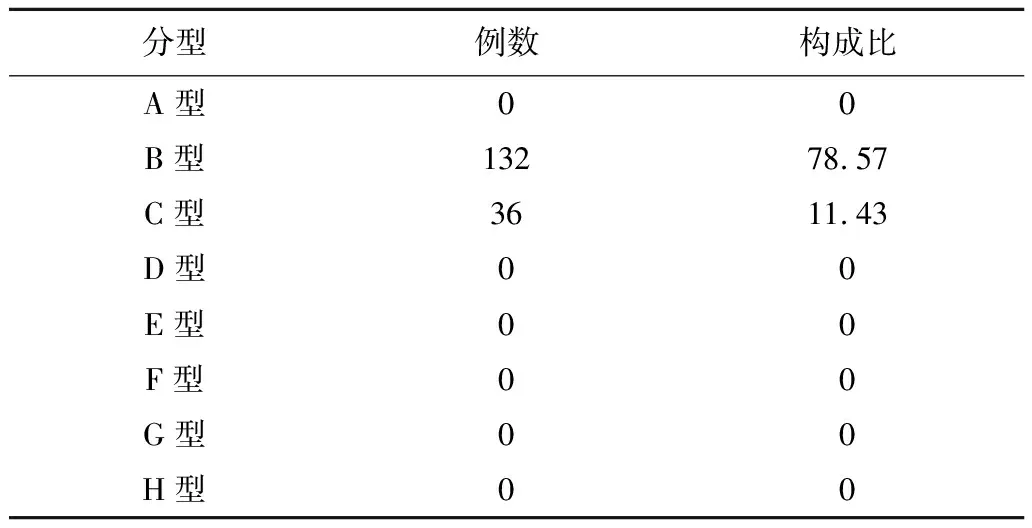
表1 HBsAg阳性患者HBV基因型的分布情况
2.2入组患者不同HBV基因型的肝炎严重程度 HBV-B型患者的炎症活动程度、肝纤维化程度的分期均低于HBV-C型患者,二者比较差异有统计学意义(P<0.05)(表2)。
2.3入组患者不同HBV基因型的肝功能指标比较 HBV-B型患者的谷草转氨酶、谷丙转氨酶、碱性磷酸酶、γ-谷氨酰转肽酶、总胆红素、HBV-DNA拷贝数均显著低于HBV-C型患者(P<0.05)(表3)。
2.4入组患者不同HBV基因型的肝纤维化程度 HBV-B型患者的血清透明质酸、层粘连蛋白、Ⅳ型胶原、Ⅲ型胶原N端肽水平均显著低于HBV-C型患者(P<0.05)(表4)。
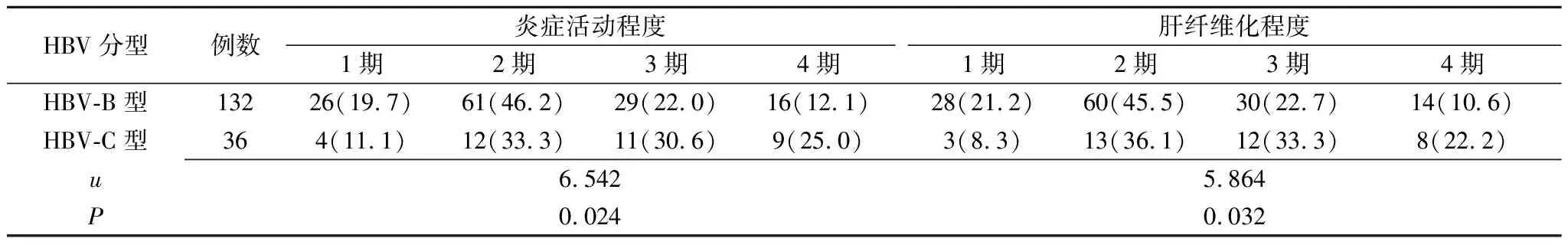
表2 HBsAg阳性患者不同HBV基因型的肝炎严重程度比较 [例(%)]
HBsAg:乙型肝炎表面抗原;HBV:乙型肝炎病毒
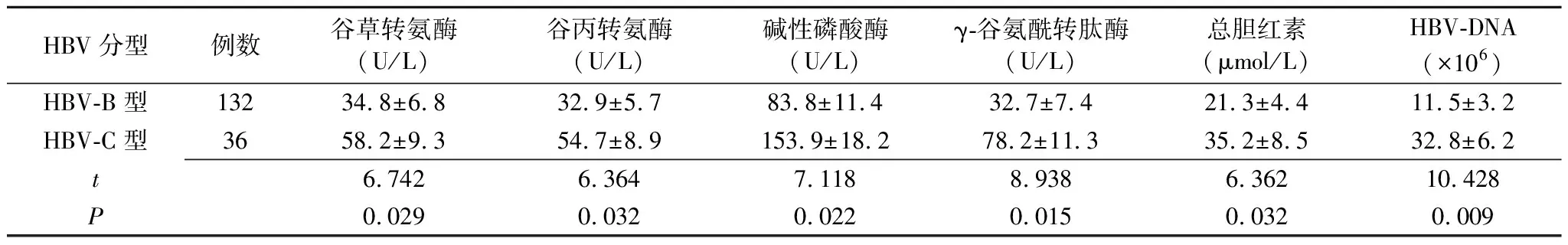
表3 HBsAg阳性患者不同HBV基因型的肝功能指标比较
HBsAg:乙型肝炎表面抗原;HBV:乙型肝炎病毒
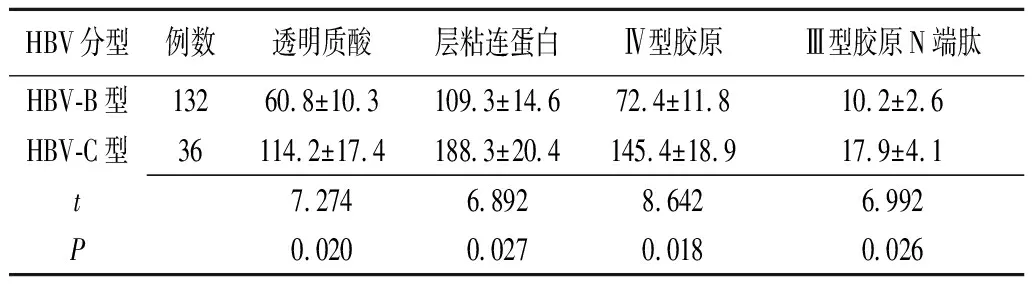
表4 HBsAg阳性患者不同HBV基因型的肝纤维化指标比较 (μg/L)
HBsAg:乙型肝炎表面抗原;HBV:乙型肝炎病毒
3 讨 论
HBsAg是一种相对分子质量为2.4×106的多肽,位于HBV的外壳中,虽然本身不具有传染性,但是却能在HBV感染宿主的过程中出现。目前,已将HBsAg作为已感染HBV的标志之一[2]。HBV进入宿主后会诱发一系列免疫反应、造成肝脏细胞的变性、坏死。HBV感染后的临床过程各异、疾病谱各不相同,其病情的进展与宿主免疫状态、病毒感染方式等密切相关[3]。
近年来的研究发现,HBV基因组DNA序列的不同也参与HBV感染宿主的过程[4]。不同的HBV基因型患者可表现出不同的疾病过程,部分患者可表现为HBsAg携带者,但无明显的临床症状;部分患者表现为慢性乙型肝炎,发生肝细胞的变性坏死;部分患者则可在肝细胞变性坏死的基础上出现弥漫性纤维化和假小叶的形成,严重者可发展为肝硬化和肝癌[5]。
已知的HBV基因型共有A、B、C、D、E、F、G、H八种类型,相关的研究已经发现其分布有明显的地区差异[6]。A型主要分布在欧洲的西北部及北美洲;B型、C型主要分布在亚洲的东部及南部;D型多见于地中海地区以及中东地区;E型主要分布在撒哈拉沙漠区域;F型、H型主要见于美国及中美洲;G型仅在美国、法国两个国家发现[7]。相关的流行病学资料显示,我国HBV的基因型主要为B、C两种类型[8],本研究也同样发现168例入组患者中HBV-B型占78.57%、C型占11.43%,其余类型未发现。
目前的多数研究认为,HBV-C型感染后宿主的疾病进展较快、肝功能破坏较重、预后较为不理想[9]。研究对168例HBsAg阳性患者的临床表现进行了分析,旨在为探寻不同HBV基因型患者的临床特征提供参考。本研究首先比较了HBV-B型患者与HBV-C型患者的肝炎严重程度,由结果可知:HBV-B型患者的炎症活动程度、肝纤维化程度均弱于HBV-C型患者,说明HBV-B型感染后的整体病情相对较轻。
为了进一步确定两种基因型HBV感染后的疾病情况,本研究对肝功能指标和肝纤维化指标进行了比较分析,结果:HBV-B型患者的谷草转氨酶、谷丙转氨酶、碱性磷酸酶、γ-谷氨酰转肽酶、总胆红素、HBV-DNA拷贝数以及血清透明质酸、层粘连蛋白、Ⅳ型胶原、Ⅲ型胶原N端肽水平均低于HBV-C型患者。上述指标能够直接反映肝细胞的损伤程度和肝脏组织发生纤维化的程度,且结果显示HBV-B型感染后肝细胞破坏较轻,纤维化程度较弱。
本研究纳入的样本量相对较少,若要得到更为确切可靠的结论需要在下一步工作中收集更多的病例。但是通过上述分析可以得出初步的结论:在我国HBsAg阳性的患者中,HBV基因型主要为B型和C型;且B型感染后的炎症活动程度、肝纤维化程度均较弱,整体病情相对较好。
[1] Ji YP,Zhao LY,Zhou B,etal.Investigation and analysis of occult hepatitis B virus infection among voluntary blood donors in Lishui area[J].Zhonghua Shi Yan Lin Chuang Bing Du Xue Za Zhi,2011,25(6):457-459.
[2] Dias AL,Oliveira CM,Castilho Mda C,etal.Molecular characterization of the hepatitis B virus in autochthonous and endogenous populations in the Western Brazilian Amazon[J].Rev Soc Bras Med Trop,2012,45(1):9-12.
[3] 陈媛,张永乐,陈公英.慢性乙型肝炎临床表现形式与乙肝病毒基因型的关系分析[J].中国卫生检验杂志,2011,21(9):2239-2240.
[4] 王蕾,刘华,宁小晓,等.HBsAg和HBsAb双阳性慢性乙肝患者血清中HBV基因型与S区突变的关系[J].上海交通大学学报,2010,30(10):1226-1230.
[5] 罗光成,冯霞,闫惠平,等.慢性乙型肝炎患者血清自身抗体与HBV基因型关系的研究[J].北京医学,2012,34(9):814-817.
[6] Tuaillon E,Mondain AM,Nagot N,etal.Comparison of serum HBsAg quantitation by four immunoassays,and relationships of HBsAg level with HBV replication and HBV genotypes[J].PLoS One,2012,7(3)e32143:
[7] 林芳,冯霞,张国元,等.慢性乙型肝炎细胞免疫研究动态[J].北京医学,2011,33(7):494-496.
[8] 蔡伟雄,李惠平,何少雄.慢性乙型肝炎患者肝组织中HBV cccDNA定量检测与基因型的相关性分析[J].中国医药科学,2012,2(16):107-109.
[9] 黄晶,高志良.乙型肝炎病毒基因型及其临床意义的研究[J].世界华人消化杂志,2002,10(11):1362-1364.
