大肠癌肝转移相关的间质差异表达基因的筛选
2014-03-27程家乐彭佳远
程家乐,姚 敬,彭佳远,汪 昱
(上海交通大学附属第六人民医院普外科,上海200000)
大肠癌是影响人类健康的重要疾病,其发病率在世界范围内位于第三位。尽管诊断技术和治疗方式的不断改进,每年仍有约100万人发生大肠癌,并且有60万人死于该病[1],约一半大肠癌患者发生远处转移,其中通过门静脉系统肝转移是主要的转移途径[2-3]。故对大肠癌肝转移的早期发现及早期诊断成为治疗的关键。大肠癌肝转移的上皮细胞相关基因目前国内外研究较多,而间质遗传不稳定基因国外报道较少,国内未见报道。激光捕获显微切割和基因芯片两种新兴技术已成为肿瘤研究的重要手段。前者能在显微镜直视下通过激光捕获和显微切割从异质性组织中得到目的细胞或细胞群,保证了组织的同质性;后者可同时高效率检测成千上万个基因,是筛选差异表达基因有力的工具。因此,本实验联合应用激光捕获显微切割和基因芯片技术筛选大肠癌肝转移间质相关基因,为临床早期诊断和靶向治疗大肠癌肝转移奠定基础。
1 材料与方法
1.1组织标本 于2008年7月至2010年7月由上海市第六人民医院提供的手术切除大肠癌伴肝转移及不伴肝转移原发灶标本各4例。大肠癌非转移为大肠癌术后2年内未见肝转移的病例。实验标本基本信息见表1,所有患者术前均未行化疗和放疗,术后30 min内取肿瘤组织并与液氮罐保存备用,全部标本均由病理学诊断确诊。
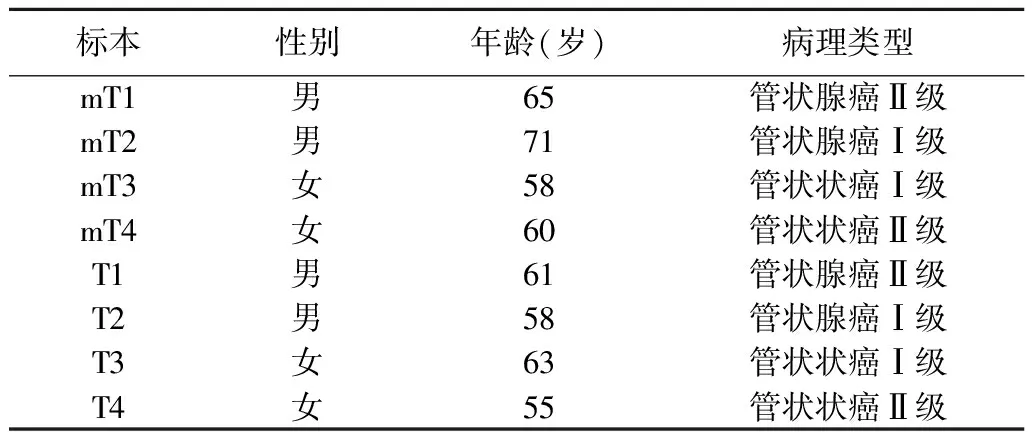
表1 大肠癌标本临床病理资料
mT代表有肝转移的大肠癌原发灶组织;T代表无肝转移大肠癌组织;1~4为标本序号
1.2激光捕获显微切割与微量RNA提取 标本取出后,用冰冻切片机(德国徕卡仪器公司生产,型号:CM1850 UV)行连续切片,厚度约7 μm,将切片放在56 ℃烘烤过夜,HE染色,室温待标本干燥后采用激光显微切割机(Arctururs公司生产,型号:Pix Cell Ⅱ LCM)切割,分离出标本中的间质组织。显微切割时间不能超过30 min,以免RNA降解。使用Trizol试剂(英杰公司提供,批号:15596026)进行标本微量RNA提取。使用RNeasy Mini Kit(Qiagen公司生产,型号:74104)纯化RNA,甲醛变性琼脂糖凝胶电泳检测RNA的浓度。根据检测结果,质量合格的RNA进入下一步实验。
1.3RNA线性扩增、荧光标记和芯片杂交 质检合格的RNA样本,采用单标快速扩增荧光标记试剂盒(安捷伦公司生产,批号:0006081570)进行互补核糖核酸(complementary ribonucleic acid,cRNA)合成,行线性扩增,Cy3单色荧光标记,用紫外分光光度计(安捷伦公司生产,型号:ND-1000)检测标记后的cRNA质量和荧光标记率,当RNA溶液的A260/A280比值范围在1.8~2.1之间时,说明RNA纯度好。检测合格的标志物与安捷伦人全基因组表达谱芯片(4×44K 2.0)杂交,洗涤。
1.4芯片检测资料的分析 采用安捷伦微阵列扫描仪(安捷伦公司生产,型号:G2505B)扫描芯片,将安捷伦芯片特征提取软件读出的荧光值导入Agilent Genespring GX软件中进行数据分析。数据经过标准化后得出大肠癌伴肝转移原发灶间质和不伴肝转移大肠癌癌灶间质标记的信号比值(倍数变化),即为该基因组在大肠癌伴肝转移原发灶间质和不伴肝转移大肠癌癌灶间质中变化情况。最后经过T-test检验,筛选出倍数变化≥2的基因为表达显著上调基因,倍数变化≤0.5为表达显著下调基因。同时将所有差异性表达基因导入Agilent Genespring GX软件后,得出基因本体学分析和通路分析结果。
1.5实时定量聚合酶链反应验证4个基因的表达 利用激光捕获显微切割提取4例大肠癌伴肝转移原发灶及4例大肠癌不伴肝转移癌灶的间质组织,使用Trizol试剂(英杰公司提供,批号:15596026)进行标本微量RNA提取。对表达上调骨膜蛋白(Periostin)基因、胰岛素样生长因子2(insulin-like growth factor-2,IGF-2)基因和表达下调的过氧化物酶体增殖活化受体γ共激活因子(peroxisome proliferator-activated receptor-γ coactivator,PGC)、趋化因子配体21(chemokine ligand 21,CCL21)基因进行验证。
2 结 果
2.1激光捕获显微切割后的组织 激光捕获显微切割后,间质成功地从组织中分离出来。如图所示,图1-1(见封三)为其中1例伴肝转移大肠癌间质切割后的剩余组织;图1-2(见封三)为该例伴肝转移大肠癌切割下来的间质;图1-3(见封三)为其中1例不伴肝转移大肠癌间质切割后的剩余组织;图1-4(见封三)为该例不伴肝转移大肠癌切割下来的间质。
2.2甲醛变性琼脂糖凝胶电泳鉴定RNA质量 由于通过激光捕获显微切割获得的目的细胞数量有限,RNA产量较低,故点样量相对偏少RNA变性琼脂糖凝胶电泳,出现28S和18S两条带,且28S带密度约为18S带密度的2倍,几乎未出现其他混杂带(图2),据此可判断RNA质量好,可以进入下一步的实验。
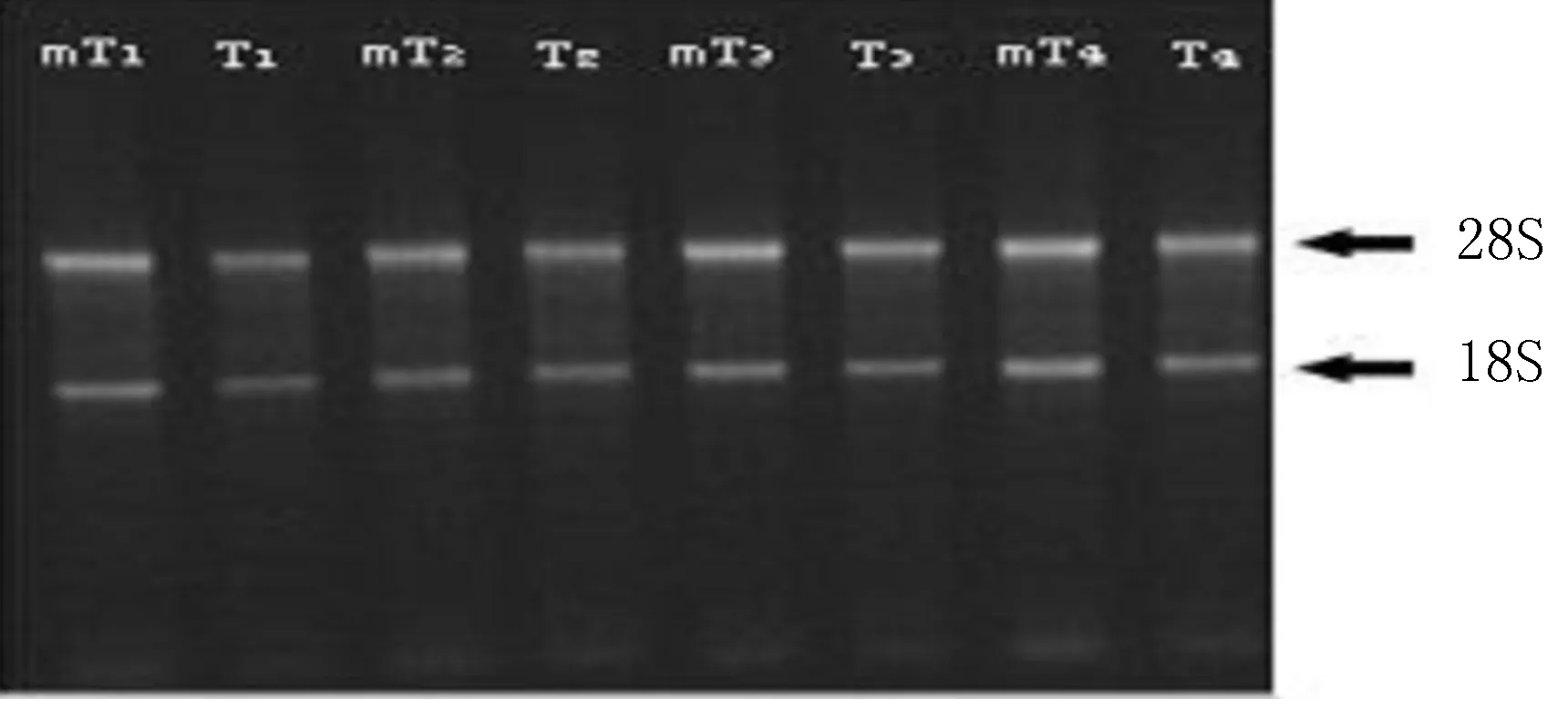
mT:伴有肝转移的大肠癌原发灶间质细胞;T:不伴肝转移大肠癌组织的间质细胞;1~4:标本编号
图2微量RNA的变性琼脂糖凝胶电泳
2.3荧光标记的cRNA定量分析 激光捕获显微切割所得的总RNA经过线性扩增,紫外分光光度计检测表明所得的cRNA量为1.70~1.86 μg,大肠癌伴肝转移原发灶间质和不伴肝转移大肠癌癌灶间质组织的A260/A280比值介于1.9~2.1之间,说明RNA纯度高,荧光标记效率在9 pmol/μg以上可参加杂交反应,RNA基本信息见表2。质量合格,可进入下一步实验。
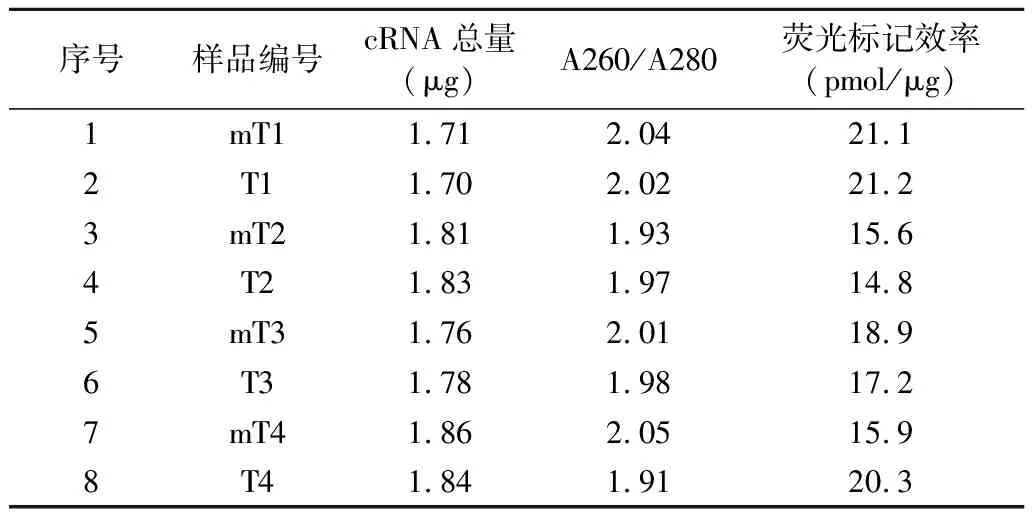
表2 大肠癌RNA样品基本信息
mT:伴有肝转移的大肠癌原发灶间质细胞;T:不伴肝转移大肠癌组织的间质细胞
2.4芯片检测结果 用Cy3分别标记大肠癌伴肝转移原发灶间质和不伴肝转移大肠癌癌灶间质,与芯片杂交后扫描图像,可以看到空白对照点无信号,阴性对照点有弱信号,阳性对照点为强信号。经Agilent Genespring GX软件分析,背景信号噪音低,证实该实验可靠。用大肠癌伴肝转移原发灶间质和不伴肝转移大肠癌癌灶间质的荧光信号作散点图,大部分聚集在一个以45°对角线为中心的区域里,表示信号差异在0.5~2.0之间,所有差异性基因均满足P<0.05(图3)。
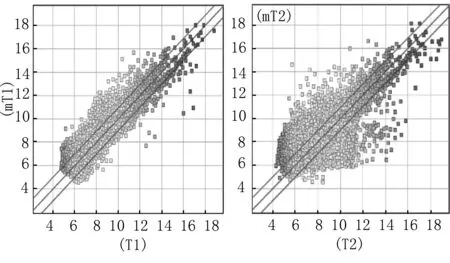
图3-1 mT1 VS T1 图3-2 mT2 VS T2
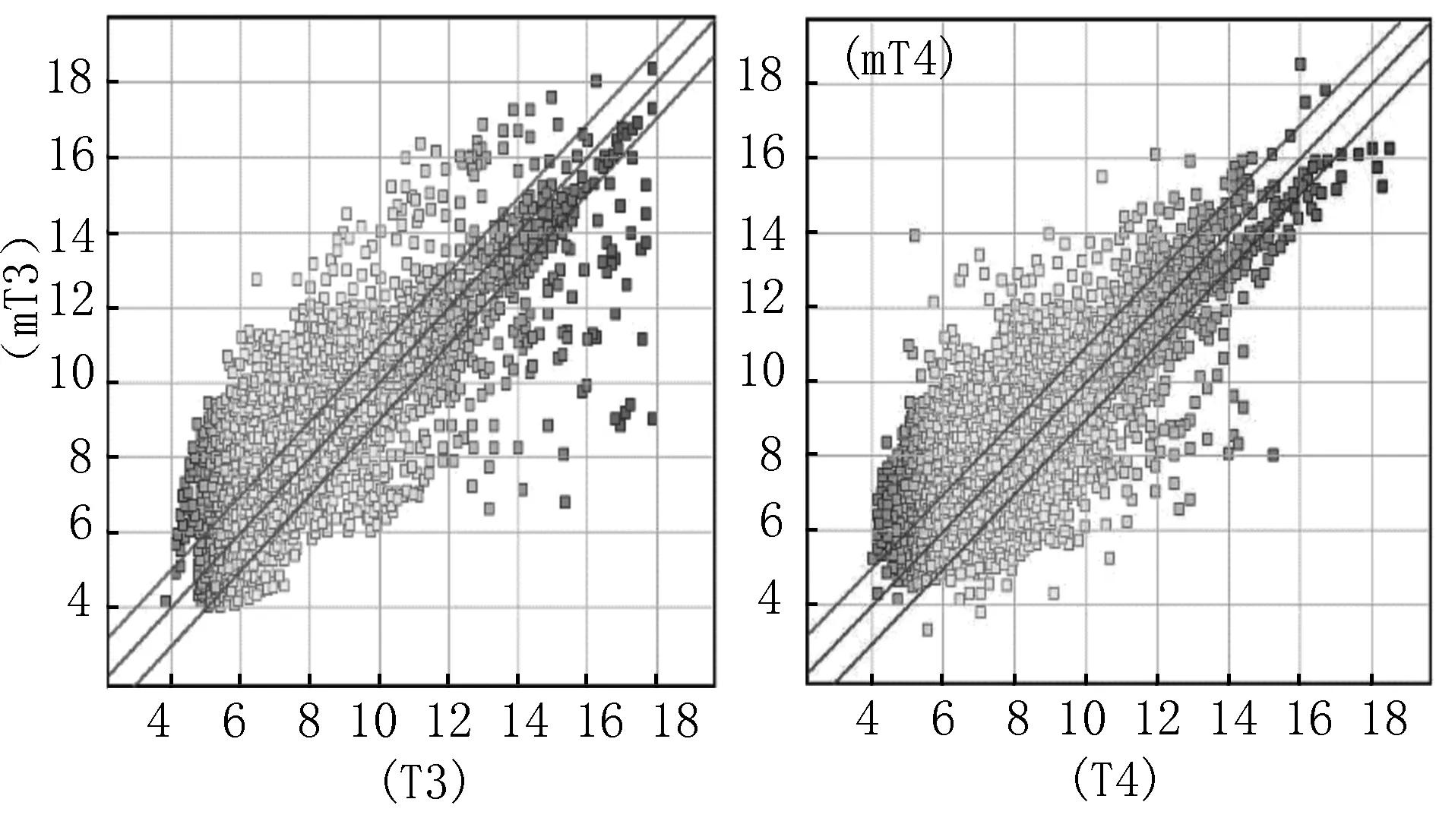
图3-3 mT3 VS T3 图3-4 mT4 VS T4
图3大肠癌肝转移间质差异表达基因的散点图其中位于三条基线之间的为表达无显著差异的基因,位于最上层基线之上的为上调基因,位于最下层基线之下的为下调基因
2.5生物学信息分析 依荧光素大肠癌伴肝转移原发灶间质/不伴肝转移大肠癌癌灶间质比值(倍数变化)>2.0或<0.5的数据项差异表达,共筛选出1948条基因发生差异表达,其中上调的有1266条,下调的有682条,将这些基因按基因本体论分析分子功能进行分类,发现这些差异表达基因与细胞分化、酶活性调节,信号转导及基因转录、翻译调节等有关。按通路分析,发现这些差异基因主要参与细胞外基质受体相互作用、局部黏附、细胞黏附分子、抗原过程和呈递、细胞因子间相互作用、转化生长因子β信号通路等通路。
2.6实时定量聚合酶链反应验证结果 基因Periostin、IGF-2在肝转移的大肠癌间质中均高表达,基因PGC、CCL21在肝转移的大肠癌间质中均低表达。表3显示各基因的引物和产物。上述结果与基因芯片的表达结果是一致的(表4),说明基因芯片结果可靠。

表3 引物列表
GAPDH:甘油醛-3-磷酸脱氢酶;Periostin:骨膜蛋白; IGF-2:胰岛素样生长因子2; PGC:过氧化物酶体增殖活化受体γ共激活因子;CCL21:趋化因子配体21

表4 样品的待测基因相对含量表
mT:有肝转移的大肠癌间质组织;T:无肝转移的大肠癌间质组织;mT/T代表基因的相对比值 GAPDH:甘油醛-3-磷酸脱氢酶;Periostin:骨膜蛋白;IGF2:胰岛素样生长因子;PGC:过氧化物酶体增殖活化受体γ共激活因子;CCL21:趋化因子配体21
3 讨 论
人类的大部分恶性肿瘤都起源于上皮细胞,在正常情况下,起源于上皮细胞层的恶性肿瘤与起支持作用的间质细胞被基底膜分隔。长期以来学者们都认为上皮细胞恶性肿瘤只与上皮细胞相关,其治疗方案也只针对上皮细胞本身。然而恶性肿瘤的进展不仅有上皮细胞的癌症相关变化,作为肿瘤生长微环境的间质细胞在上皮细胞肿瘤的进展中也起了重要的作用[4]。目前上皮与间质细胞在肿瘤进展中的相互作用主要有两种学说:一种是间质细胞首先发生异常进而导致上皮细胞的变异,另一种是变异的上皮细胞通过旁分泌的方式引起间质的肿瘤相关变化[5]。间质中存在着多种细胞:由内皮细胞、平滑肌细胞、周皮细胞组成的脉管系统为组织输送氧气及营养物质[6],由趋化因子及细胞因子募集的炎性细胞及免疫细胞同时有致癌和抑癌作用[7],在肿瘤的生长与转移过程中,间质中处于静息状态的纤维母细胞变为活化的纤维母细胞,是上皮与间质旁分泌信号通路的主要调控者[8]。
本研究结合激光捕获纤维切割和基因芯片两种技术筛选出了与大肠癌肝转移相关的肠癌间质基因共1948条,分别为1266条上调基因及682条下调基因。这些基因与细胞分化、酶活性调节、信号转导、细胞因子间相互作用等相关。并通过实时定量聚合酶链反应验证基因芯片结果,证实基因芯片结果可靠。
研究表明,在乳腺癌[9]、前列腺癌[10]、Wilms瘤[11]中 IGF-2双等位基因不仅在肿瘤细胞高表达,与肿瘤邻接的组织中也有一定程度的表达,这些研究提示在肿瘤的进展过程中,IGF-2基因不仅于上皮细胞中高表达,间质细胞可能也会出现高表达。关华鹤[12]研究表明大肠癌组织和癌旁正常组织均出现IGF-2高表达,且大肠癌中IGF-2的高表达与淋巴结转移呈正相关。这表明IGF-2与结直肠癌的肝转移密切相关,本研究显示伴有肝转移的大肠癌间质中IGF-2表达显著高于不伴肝转移大肠癌间质,提示IGF-2于间质中高表达是大肠癌肝转移的风险因素,其机制还有待进一步研究。
Bao等[13]研究发现Periostin基因在80%的原发结肠癌组织中表达,并在所有肝转移灶组织中表达,且肝转移灶中Periostin基因的表达远高于原发结肠癌组织,这表明Periostin基因高表达与结肠癌肝转移有密切联系。Kikuchi等[14]通过免疫组化和电镜证实Periostin由结肠腺周间质和结肠癌相关的间质细胞分泌。这些研究提示间质中Periostin基因高表达与大肠癌肝转移有着密切的联系,本实验结果应证了这一点,也进一步说明Periostin确实是在间质中表达的基因。
Liang等[15]将PGC-1α基因导入小鼠间质细胞,使该基因于间质高表达,发现导入PGC-1α基因后间质线粒体形成与清除氧自由基的作用增强,这提示PGC-1基因于间质中的表达情况也影响着肿瘤的预后,且PGC-1基因表达下降的致癌作用可能与其降低细胞能量代谢有关。目前研究发现PGC-1的低表达存在于人结肠癌、前列腺癌、乳腺癌组织中[16-18]。然而,间质中PGC-1基因的表达情况与大肠癌肝转移目前未见报道。本研究结果提示PGC-1在大肠癌肝转移原发灶间质中低表达,表明PGC-1在大肠癌发生,发展中可能有抑癌作用,还需进一步研究。
Yousefieh等[19]发现,使小鼠前列腺癌间质高表达CCL21基因,利用CCL21的趋化功能,使树突状细胞、T细胞等免疫细胞聚集于肿瘤间质可以抑制肿瘤发展和转移,其中树突状细胞作用于记忆性T细胞和初始T细胞,使其变为具有效应的T细胞,可以直接杀死肿瘤细胞。Mumtaz等[20]于2008的研究显示,大肠癌患者体内的CCL21较正常人呈明显的低水平表达状态。可以推断,大肠癌间质中CCL21基因的表达必然和肝转移有关,本实验利用基因芯片筛选到的大肠癌肝转移间质差异表达基因中CCL21与不伴肝转移肠癌间质相比低水平表达,提示CCL21有望成为大肠癌肝转移诊断及免疫治疗的分子标志物。
本研究联合应用激光显微切割与基因芯片技术成功构建大肠癌肝转移间质差异表达基因,并用实时定量聚合酶链反应验证了基因芯片的准确性。以上多个差异表达基因,在以往大肠癌肝转移发生机制研究中报道较少,其在大肠癌肝转移中的明显高表达或低表达,说明它们在大肠癌肝转移癌变过程中可能起了较大作用,至于其具体作用机制尚需进一步研究。下一步研究将从基因组、蛋白质组水平上对重点基因进行大样本检测,以确定大肠癌肝转移发生发展的关键分子机制、诊断和治疗靶点。
[1] Chaffer CL,Weinberg RA.A perspective on cancer cell metastasis[J].Science,2011,331(6024):1559-1564.
[2] Gumbiner BM.Regulation of cadherin-mediated adhesion in morphogenesis[J].Nat Rev Mol Cell Bio,2005,6(8):622-634.
[3] Su J,You P,Li WL,etal.The existence of multipotent stem cells with epithelial-mesenchymal transition features in the human liver bud[J].Int J Biochem Cell B,2010,42(12):2047-2055.
[4] Bissell MJ,Radisky D.Putting tumours in context[J].Nat Rev Cancer,2001,1(1):46-54.
[5] Polyak K,Haviv I,Campbell IG.Co-evolution of tumor cells and their microenvironment[J].Trends Genet,2009,25(1):30-38.
[6] Lohela M,Bry M,Tammela T,etal.VEGFs and receptors involved in angiogenesis versus lymphangiogenesis[J].Curr Opin Cell Biol,2009,21(2):154-165.
[7] Muller-Hubenthal B,Azemar M,Lorenzen D,etal.Tumour biology:tumour-associated inflammation versus antitumor immunity[J].Anticancer Res,2009,29(11):4795-4805.
[8] Lorusso G,Ruegg C.The tumor microenvironment and its contribution to tumor evolution toward metastasis[J].Histochem Cell Biol,2008,130(6):1091-1103.
[9] Douc-Rasy S,Barrois M,Fogel S,etal.High incidence of loss of heterozygosity and abnormal imprinting of H19 and IGF2 genes in invasive cervical carcinomas.Uncoupling of H19 and IGF2 expression and biallelic hypomethylation of H19[J].Oncogene,1996,12(2):423-430.
[10] Jarrard DF,Bussemakers MJ,Bova GS,etal.Regional loss of imprinting of the insulin-like growth factor II gene occurs in human prostate tissues[J].Clin Cancer Res,1996,1(12):1471-1478.
[11] Okamoto K,Morison IM,Taniguchi T,etal.Epigenetic changes at the insulin-like growth factor II/H19 locus in developing kidney is an early event in Wilms tumorigenesis[J].Proc Natl Acad Sci USA,1997,94(10):5367-5371.
[12] 关华鹤.大肠癌中IGF2印记丢失与淋巴结转移关系[D].沈阳:中国医科大学,2009.
[13] Bao S,Ouyang G,Bai X,etal.Periostin potently promotes metastatic growth of colon cancer by augmenting cell survival via the Akt/PKB pathway[J].Cancer Cell,2004,5(4):329-339.
[14] Kikuchi Y,Kashima TG,Nishiyama T,etal.Periostin is expressed in pericryptal fibroblasts and cancer—associated fibroblasts in the colon[J].J Histochem Cytochem,2008,56(8):753-764.
[15] Liang H,Bai Y,Li Y,etal.PGC-1α-Induced Mitochondrial Alterations in 3T3 Fibroblast Cells[J].Ann N Y Acad Sci,2007,1100:264-279.
[16] Jiang WG,Douglas-Jones A,Mansel RE.Expression of peroxisome-proliferator activated receptor-gamma(PPARγ)and the PPARγ co-activator,PGC-l,in human breast cancer correlates with clinical outcomes[J].Int J Cancer,2003,106(5):752-757.
[17] Feilchenfeldt J,Bnundler MA,Soravia C,etal.Peroxisome proliferator-activated receptors(PPARs) and associated transcription factors in colon Cancer:Reduced expression of PPARγ-coactivator l(PCG-1)[J].Cancer Lett,2004,203(1):25-33.
[18] Jiang WG,Davies G,Kynaston H,etal.Does the PGC-1/PPARγ pathway play a role in Com-1/p8 mediated cell growth inhibition in prostate cancer?[J].Int J Mol Med,2006,18(6):1169-1175.
[19] Yousefieh N,Hahto SM,Stephens AL,etal.Regulated expression of ccl21 in the prostate tumor microenvironment inhibits tumor growth and metastasis in an orthotopic model of prostate cancer[J].Cancer Microenvironment,2009,2(1):59-67.
[20] Mumtaz M,Wfigsiiter D,LofgrenS,etal.Decreased expression of the chemokine CCL21in humancolorectal adenocarcinomas[J].Oncol Rep,2009,21(1):153-158.
