PPARγ磷酸化与非磷酸化的研究进展
2014-03-27综述审校
宋 扬(综述),吴 荣(审校)
(中国医科大学附属盛京医院肿瘤科,沈阳 110021)
过氧化物酶增殖活化受体(peroxisome proliferator-activated receptors,PPAR)是一类由配体激活的核转录因子,属于Ⅱ型核受体超家族。由于这类新型的核受体可以被过氧化物酶体增殖剂激活,将其命名为PPAR。PPAR能够识别内源性或外源性的特异性配体,发生激活并转录一系列靶基因,从而参与众多生理功能的调控。目前认为PPAR共包括3种亚型,即α、β/δ、γ。随着研究的深入,发现PPARγ与多种疾病密切相关,如糖尿病、肿瘤、动脉粥样硬化等[1]。PPARγ的转录后修饰(磷酸化、乙酰化、泛素化等)也越来越引起人们的关注。
1 PPARγ简介
1.1PPARγ PPAR是配体依赖的核受体超家族的成员之一,包括三个相近同源基因的亚型PPARα(NR1C1)、PPARβ/δ(NR1C2)和PPARγ(NR1C3)。与其他核受体相似,PPARγ主要包含以下四个不同的功能结构域:A/B、C、D和 E/F[1]。N端非配体依赖的转录活化域(A/B区),亦称为激活功能1(activation function 1,AF-1),主要负责PPARγ的磷酸化[2]。DNA结合域或称为C区可以促进靶基因启动子区PPARγ与过氧化物酶体增殖物反应元件的结合[3]。D区是辅助因子结合区域。E区,也称配体结合域(ligand-binding domain,LBD),负责配体特异性及PPAR的激活从而增加靶基因的表达[4]。通过PPARγ辅助因子的集聚来辅助基因转录过程是通过配体依赖的AF-2实现的,位于E/F区。E/F区也是与配体形成二聚体的区域(图1)[4]。
PPARγ有3个异构体,分别为PPARγ1、PPARγ2和PPARγ3[5]。根据组织的不同,PPARγ的表达也有不同。PPARγ1分布于大部分组织,而PPARγ2仅局限于脂肪组织,PPARγ3在巨噬细胞、大肠及白脂肪组织中表达丰富[5-6]。
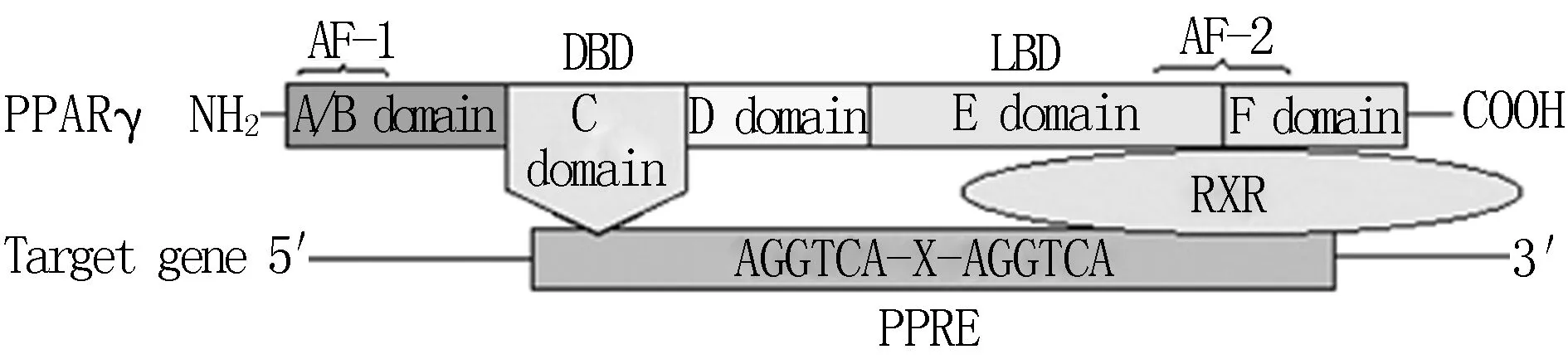
PPARγ:过氧化物酶体增殖物激活受体γ;AF-1:配体非依赖性激活结构域; DBD:DNA结合结构域;LBD:配体结合结构域;AF-2:配体依赖性激活结构域;RXR:视黄酸X受体;PPRE:过氧化物酶体增殖反应元件
图1PPARγ的结构和活化图
1.2PPARγ的转录后修饰 机体可以从不同层次上对PPARγ转录活性进行调控,包括蛋白表达水平、配体以及转录辅助因子等。PPARγ的AF-1区域负责各种各样的蛋白翻译后修饰,这是机体调节PPARγ转录活性的一种重要方式。已知的PPARγ转录后修饰包括磷酸化、蛋白化、乙酰化和泛素化等。它们不仅能够改变蛋白构象,调控蛋白相互作用,而且可以改变受体与配体间的亲和力,从而调控下游基因的转录。同时,PPARγ的蛋白翻译后修饰与一些疾病(如糖尿病、肿瘤等)密切相关。因而,对PPARγ蛋白翻译后修饰的研究有重要意义。
2 PPARγ的磷酸化
磷酸化修饰是PPARγ第一个被鉴定的翻译后修饰方式。在不同的细胞和刺激下,PPARγ发生磷酸化位点也各不相同,产生的生物学效应也多种多样。
2.1丝裂原活化蛋白激酶 在体内外实验中发现PPAR的激活可以通过已知的丝裂原活化蛋白激酶(mitagen-activated protein kinases,MAPK)的三种途径来实现磷酸化过程,分别是细胞外信号调节激酶、p38、c-Jun氨基端激酶[7-8]。关于PPARγ磷酸化的第一个研究是通过观察MAPK诱导的生长因子(包括表皮生长因子、成纤维细胞生长因子、血小板源性生长因子)能够抑制脂肪形成发现的。Ser112突变成α-丙氨酸既阻止了生长因子刺激Ser112位点的磷酸化,也抑制了血小板源性生长因子和表皮生长因子在PPARγ转录活性中的作用[9]。在AF-1功能域上PPARγ在Ser112位点由MAPK介导的磷酸化可调节配体与C端LBD的结合抑制PPARγ的活性(图2)[10]。
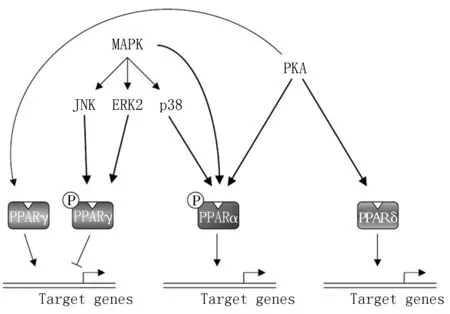
MAPK:丝裂原活化蛋白激酶;PKA:cAMP依赖蛋白激酶;JNK:c-Jun氨基端激酶;ERK:细胞外信号调节激酶;PPAR:过氧化物酶体增殖物激活受体
图2包含PPAR家族转录活性的调节及磷酸化的激酶途径
2.2细胞周期素依赖的蛋白激酶5 除A/B结构域外,最新研究发现,PPARγ位于DNA结合结构域和LBD之间铰链区的S273可以被细胞周期素依赖的蛋白激酶5(cyclin-dependent kinase 5,Cdk5)磷酸化[11]。Cdk5依赖的磷酸化被认为在神经生物学和神经变性疾病方面有重要作用[12],但这种激酶也在非神经组织中表达,如能够分泌胰岛素的胰岛β细胞[13]及脂肪细胞[11]。Cdk5的活性可以在肥胖及胰岛素抵抗的状态下通过肿瘤坏死因子α在脂肪组织中上调来调节[14-15]。在脂肪组织中由Cdk-5介导的PPARγ的磷酸化被认为与肥胖相关[11]。更重要的是,用有高度亲和力的PPARγ配体胰岛素增敏药物噻唑烷二酮处理,可以增加PPARγ的转录活性,并减少在Ser273位点上PPARγ2 Cdk5依赖的磷酸化。然而,一般来说PPARγ2在Ser273位点上Cdk5的磷酸化不会调节PPARγ的转录活性,但会改变在脂肪细胞中重要靶基因代谢的表达。而且,不如噻唑烷二酮有效,但有胰岛素增敏效果的PPARγ激动剂,也能抑制Cdk5介导的PPARγ2磷酸化。脂肪细胞中缺乏核辅阻遏物(NCoR)的转基因小鼠在脂肪生成,减少炎症,增强全身胰岛素敏感性和显著减少Cdk5介导的Ser273位点PPARγ磷酸化激活表现出改善。这些研究表明,NCoR可以作为一种适应蛋白来增加Cdk5结合并磷酸化PPARγ的能力[16]。也就是说,由Cdk5介导的Ser273位点的PPARγ磷酸化是控制全身胰岛素敏感性的一个关键,基于这一点,新一类的抗糖尿病药物可能诞生。
2.3其他 最近发现,Cdk7和Cdk9能够修饰Ser112增加PPARγ的活性。Cdk9的异构体p55在脂肪生成过程中高度上调,人们发现它能够在体外与AF-1区域的PPARγ结合并于Ser112位点蛋白磷酸化[17]。Cdk9的过表达能够增加PPARγ介导的转录过程,刺激脂肪细胞分化。Cdk7激酶是一般转录因子Ⅱ H复合体的基本转录因子的亚基,在DNA修复和转录上有重要作用[18]。Cdk7介导的磷酸化刺激了PPARγ的转录活性,因为PPARγ靶基因的表达水平相对于野生型大鼠来说在着色性干皮病互补集团D缺乏的大鼠上低表达。而有报道指出,Cdk7介导的磷酸化抑制了PPARγ促脂肪细胞分化的能力,表明磷酸化调控PPARγ转录活性的模式十分复杂,特定的细胞中和特定的刺激下,参与的激酶类型不同,招募的转录辅助因子也不同,从而导致PPARγ活性的上调或下降[18]。
此外,细胞周期蛋白D3可以与PPARγ相互作用,招募并激活Cdk6,进而使A/B结构域磷酸化,从而促进脂肪细胞生成[19]。PPARγ A/B结构域上的S16与S21位点可以被酪蛋白激酶Ⅱ磷酸化,从而促进其从细胞核向细胞质的转运[20]。在肾小管细胞中胰岛素和C-肽可以激活PPARγ,此效应依赖于磷脂酰肌醇3激酶介导的A/B区磷酸化[21]。
3 PPARγ的非磷酸化
3.1PPARγ与配体 PPARγ与维甲酸X受体α以异源二聚体的形式存在,通过结合到靶基因启动子区的特异反应元件上调控靶基因的转录。当其未与配体结合时,二聚体招募许多包含组蛋白脱乙酰基酶活性的辅助抑制因子,如核受体辅助抑制因子、维甲酸和甲状腺激素受体沉默调节子等结合到靶基因上,使得靶基因的转录受到抑制;当有特异性配体结合PPARγ时,上述辅助抑制因子发生泛素化并被降解辅助激活因子包括类固醇受体辅助活化因子1和PPAR结合蛋白(其具有组蛋白乙酰化酶活性)被招募并结合到PPARγ/维甲酸X受体α异源二聚体上,引起组蛋白乙酰化并导致核小体结构重塑,从而招募RNA聚合酶Ⅱ,激活下游参与脂肪生成、胰岛素敏感性调节、脂质代谢和炎性反应的靶基因转录。研究表明,PPARγ主要通过配体依赖的转录激活机制,调节靶基因的转录活性,它可以通过配体依赖的转录调控抑制核因子κB、信号转导子和转录激活子、环腺苷酸效应元件结合蛋白和活化蛋白质1等的表达来抑制炎性细胞因子的表达及分泌,阻断炎性细胞的黏附和迁移,并减弱血管收缩和血栓形成,从而在抗炎抗增殖及抗动脉粥样硬化过程中发挥重要作用[22]。
3.2PPARγ与炎性分子 PPAR可以通过调节内皮细胞、平滑肌细胞、单核细胞/巨噬细胞及T细胞中的趋化因子、趋化因子受体及黏附分子来干扰炎症应答的不同步骤。分子学研究表明,PPARγ可以在体外干扰炎症途径,如核因子κB与p50和p65的生理反应。格列酮可抑制c-fos在血管平滑肌细胞的表达,这可能是PPARγ激活蛋白1抑制途径的另一种机制[23]。PPARγ通过干扰信号转导因子和转录激活因子1,激活蛋白1及核因子κB途径来抑制诱导性一氧化氮合酶的表达[24]。在T淋巴细胞中,PPARγ配体通过这种核受体与活化T细胞核因子的相互作用减少白细胞介素2的分泌。
4 PPARγ的磷酸化与疾病
4.1PPARγ的磷酸化与糖尿病 PPARγ是重要的糖尿病相关基因之一,迄今为止,在糖尿病及相关代谢疾病中已发现了PPARγ的多种突变。机体的胰岛素耐受可以通过PPARγ的磷酸化调控其转录活性来调控。实验表明,PPARγ S112A转基因小鼠在高脂喂食下能够维持较高的胰岛素敏感性,体质量却不会显著增加,这与非磷酸化形式的PPARγ能有效上调脂连蛋白的表达相关[25]。在体内,酪氨酸激酶1的下游可以负调控Ras/甲基乙基酮/细胞外信号调节激酶级联反应,从而间接调控PPARγ磷酸化[26]。PPARγ配体和激动剂罗格列酮可诱导Cdk5介导的S273位磷酸化,同时改善胰岛素耐受,而S112位磷酸化不受配体影响。临床数据也显示,糖尿病患者PPARγ(S273)的磷酸化状态与胰岛素敏感性呈显著负相关[27]。这些结果不仅让人们对PPARγ配体的作用机制有了新的认识,同时也提示,Cdk5介导的PPARγ S273位磷酸化可作为2型糖尿病治疗的新靶点。
4.2PPARγ与肿瘤 PPARγ在多种肿瘤细胞(如结肠癌、乳腺癌、肝癌及肺癌)中均有表达,它通常被认为是抑癌基因,但其在肿瘤发展的功能中所起的作用可能与PPARγ的翻译后修饰有一定联系。PPARγ配体通常能够抑制肿瘤的生长,但在呈递抗原细胞基因突变的结肠癌中反而促进肿瘤细胞增殖,这与PPARγ介导的β联蛋白调控有部分关联,也可能与配体诱导的PPARγ翻译后修饰有关。有实验表明,在乳腺癌MDA-MB-231细胞中,过表达小细胞蛋白β可以增加Cdk9介导的PPARγ1 S82的磷酸化,并促进其下游相关靶基因的转录,从而抑制肿瘤的发展[28]。在结肠癌中,促胃液素可以刺激肿瘤细胞的增殖,此效应与细胞外信号调节激酶,成纤维细胞生长因子受体介导的PPARγ磷酸化及蛋白酶体降解相关;如果将磷酸化位点进行突变(S84A)则可逆转促胃液素的效应[28]。综上所述,PPARγ的磷酸化修饰在肿瘤的发生、发展中有重要的调控作用,从而利用这一点,PPARγ的磷酸化修饰也能作为肿瘤治疗的靶点。
5 小 结
目前,肥胖症、高血压、高血脂、肿瘤等已严重威胁人类的健康,而PPARγ的生物活性与这些疾病的发生、发展有密切的联系。但有许多PPARγ的信号通路目前还不清楚,参与转录后修饰的蛋白酶所调控的蛋白相互作用以及下游靶基因仍是目前研究的热点,通过对信号通路的调控及靶基因影响的研究,开发针对翻译后修饰的配体药物,有望对相关疾病的预防和治疗起到重要作用。
[1] Desvergne B,Wahli W.Peroxisome proliferator-activated receptors:nuclear control of metabolism.Peroxisome proliferator-activated receptors:nuclear control of metabolism[J].Endocr Rev,1999,20(5):649-688.
[2] Werman A,Hollenberg A,Solanes G,etalLigand-independent activation domain in the N terminus of peroxisome proliferator-activated receptor gamma(PPARgamma).Differential activity of PPARgamma1 and-2 isoforms and influence of insulin[J].J Biol Chem,1997,272(32):20230-20235.
[3] Kliewer SA,Umesono K,Noonan DJ,etal.Convergence of 9-cis retinoic acid and peroxisome proliferator signalling pathways through heterodimer formation of their receptors[J].Nature,1992,358(6389):771-774.
[4] Berger J,Moller DE.The mechanisms of action of PPARs[J].Annu Rev Med,2002,2(53):409-435.
[5] Fajas L,Fruchart JC,Auwerx J.PPARgamma3 mRNA:a distinct PPARgamma mRNA subtype tran-scribed from an independent promoter[J].FEBS Lett,1998,438(1/2):55-60.
[6] Braissant O,Foufelle F,Scotto C,etal.Differential expression of peroxisomeproliferator-activated receptors(PPARs):tissue distribution of PPAR-alpha,-beta,and-gamma in the adult rat[J].Endocrinology,1996,137(1):354-366.
[7] Hu E,Kim JB,Sarraf P,etal.Inhibition of adipogenesis through MAP kinase-mediated phosphorylation of PPARgamma[J].Science,1996,274(5295):2100-2103.
[8] Camp HS,Tafuri SR,Leff T.c-Jun N-terminal kinase phosphorylates peroxisome proliferator-activated receptor-gamma1 and negatively regulates its transcriptional activity[J].Endocrinology,1999,140(1):392-397.
[9] Camp HS,Tafuri SR.Regulation of peroxisome proliferator-activated receptor gamma activity by mitogen-activated protein kinase[J].J Biol Chem,1997,272(16):10811-10816.
[10] Shao D,Rangwala SM,Bailey ST,etal.Interdomain communication regulati ng ligand binding by PPAR-gamma[J].Nature,1998,396(6709):377-380.
[11] Choi JH,Banks AS,Estall JL,etal.Anti-diabetic drugs inhibit obesity-linked phosp horylation of PPARgamma by Cdk5[J].Nature,2010,466(7305):451-456.
[12] Choi JH,Banks AS,Kamenecka TM,etal.Antidiabetic actions of a non-agonist PPARgamma ligand blocking Cdk5-mediated phosphorylation[J].Nature,2011,477(7365):477-481.
[13] Lilja L,Yang SN,Webb DL,etal.Cyclin-dependent kinase 5 promotes insulin exocytosis[J].J Biol Chem,2001,276(36):34199-34205.
[14] Hotamisligil GS,Arner P,Caro JF,etal.Increased adipose tissue expression of tumor necrosis factor-alpha in human obesity and insulin resistance[J].J Clin Invest,1995,95(5):2409-2415.
[15] Utreras E,Futatsugi A,Rudrabhatla P,etal.Tumor necrosis factor-α regulates cyclin-dependent kinase 5 activity during pain signaling through transcriptional activation of p35[J].J Biol Chem,2009,284(4):2275-2284.
[16] Li P,Fan W,Xu J,etal.Adipocyte NCoR knockout decreases PPARgamm a phosphorylation and enhances PPARgamma activity and insulin sensitivity[J].Cell,2011,147(4):815-826.
[17] Iankova I,Petersen RK,Annicotte JS,etal.Peroxisome proliferator-activated receptor gamma recruits the positive transcription elongation factor b complex to activate transcription and promote adipogenesis[J].Mol Endocrinol,2006,20(7):1494-1505.
[18] Zurita M,Merino C.The transcriptional complexity of the TFIIH complex[J].Trends Genet,2003,19(10):578-584.
[19] Sarruf DA,Iankova,Abella A,etal.Cyclin D3 promotes adipogenisis through activation of peroxisome proliferator-activated receptor[J].Mol Cell Biol,2005,25(22):9985-9995.
[20] Knethen AV,Tzieply N,Jennewein C,etal.Casein-kinase-Ⅱ-dependent phosphorylation of PPARγ provokes CRM1-mediated shuttling of PPARγ from the nucleus to the cytosol[J].J Cell Sci,2010,123(Pt 2):192-201.
[21] Al-Rasheed NM,Chana RS,Baines RJ,etal.Ligand-independent activation of peroxisome proliferator-activated receptorγby insulin and C-peptide in kidney proximal tubular cells[J].J Biol Chem,2004,279(48):49747-49754.
[22] Abdelrahman M,Sivarajah A,Thiemermann C.Beneficial effects of PPAR-γligands in ischemia-reperfusion injury,inflammation and shock[J].Cardiovasc Res,2005,65(4):772-781.
[23] Law RE,Meehan WP,Xi XP,etal.Troglitazone inhibits vascular smooth muscle cell growth and intimal hyperplasia[J].J Clin Invest,1996,98(8):1897-1905.
[24] Li M,Pascual G,Glass CK.Peroxisome proliferator-activated receptor gamma-dependent repression of the inducible nitric oxide synthase gene[J].Mol Cell Biol,2000,20(13):4699-4707.
[25] Yang XY,Wang LH,Chen T,etal.Activation of human T lymphocytes is inhibited by peroxisome proliferator-activated receptor gamma(PPARgamma) agonists.PPARgamma co-association with transcription factor NFAT[J].J Biol Chem,2000,275(7):4541-4544.
[26] Hosooka T,Noguchi T,Kotani K,etal.Dok1 mediates high-fat diet-induced adipocyte hypertrophy and obesity through modulation of PPARγphosphorylation[J].Nat Med,2008,14(2):188-193.
[27] Peters JM,Shah YM,Gonzalez FJ.The role of peroxisome proliferator-activated receptors in carcinogesis and chemoprevention[J].Nat Rev Cancer,2012,12(3):181-195.
[28] Chang AJ,Song DH,Michael WM.Attenuation of peroxisome proliferator-activated receptor γ(PPARγ)mediates gastrin-stimulated colorectal cancer cell proliferaion[J].J Biol Chem,2006,281(21):14700-14710.
